Что называют ферментом в биологии
Ферменты
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Функции ферментов
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10 −10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 10 6 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
Простейшим описанием кинетики [ru] односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Структура и механизм действия ферментов
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
В активном центре условно выделяют [8] :
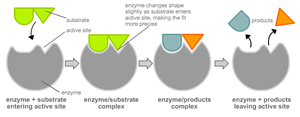
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
В присутствии фермента:
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеров часто сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»
Модель индуцированного соответствия
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь — цепочка последовательных ферментативных реакций. Часто конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи — важный способ поддержания гомеостаза (относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне.
Медицинское значение
Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом [ru] в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма».
Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции.
Ещё шире область использования ферментов в научных исследованиях и в медицине.
Параграф 15 ферменты определение, природа, функции
Параграф 15: ФЕРМЕНТЫ (определение, природа, функции, классификация).
См. сначала п.57-59.
Содержание параграфа:
15. 1. ОПРЕДЕЛЕНИЕ ферментов.
15. 2. ФУНКЦИЯ ферментов в организме и ЗНАЧЕНИЕ ферментов для организма.
15. 3. Недостаточная активность ферментов.
Последствия прекращения работы фермента.
Причины недостаточной активности фермента:
15. 4. Избыточная активность ферментов.
Последствия избыточной активности фермента.
Причины избыточной активности фермента:
15. 5. ЕДИНИЦЫ измерения активности ферментов.
15. 6. Химическая ПРИРОДА ферментов.
15. 7. ИСТОЧНИК ферментов в организме (откуда ферменты берутся в организме).
15. 8. Условия синтеза ферментов в клетках.
15. 9. Условия работы ферментов в клетках.
Кратко: в организме есть белки, способные ускорять (то есть катализировать) химические реакции. Эти белки называются ФЕРМЕНТАМИ.
Подробнее: в организме человека происходят превращения одних веществ в другие,
то есть химические реакции.
Многие реакции протекали бы с очень низкой скоростью,
при которой жизнь организма была бы невозможна,
если бы эти химические реакции не ускорялись специальными веществами,
которые называются катализаторами (ускорителями реакций).
Большинство катализаторов организма являются белками (другими словами, имеют белковую природу).
Такие белковые катализаторы (они же каталитические белки) называются ферментами.
15. 1. Определение ферментов. Что называют ферментами?
15. 2. Функция ферментов в организме
и значение ферментов для организма (нормальной активности ферментов).
Ферменты осуществляют КАТАЛИЗ химических реакций в организме.
То есть ферменты ускоряют химические реакции в организме.
В этом значение ферментов для организма.
Ферменты увеличивают скорость реакций в миллиард и более раз (в 105-1014 раз).
Ферменты ускоряют только те реакции, которые протекают и без помощи ферментов хотя бы с очень низкой скоростью.
Если реакция невозможна (не может протекать без катализатора в принципе даже очень медленно),
то и под влиянием фермента она не может ни ускориться, ни начаться.
То есть ферменты только ускоряют реакции, причём ускоряют только возможные реакции (возможные с точки зрения термодинамики).
Значение ферментов для организма в том, что
без работы ферментов в качестве катализаторов жизнь организма невозможна,
так как без участия ферментов большинство реакций организма
протекали бы с крайне низкой скоростью, что несовместимо с жизнью.
Термины:
Вещество, реакцию превращения которого в другое вещество (в продукт реакции) катализирует фермент,
называется СУБСТРАТОМ фермента.
Вещество, которое образуется в результате химической реакции (из субстрата), называется продуктом реакции.
В обратимых реакциях продукт одной реакции является субстратом обратной реакции и наоборот.
15. 3. Недостаточная активность ферментов.
Последствия прекращения работы фермента:
прекращение работы фермента (недостаточная активность фермента)
приводит к резкому снижению скорости реакции данного фермента
(то есть скорости реакции, которую мог бы катализировать этот фермент),
что приводит к накоплению субстрата реакции
и к дефициту продукта реакции.
Накопление ряда субстратов и дефицит ряда продуктов
нарушают жизнедеятельность организма,
могут ухудшать самочувствие, приводить к развитию заболеваний и к смерти.
Например, накопление такого субстрата, как аммиак (в случае прекращения работы ферментов синтеза мочевины),
или дефицит такого продукта, как АТФ (в случае прекращения работы ферментов, катализирующих реакции синтеза АТФ),
приводят к смерти.
Накопление такого субстрата, как фенилаланин (п.68) может привести к развитию олигофрении.
Но если нет субстрата фермента, то не будет проблем и из-за накопления субстрата реакции. При условии, что можно обойтись без продукта реакции.
Причины недостаточной активности молекул фермента:
Кроме того, может быть недостаточным количество молекул фермента (концентрация фермента в клетке).
Причины дефицита молекул фермента:
1. Снижение скорости синтеза (см. далее).
2. Нарушение транспорта молекул данного фермента в нужную часть клетки или из клетки (нарушение секреции).
3. Повышение скорости расщепления данного белка (протеолиза)
или всех белков клетки (например, при разрушении лизосом).
4. Денатурация белков при нагревании, ацидозе и алкалозе, появлении веществ, вызывающих денатурацию белков.
15. 4. Избыточная активность ферментов.
Последствия избыточной активности фермента:
избыточная активность фермента
приводит к повышению скорости реакции данного фермента
(то есть скорости реакции, которую катализирует этот фермент),
что приводит к дефициту субстрата реакции
и к образованию избытка продукта реакции.
Накопление ряда продуктов и дефицит ряда субстратов
нарушают жизнедеятельность организма,
могут ухудшать самочувствие, приводить к развитию заболеваний и к смерти.
Например, накопление такого продукта, как мочевая кислота
(в случае избыточной активности ферментов синтеза мочевой кислоты),
приводят к развитию ПОДАГРЫ, которая может привести к почечной недостаточности.
Но если нет субстрата фермента, то не будет и проблем из-за избытка продукта.
При условии, что можно обойтись без субстрата и продукта.
Причины избыточной активности молекул фермента:
1. МУТАЦИЯ ГЕНА, кодирующего данный фермент, из-за которой данный фермент становится чрезмерно активным;
мутация может быть врождённой из-за влияния мутагенов на организмы родителей
или приобретённой в течение жизни индивида под влиянием мутагенов.
Для коррекции нужна генотерапия, которая в настоящее время пока не развита.
2. Избыток в пище или воде микроэлемента или витамина,
необходимого для работы этого фермента
(эта причина устраняется снижением поступления этих веществ с водой и пищей).
Например, избыток витамина С может привести к неправильному заживлению ран (слишком быстрому рубцеванию ран), так как приводит к чрезмерной активности ферментов синтеза коллагена.
Кроме того, может образоваться избыток молекул фермента
при повышении скорости синтеза данного фермента или
при снижении скорости расщепления данного фермента.
15. 5. Единицы измерения активности ферментов.
Активность ферментов измеряется в том,
какое количество субстрата превратилось за единицу времени (в продукт)
или какое количество продукта образовалось за единицу времени (из субстрата).
(То есть насколько изменилась концентрация субстрата или продукта за единицу времени).
15. 6. Химическая природа ферментов.
15. 7. Источник ферментов в организме
(откуда ферменты берутся в организме).
Как и все белки организма, ферменты образуются в организме
в результате процесса, который называется СИНТЕЗОМ БЕЛКА.
Синтез белка (и ферментов в том числе) протекает только в клетках.
После синтеза ряд белков может секретироваться (выделяться) из клеток во внеклеточную среду
(например, антибактериальный лизоцим, ферменты плазмы крови и т.д.)
15. 8. Условия синтеза ферментов в клетках.
Для синтеза ферментов (как и других белков) требуются:
1) наличие «сырья» в клетке: БЕЛКОВЫХ АМИНОКИСЛОТ всех 20-ти типов,
2) наличие в клетке ГЕНА, кодирующего данный фермент (первичную структуру фермента, порядок соединения аминокислотных остатков в данной молекуле белка),
3) (иногда) наличие в клетке ВИТАМИНОВ И МИКРОЭЛЕМЕНТОВ (ионов металлов и селена),
4) ряд регуляторов синтеза белков (активаторы транскрипции и т.д.),
5) отсутствие ингибиторов синтеза белков (например, дифтерийного токсина),
6) нормальные условия в клетке: температура, рН и т.д.
Чтобы были все 20 типов аминокислот (для синтеза в клетке ферментов и других белков и веществ),
в пище должны присутствовать в нужных количествах незаменимые аминокислоты
в составе белков таких продуктов, как:
молочные, мясо, рыба, яйца, соя и другие бобовые.
Витамины и минералы тоже поступают в организм в основном в составе пищи (кроме этого, некоторое количество витаминов может синтезироваться и поставляться организму человека микрофлорой кишечника,
витамин Д может синтезироваться в коже под действием света, но не входит в состав белков,
дефицит витамина РР может отчасти компенсироваться синтезом коферментов НАД+ и НАДФН из триптофана при его достатке в пище).
Гены должны быть такими, чтобы кодировать
ферменты с нормальной активностью (не слишком высокой и не низкой),
которые могут регулироваться.
Изменение гена (мутация) может привести
к появлению фермента с низкой или чрезмерной активностью,
что может привести к развитию патологии.
Причиной мутации может стать действие мутагенов:
радиации, химических веществ, вирусов.
Поэтому желательно не засорять биосферу мутагенами.
15. 9. Условия работы ферментов в клетках.
ферменты
Полезное
Смотреть что такое «ферменты» в других словарях:
ФЕРМЕНТЫ — (син. энзимы; франц. диастазы), биол. агенты, катализирующие большинство хим. реакций, лежащих в основе жизнедеятельности клетки и организма. Ряд характерных свойств термолябильность, специфичность действия, высокая каталитическая эффективность,… … Большая медицинская энциклопедия
ФЕРМЕНТЫ — (от лат. fermentum брожение, закваска), энзимы, биокатализаторы, специфич. белки, присутствующие во всех живых клетках и играющие роль биол. катализаторов. Через их посредство реализуется генетич. информация и осуществляются все процессы обмена… … Биологический энциклопедический словарь
ФЕРМЕНТЫ — (лат. Fermentum закваска, от fervere быть горячим). Органические вещества, производящие брожение других органических тел, не подвергаясь сами гниению. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФЕРМЕНТЫ… … Словарь иностранных слов русского языка
ФЕРМЕНТЫ — (от лат. fermentum закваска) (энзимы) биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения веществ в организме, направляя и регулируя тем самым его обмен веществ. По химической природе белки. Ферменты… … Большой Энциклопедический словарь
ФЕРМЕНТЫ — (от латинского fermentum закваска), биологические катализаторы, присутствующие во всех живых клетках. Осуществляют превращения (обмен) веществ в организме. По химической природе белки. В многочисленных биохимических реакциях в клетке участвует… … Современная энциклопедия
ферменты — сущ., кол во синонимов: 2 • биокатализаторы (1) • энзимы (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ферменты — ферменты. См. энзимы. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
ФЕРМЕНТЫ — [fermentum закваска] биокатализаторы белковой природы, вырабатываемые живыми организмами и выполняющие в них важнейшие физиологические функции в сфере процессов обмена веществ. Строго специализированы по характеру выполняемых ими функций.… … Геологическая энциклопедия
Ферменты — (от лат. fermentum закваска), энзимы присутствующие во всех живых клетках белковые катализаторы реакций обмена веществ. Разделяются на эндоферменты (действуют внутри клеток), эктоферменты (в клеточных мембранах) и экзоферменты, выделяемые… … Экологический словарь
Ферменты — представляют собой органические вещества, производимые живыми клетками, они инициируют и регулируют специфические химические реакции внутри или вне живых клеток, при этом химическая структура самих ферментов не подвергается какому либо изменению … Официальная терминология
ферменты — – биокатализаторы, образующиеся в клетках организма и представляющие собой простые и сложные белки … Краткий словарь биохимических терминов