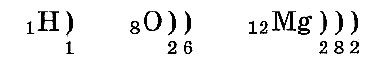Что называют электронным облаком атомной орбиталью энергетическим уровнем
Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.
Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:
Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
Что называют электронным облаком атомной орбиталью энергетическим уровнем
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)
Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
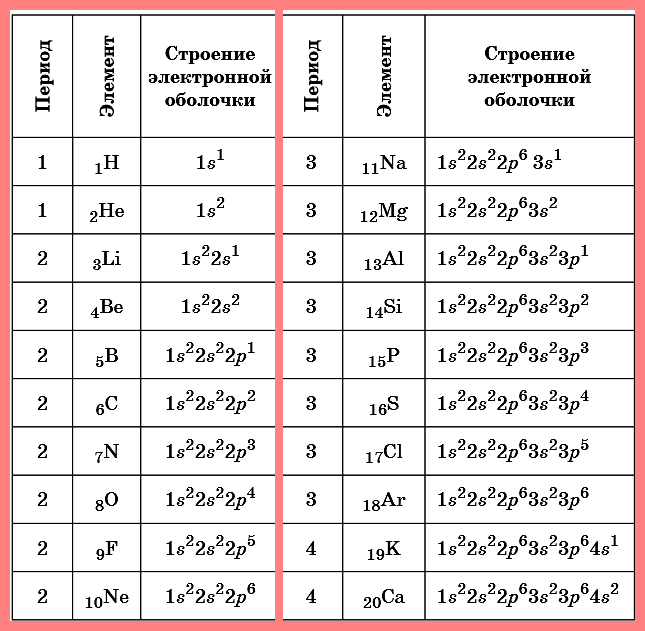
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Строение атома. Модели атома. Атомные спектры
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Строение атома
Первые модели атома.
В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Атомные спектры.
При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же случаев излучение характеризуется несколькими длинами волн. При разложении излучения на монохроматические компоненты получают спектр излучения, где отдельные его составляющие выражаются спектральными линиями. Спектры, получающиеся при излучении свободными или слабо связанными атомами (например, в газах или парах), называют атомными спектрами. Длины волн, соответствующие атомному спектру водорода, определяются уравнением Бальмера
Кванты и модель Бора.
В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (колебания) ν:
В 1910 г. датский ученый Н. Бор, используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n (1,2,3,4, …), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29 · 10 – 13 м, радиус других орбит был равен:
rn = n 2 (5,29 · 10 – 13 ) (3)
Энергия электрона (эВ) зависит от значения главного квантового числа n:
Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже (чем более отрицательна) ее энергия. Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n = 1). Такое состояние называется основным. При переходе электрона на более высокие орбиты атом становится возбужденным. Такое состояние атома неустойчиво. При переходе с верхней орбиты на нижнюю атом излучает квант света, что экспериментально обнаруживается в виде серий атомного спектра. Значения n и m в уравнении (1) соответствуют значениям главных квантовых чисел, с которых электрон переходит (т) и на которые электрон переходит (n).
Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой.
Теория Бора получила экспериментальное подтверждение. Однако она не смогла объяснить поведение электрона в магнитном поле и все атомные спектральные линии. Теория Бора оказалась непригодной для многоэлектронных атомов. Возникла необходимость в новой модели атома, основанной на открытиях в микромире.
Двойственная природа электрона.
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с) λ = 2,21 · 10 – 38 м.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
Квантово – механическая модель атома.
В настоящее время строение атома рассматривается с позиций квантовой или волновой механики, в основе которой лежит представление о двойственной природе электрона: электрон, как и любая частица микромира, обладает одновременно свойствами частицы (массой m и скоростью передвижения v) и свойствами волны (длиной волны ):
Волновая механика описывает движение электрона в атоме как распространение волны по всему объему атома. Каждое мгновение электрон может находиться в любой части пространства вокруг ядра.
Путь, описываемый электроном, сливается в расплывчатое электронное облако, в котором плотность отрицательного заряда соответствует вероятности обнаружения электрона.
Плотность электронного облака максимальна на некотором расстоянии от ядра и характеризует удаленность электрона от ядра и запас его энергии. Состояние электрона в атоме математически описывается волновым уравнением.
Представление об электронном облаке – это квантово-механическая модель электрона в атоме. Понятию «электронное облако» соответствуют также понятия «атомная орбиталь», «квантовая ячейка», «энергетическая ячейка». Электронные облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соответствует определенному энергетическому состоянию электрона.
В многоэлектронных атомах все электроны распределяются по энергетическим уровням (электронным слоям или электронным оболочкам). В пределах энергетического уровня электроны распределяются по подуровням (подоболочкам). Полная характеристика каждого электрона определяется значениями четырех квантовых чисел. Многоэлектронный атом подчиняется принципу Паули (1925 г.): в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел:
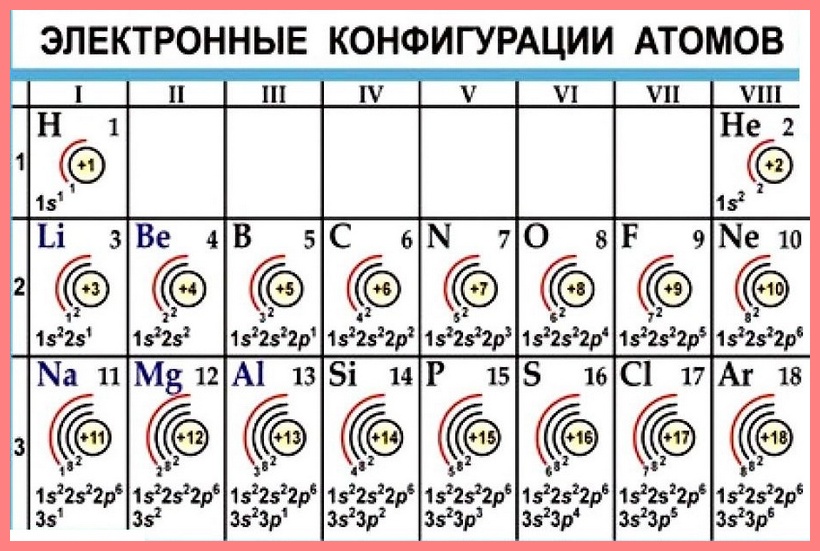
1. Главное квантовое число (n) характеризует энергетический уровень и отражает размеры электронного облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или в буквенном изображении K, L, M, N, O, P, Q…). С увеличением n (удалением электрона от ядра) энергия электрона возрастает. Число энергетических уровней в невозбужденном атоме равно номеру периода, в котором находится элемент в периодической системе. Например, электроны атома натрия распределяются по трем уровням, которым соответствуют значения главного квантового числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетический подуровень и отражает форму электронного облака. Усложнение формы электронного облака связано с возрастанием энергии электрона. Орбитальное квантовое число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетического уровня (с данным значением n) могут принимать целочисленные значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квантовое число (т.е. обозначают, в каком уровне находится электрон и каков размер его электронного облака) и буквой указывают орбитальное квантовое число (т.е. характеризуют форму этого облака). например, подуровни 1s, 2s, 2p, 4s, 3d, 5f и т.д.
Таблица 5. Энергетические подуровни
Согласно пределам изменений орбитального квантового числа от 0 до (n-1), в каждом энергетическом уровне возможно строго ограниченное число подуровней, а именно: число подуровней равно номеру уровня:
| n | l | Обозначение подуровней | Число подуровней |
| 1 | 0 | 1s | один |
| 2 | 0, 1 | 2s, 2p | два |
| 3 | 0, 1, 2 | 3s, 3p, 3d | три |
| 4 | 0, 1, 2, 3 | 4s, 4p, 4d, 4f | четыре |
Сочетание главного (n) и орбитального (l) квантовых чисел полностью характеризует энергию электрона. Запас энергии электрона отражается суммой (n+l).
Так, например, электроны 3d-подуровня обладают более высокой энергией, чем электроны 4s-подуровня:
Порядок заполнения уровней и подуровней в атоме электронами определяется правилом В.М. Клечковского: заполнение электронных уровней атома происходит последовательно в порядке возрастания суммы (n+1).
В соответствии с этим определена реальная энергетическая шкала подуровней, по которой построены электронные оболочки всех атомов:
3. Магнитное квантовое число (ml ) характеризует направление электронного облака (орбитали) в пространстве.
Чем сложнее форма электронного облака (т.е. чем выше значение l), тем больше вариаций в ориентации данного облака в пространстве и тем больше существует отдельных энергетических состояний электрона, характеризующихся определенным значением магнитного квантового числа.
Например, шарообразная s-орбиталь однозначно направлена в пространстве. Гантелеобразные орбитали каждого p-подуровня ориентируются по трем осям координат
4. Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и принимает всего два значения: + 1 /2 и – 1 /2, в зависимости от направления вращения в ту или другую сторону. Согласно принципу Паули, в одной орбитали может расположиться не более 2 электронов с противоположно направленными (антипараллельными) p- подуровень спинами:.
Такие электроны называются спаренными.
Неспаренный электрон схематически изображается одной стрелкой:.
Зная емкость одной орбитали (2 электрона) и число энергетических состояний в подуровне (ms), можно определить количество электронов в подуровнях:
| Подуровень | Число орбиталей | Число электронов в подуровне |
| S | 1 | 2 |
| P | 3 | 6 |
| D | 5 | 10 |
| F | 7 | 14 |
Эти цифры необходимо хорошо запомнить для правильного написания электронных формул атома.
Итак, четыре квантовых числа – n, l, ml, ms – полностью определяют состояние каждого электрона в атоме. Все электроны в атоме с одинаковым значением n составляют энергетический уровень, с одинаковыми значениями n и l – энергетический подуровень, с одинаковыми значениями n, l и ml – отдельную атомную орбиталь (квантовую ячейку). Электроны одной орбитали отличаются спинами.
Учитывая значения всех четырех квантовых чисел, определим максимальное количество электронов в энергетических уровнях (электронных слоях):
| Уровень | Подуровни | Количество электронов | ||
| по подуровням | суммарное | |||
| K | n=1 | s | s 2 | 2 |
| L | n=2 | s, p | s 2 p 6 | 8 |
| M | n=3 | s, p, d | s 2 p 6 d 10 | 18 |
| N | n=4 | s, p, d, f | s 2 p 6 d 10 f 14 | 32 |
Большие количества электронов (18,32) содержатся только в глубоко лежащих электронных слоях атомов, внешний электронный слой может содержать от 1 (у водорода и щелочных металлов) до 8 электронов (инертные газы).
Важно помнить, что заполнение электронами электронных оболочек происходит по принципу наименьшей энергии: сначала заполняются подуровни с минимальным значением энергии, затем с более высокими значениями. Эта последовательность соответствует энергетической шкале подуровней В.М. Клечковского.
Электронную структуру атома отображают электронные формулы, в которых указываются энергетические уровни, подуровни и число электронов в подуровнях.
При составлении электронной формулы атома марганца 25Mn необходимо учесть последовательность возрастания энергии подуровней: 1s2s2p3s3p4s3d…
Окончательная электронная формула атома марганца (с учетом удаленности электронов от ядра) выглядит так:
Электронная формула марганца полностью соответствует положению его в периодической системе: число электронных слоев (энергетических уровней) – 4 равно номеру периода; во внешнем слое 2 электрона, предпоследний слой не завершен, что характерно для металлов побочных подгрупп; общее количество подвижных, валентных электронов (3d 5 4s 2 ) – 7 равно номеру группы.
В зависимости от того, какой из энергетических подуровней в атоме –s-, p-, d- или f- застраивается в последнюю очередь, все химические элементы подразделяются на электронные семейства: s-элементы (H, He, щелочные металлы, металлы главной подгруппы 2-й группы периодической системы); p-элементы (элементы главных подгрупп 3, 4, 5, 6, 7, 8-й групп периодической системы); d-элементы (все металлы побочных подгрупп); f- элементы (лантаноиды и актиноиды).
Электронные структуры атомов являются глубоким теоретическим обоснованием структуры периодической системы, длина периодов (т.е. количество элементов в периодах) непосредственно вытекает из емкости электронных слоев и последовательности возрастания энергии подуровней:
Каждый период начинается s-элементом со структурой внешнего слоя s 1 (щелочной металл) и заканчивается p-элементом со структурой внешнего слоя …s 2 p 6 (инертный газ). I-й период содержит только два s-элемента (H и He), II-й и III-й малые периоды содержат по два s-элемента и шесть p-элемента. В IV-м и V-м больших периодах между s- и p-элементами «вклиниваются» по 10 d-элементов – переходных металлов, выделенных в побочные подгруппы. В VI и VII периодах к аналогичной структуре добавляется еще по 14 f-элементов, по свойствам близких соответственно лантану и актинию и выделенных в виде подгрупп лантаноидов и актиноидов.
При изучении электронных структур атомов обратите внимание на их графическое изображение, например:
применяют оба варианта изображения: а) и б):
Для правильного расположения электронов на орбиталях необходимо знать правило Гунда: электроны в подуровне располагаются так, чтобы их суммарный спин был максимальным. Иными словами, электроны прежде по одному занимают все свободные ячейки данного подуровня.
Например, если необходимо разместить три p-электрона (p 3 ) в p-подуровне, который всегда имеет три орбитали, то из двух возможных вариантов правилу Гунда отвечает первый вариант:
В качестве примера рассмотрим графическую электронную схему атома углерода:
Количество неспаренных электронов в атоме – очень важная характеристика. Согласно теории ковалентной связи, только неспаренные электроны могут образовывать химические связи и определяют валентные возможности атома.
Если в подуровне имеются свободные энергетические состояния (незанятые орбитали), атом при возбуждении «распаривает», разъединяет спаренные электроны, и его валентные возможности повышаются:
Углерод в нормальном состоянии 2-х-валентен, в возбужденном – 4-х-валентен. Атом фтора не имеет возможностей для возбуждения (т.к. все орбитали внешнего электронного слоя заняты), поэтому фтор в своих соединениях одновалентен.
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (n, l, m1 и m5).
Таблица 6. Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях