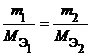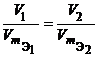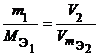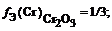Что называют эквивалентом элемента
Что называют эквивалентом элемента
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
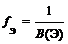
где В(Э) – валентность элемента
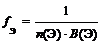
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
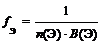
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
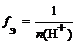
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
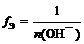
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
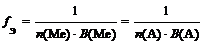
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
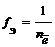
где 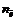
Fe 2+ + 2 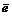
MnO4 – + 8H + + 5 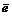
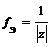
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
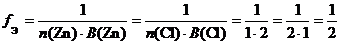
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
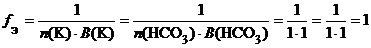
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
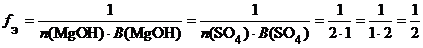
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать: