Что называют буферными системами крови
Буферные системы крови
Циркулирующая кровь представляет собой взвесь живых клеток в жидкой среде, химические свойства которой очень важны для их жизнедеятельности. У человека за норму принят диапазон колебаний pH крови 7,37-7,44 со средней величиной 7,4. Буферные системы крови слагаются из буферных систем плазмы и клеток крови и представлены [1] :
Содержание
Бикарбонатная буферная система
Фосфатная буферная система
В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче.
Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет одноосновный фосфат (NaH2PО4). А роль сопряженного основания — двухосновный фосфат (Na2HPО4).
При рН = 7,4 соотношение [Н2РО4-/ НРО42-] равняется 1:4.
Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4- (Н+ + НРО42- → Н2РО4-), а при избытке ионов ОН- — за счет связывания их с ионами Н2Р04- (ОН- + Н2РО4- → НРО4-2 + Н2О).
Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
Белковая буферная система
В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
Гемоглобиновая буферная система
Самая мощная буферная система крови (в 9 раз мощнее бикарбонатной), на долю которой приходится 75 % всей буферной ёмкости крови. [H+]=K*[HHbO2]/[KHb]
Механизм действия гемоглобинового буфера 1. [общий механизм] Hb- + H+ = HHb HHbO2 + OH- = H2O + HbO2- 2. Гемоглобин является белком, он амфотерен
Протеин протеин протеин H2CO3 > HHb
См. также
Примечания
Литература
Использованная литература
Ссылки
Полезное
Смотреть что такое «Буферные системы крови» в других словарях:
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Газы крови — газы, содержащиеся в крови животных и человека в растворённом состоянии и в химически связанном виде. Полное исследование Г. к. человека было впервые проведено И. М. Сеченовым (1859). Г. к. состоят из газов, поступающих из окружающей… … Большая советская энциклопедия
Группа крови — У этого термина существуют и другие значения, см. Группа крови (значения). Нашивка над левым нагрудным карманом на форме военнослужащего РФ содержит информацию о группе крови и резус факторе бойца (на снимке во … Википедия
Общий анализ крови — Клетки крови под электронным микроскопом. Клинический анализ крови анализ, позволяющий оценить содержание гемоглобина в системе красной крови, количество эритроцитов, цветовой показатель, количество лейкоцитов, тромбоцитов. Клинический анализ… … Википедия
Плазма крови — (от греч. πλάσμα нечто сформированное, образованное) жидкая часть крови, в которой взвешены форменные элементы вторая часть крови. Процентное содержание плазмы в крови составляет 52 61 %. Макроскопически представляет собой… … Википедия
Компоненты крови — составляющие цельной крови, используемые в медицинских учреждениях. В современной службе крови цельная кровь практически не используется, так как ее переливание плохо соответствует принципам этиотропной терапии, дает слишком большое число… … Википедия
Заболевания крови — большая и разнородная группа заболеваний, сопровождающихся тем или иным нарушением функций или строения тех или иных клеток крови эритроцитов, лейкоцитов или тромбоцитов, или патологическим изменением их числа повышением либо снижением, или… … Википедия
Кислородная емкость крови — Кислородная емкость крови количество кислорода, которое может быть связано кровью при её полном насыщении; выражается в объёмных процентах (об%); зависит от концентрации в крови гемоглобина. Определение Кислородной емкости крови важно для… … Википедия
Что называют буферными системами крови
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
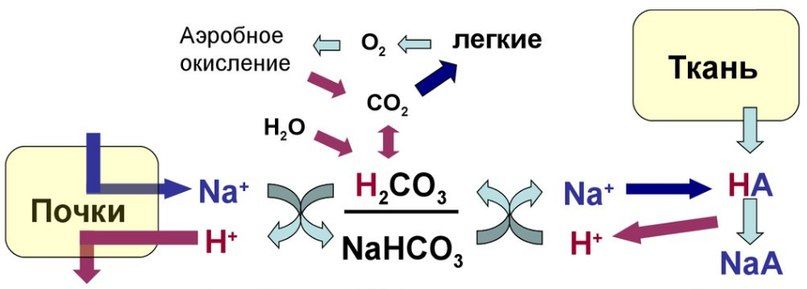
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
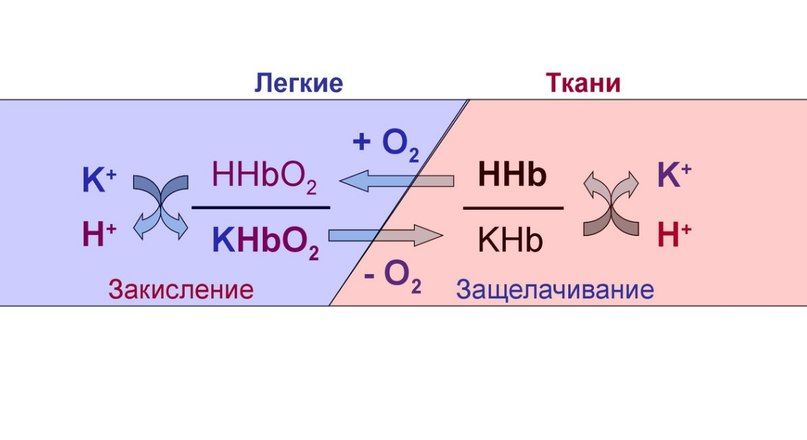
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Буферные системы крови
Во избежание недопонимания между читателями и автором в начале поста хотелось бы дать ряд определений, которые мы собираемся использовать в дальнейшем.
Первое — это определения кислот и оснований. Здесь стоит сделать оговорку, что существует несколько теорий кислот и оснований, охватывающих все множество кислотно-основных взаимодействий и рассматривающих кислотные и основные свойства с различных позиций для различных условий, но — для буферных систем крови мы воспользуемся протолитической теорией Бренстеда-Лоури, с разъяснения которой мы и начнем свой рассказ.
Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон (ион водорода, или H + ), а основания — вещества, присоединяющие протон. Сила кислоты зависит от ее способности отдать протон, а сила основания — от способности протон связать. Например, в растворе серной кислоты происходит следующее:
Серная кислота (H2SO4) передает протон основанию (H2O), при этом образуется новая кислота (H3О + ) и новое основание (HSO4 – ).
Подобным же образом может происходить реакция между соляной кислотой и аммиаком:
Соляная кислота (HCl) передает протон основанию (NH3), при этом образуется новая кислота (NH4 + ) и новое основание (Cl – ).
Как было сказано выше, кислоты и основания бывают сильными и слабыми. Например, H2SO4 и HCl представляют собой сильные кислоты, так как они очень легко отдают протон в раствор; таким образом, сильные кислоты диссоциируют быстро и полностью. И наоборот, HSO4 – и Cl – являются слабыми основаниями, так как слабо удерживают протон. В описанных выше реакциях равновесие сдвинуто в сторону образования более слабой кислоты (H3О + и NH4 + ) и более слабого основания (HSO4 – и Cl – ) соответственно. Слабые кислоты (например, H2CO3) диссоциируют не полностью, а значит, концентрация протонов в растворах этих кислот будет ниже. Сильные основания (например, OH – ) активно взаимодействуют с протонами в растворе, связывая их, а слабые основания (HCO3 – ) делают это менее активно.
Второе — единица рН — логарифмическая единица, выражающая концентрацию ионов водорода в растворе в эквивалентах на литр; обратно пропорциональна количеству протонов в растворе, т. е. при высоком содержании протонов рН понижается, при низком, соответственно, повышается.
Рассмотрим пример. Пусть есть 0,1 М (читается как децимолярный) раствор соляной кислоты. Попробуем рассчитать для него значение pH. Мы знаем, что pH = –lg[H + ]. Соляная кислота является сильной и в водном растворе будет диссоциировать полностью. Значит, количество моль/л, или М, [H + ] будет равно [HCl], то есть 0,1 М. Дальше нам нужно просто подставить это значение в формулу:
Таким образом, раствор 0,1 М соляной кислоты имеет pH, равную 1, что соответствует очень кислой среде.
Тут же стоит вспомнить, что нейтральный раствор характеризуется следующей особенностью — значение концентрации ионов водорода [H + ] равно значению концентрации гидроксильных ионов [OH–] = 10 –7 моль/л, или pH = pOH = 7,0.
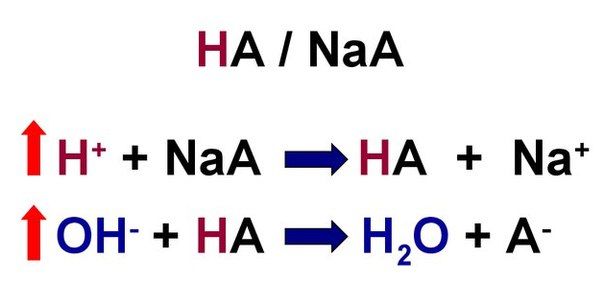
Третье — кислотно-основное равновесие (КОР) — последнее и самое главное. Буферные системы — это системы, состоящие из компонентов (например, слабой кислота и ее соль с сильным основанием или кислотно-основная пара), поддерживающих определенную концентрацию протонов в растворе, то есть определенный pH среды. Кислотность буферных растворов почти не меняется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований. Так, буферная система способна обратимо связывать протон (ион водорода). При связывании ионов водорода в условиях их повышенного количества в растворе получается слабая кислота и соль сильной кислоты, например:
И наоборот, при защелачивании среды происходит диссоциация вещества, выделяется слабое основание и вода:
В обоих случаях буферные системы препятствуют резкому изменению pH. С помощью буферных систем и осуществляется регуляция КОР в организме. Однако, при работе буферной системы один из ее компонентов расходуется и требует восстановления.
Рисунок 1 | Общий вид буферной системы
Значения рН в жидких средах организма в норме:
Диапазон патологических значений рН, при которых человек может жить в течение нескольких часов, варьируется от 6,8 до 8,0.
Выделяют 2 типа расстройств КОР: ацидозы и алкалозы.
Ацидоз — это типовой патологический процесс, характеризующийся относительным или абсолютным понижением pH. Алкалоз — это типовой патологический процесс, характеризующийся относительным или абсолютным увеличением pH. Ацидозы и алкалозы могут быть компенсированными, субкомпенсированными и декомпенсированными.
Компенсированные формы связаны с сохранением жизнедеятельности клетки, в то время как некомпенсированные формы вызывают нарушения функции клетки. Показателем компенсации является величина рН артериальной крови. В норме, как уже было сказано выше, рН = 7,4 ± 0,05. Если величина рН снижается до 7,24 или увеличивается до 7,56 (колебания составляют ± 0,16), то можно говорить о развитии субкомпенсированных форм. В том случае, если эта величина превышает ± 0,16, можно говорить о развитии декомпенсированных форм ацидоза или алкалоза. По происхождению ацидозы и алкалозы бывают газовые (дыхательные) и негазовые (метаболические), которые в свою очередь делятся на подтипы. Наряду с газовыми и негазовыми формами ацидозов и алкалозов встречаются смешанные формы. Кроме того, ацидозы и алкалозы могут быть острыми и хроническими.
Регуляция содержания ионов водорода в жидких средах
Существует три основные системы, регулирующие содержание протонов и препятствующих возникновению ацидоза и алкалоза:
1) Буферные системы организма — моментально регулируют содержание протонов в растворе путем их связывания, но они не способны вывести избыток протонов из организма. Работа буферных систем поддерживает рН крови в пределах 7,35–7,45, а сдвиг рН более чем на 0,4 в любую сторону ведет к гибели. В жидких средах организма существует несколько буферных систем:
— Бикарбонатная буферная система [H2CO3 / HCO3 – ] является основным буфером крови (до 53 % емкости от всех буферных систем);
— Гемоглобиновый буфер [HHb / Hb – ] — до 35 % буферной емкости от всех буферных систем, является внутриклеточным буфером;
— Белковый буфер [HPr / Pr – ] — до 7 % буферной емкости от всех буферных систем;
— Фосфатный буфер [H2PO4 – / HPO4 2– ] — до 5 % буферной емкости от всех буферных систем; действует преимущественно в костной ткани, моче и внутриклеточной жидкости;
— Аммонийный буфер [NH3 / NH4 + ] — действует преимущественно в моче.
2) Дыхательная система — регулирует КОР путем выведения избытка СО2, а следовательно и H2CO3, из внеклеточной жидкости.
3) Выделительная система — почки устраняют изменения КОР путем выведения избытка кислот или оснований с мочой; эта система работает гораздо медленнее, чем предыдущие, однако значительно эффективнее.
В первую очередь рассмотрим наиболее мощную систему из выше перечисленных, берущую на себя основную роль в регуляции КОР — бикарбонатную.
Бикарбонатная буферная система состоит из водного раствора, содержащего слабую угольную кислоту (H2CO3) и слабое основание — бикарбонат-ион (HCO3 – ), который во внеклеточной жидкости чаще всего находится в виде натриевой соли (NaHCO3). Вначале стоит разобрать такое понятие, как диапазон буферного действия — диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK.
Для бикарбонатного буфера pK будет равно 6,1 ± 1 — это далеко от среднего значения pH в организме, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Во-первых, концентрация бикарбоната во внеклеточной жидкости довольно высока, во-вторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3 – ) системами.
Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3 / NaHCO3 (CO2 / HCO3 – ). Бикарбонатный буфер является самым чувствительным и связывает до 40 % «лишних» ионов водорода. Он поддерживает pH=7,4. В связи с вышеперечисленными фактами бикарбонатный буфер является индикатором нарушения КОР и определение компонентов этого буфера — основа диагностики нарушения КОР.
Рисунок 2 | Схема работы бикарбонатной буферной системы
При добавлении сильной кислоты в буферный раствор протоны, образовавшиеся при ее диссоциации, нейтрализуются путем взаимодействия с ионом бикарбоната, в результате формируется угольная кислота, которая разлагается на воду и углекислый газ под воздействием фермента карбоангидразы. Избыток углекислого газа, стимулирует барорецепторы в области бифуркации аорты и каротидного синуса, усиливает вентиляцию легких и таким образом выводится из организма. В норме отношение HCO3 – / H2CO3 = 20/1. При этом, как уже упоминалось, работа этой системы неразрывно связана с легкими. Рассмотрим реакцию подробней. При поступлении в кровь кислоты более сильной, чем угольная, происходит реакция обмена и образуется новая соль и угольная кислота. В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
Обратная реакция происходит при добавлении к раствору сильного основания: гидроксид-ион взаимодействует с угольной кислотой с выделением иона бикарбоната, в результате чего концентрация угольной кислоты и, как следствие, углекислого газа в растворе снижается, что тормозит дыхательный центр, снижает вентиляцию легких и задерживает углекислый газ в организме. При этом повышается количество бикарбонат-ионов в плазме крови, что впоследствии компенсируется почками путем выделения их избытка с мочой. Рассмотрим реакцию подробней. При поступлении оснований они реагируют с угольной кислотой в результате чего образуются соль угольной кислоты. (К — катион)
Рисунок 3 | Схема работы фосфатной буферной системы
Фосфатная буферная система играет важную роль в регуляции КОР в просвете почечных канальцев в связи с тем, что концентрация фосфатов в канальцах растет. Кроме того рН мочи ниже рН других жидкостей организма и близок к значению константы диссоциации фосфатного буфера (pH = 6,8 = pK для фосфатного буфера), что позволяет ему работать на максимальных мощностях. По тем же причинам фосфатный буфер имеет большое значение в регуляции КОР во внутриклеточной жидкости.
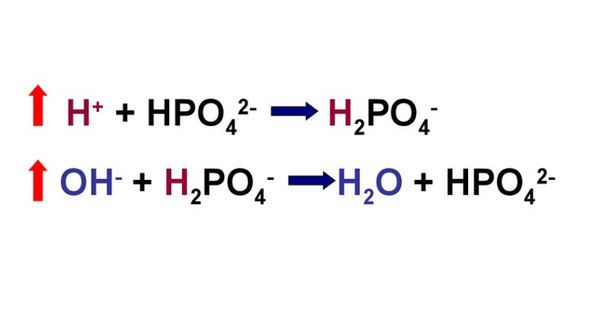
Рассмотрим устройство фосфатной буферной системы подробней. Емкость фосфатной системы составляет около 1–2 % от всей буферной емкости крови и до 50 % буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение (NaH2PO4) слабо диссоциирует и ведет себя как слабая кислота, второе (Na2HPO4) обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 — равно 4 : 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4 (К — катион)
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и моче. Как уже было отмечено выше в моче его роль состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4.
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т. к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система играет основную роль в регуляции КОР внутри клетки в связи с их богатым содержанием во внутриклеточной жидкости.
Несмотря на разницу между значениями рН внутри клетки и вне ее, колебания внутриклеточного КОР находится в зависимости от внеклеточного. Компоненты бикарбонатной буферной системы медленно диффундируют через клеточную мембрану. Соответственно работа внутриклеточных буферных систем может оказывать посильную помощь в регуляции внеклеточного КОР, однако занимает этот процесс значительно большее время. Около 60–70 % буферной емкости всего организма приходится на белковые внутриклеточные системы, однако в связи с низкой скоростью переноса компонентов буфера через мембраны, коррекция КОР за счёт них может значительно опаздывать.
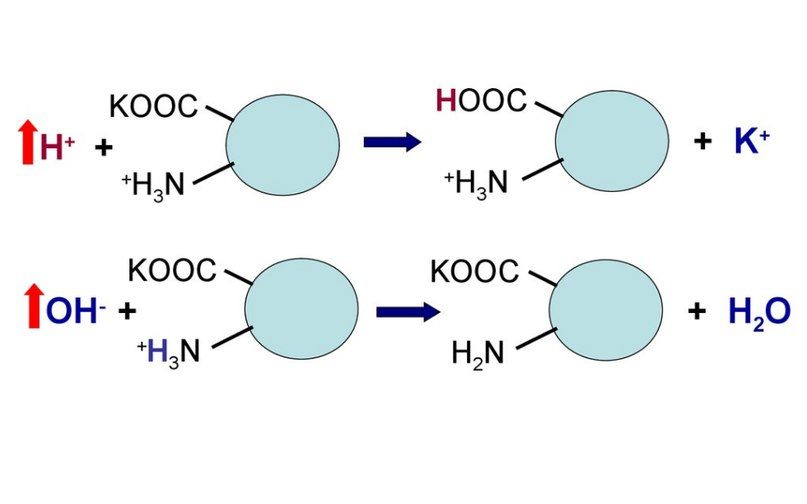
Сама по себе белковая буферная система состоит как из белков внутриклеточных, так и внеклеточных. Белки и их главные структурные компоненты, аминокислоты, являются амфолитами и потому в зависимости от величины pH среды способны принимать или отдавать ион водорода. Таким образом, кислые группы (например, COOH) могут отдавать ион водорода, при повышении pH, а аминогруппы (например, NH2) могут принимать ион водорода при падении pH. Пределы действия белковых кислотно-основных буферных систем ограничиваются количеством групп, способных отдавать или связывать ионы водорода. Жидкости организма, на основе их локализации, можно разделить на внеклеточные и внутриклеточные жидкости.
Рисунок 4 | Схема работы белковой буферной системы
К внеклеточным жидкостям тканей относятся межклеточные жидкости. Разновидностью межклеточных жидкостей является плазма крови. Плазма крови содержит белки, которые могут составляют одну буферных систем крови. Межклеточная жидкость в тканях содержит волокна внеклеточного белка и растворенные аминокислоты. Все эти компоненты составляют буферную систему межклеточных жидкостей в тканях. Основным белковым буфером в случае крови является гемоглобиновый буфер.
Гемоглобин осуществляет буферирование за счет имидазольных групп гистидиновых остатков и имеет pKa = 6,8. Величина pH крови остаётся постоянной благодаря тому, что гемоглобин способен связывать углекислый газ и ионы водорода, тут гемоглобин играет роль основания. В легких находится окисленная форма гемоглобина HHbO2, которая является более сильной кислотой (при этом кислотность HHbO2 в 70 раз выше, чем у HHb), чем угольная кислота (H2CO3), в результате чего подавляется диссоциация последней. HHbO2 отдает свои ионы Н + в среду, предотвращая повышение рН. В целом если говорить о крови, то ее буферные системы более устойчивы к действию кислот, чем оснований.
Рисунок 5 | Схема работы гемоглобиновой буферной системы
Изогидрическое правило
Поскольку в организме все буферные системы в том или ином соотношении представлены во всех жидкостных средах, они действуют сообща. Смысл изогидрического правила заключается в том, что изменение равновесия в одной буферной системе в растворе ведет за собой изменение и в других системах за счёт перераспределения между ними ионов водорода.
Регуляция кислотно-основного состояния в организме
Дыхательная система — регулирует концентрацию СО2 во внеклеточной жидкости. При повышении вентиляции СО2 активно выводится из организма, что вызывает снижение концентрации углекислоты и приводит к снижению количества протонов в крови. Снижение вентиляции вызывает повышение количества СО2 в крови, и концентрация ионов водорода в крови растет.
В клинической практике удобно использовать показатель парциального давления углекислого газа — рСО2, в норме равный 40 мм рт.ст. При повышении интенсивности метаболических процессов или уменьшении вентиляции легких рСО2 растет, накапливается углекислота и соответственно ионы водорода, приводя к снижению рН — ацидозу. Замедление метаболических процессов или рост вентиляции вызывает снижение СО2 в крови, количества протонов и приводит к алкалозу, что проявляется повышением рН.
Уровень рН в жидких средах организма очень чувствителен к изменению вентиляции. Так, увеличение вентиляции в 2 раза от нормы приводит к повышению рН на 0,23 единиц, при этом снижение альвеолярной вентиляции на ¼ ниже нормы влечет за собой снижение уровня рН на 0,45 единиц. Таким образом, становится понятно значение дыхательной системы в регуляции КОР.
В свою очередь деятельность дыхательной системы зависит от концентрации протонов в крови, то есть изменение рН во внеклеточной жидкости ведёт за собой изменение вентиляции, что является ярким примером принципа отрицательной обратной связи в системе (при работе такой связи, усилия системы направлены на возвращение к исходному состоянию организма). Рост концентрации протонов и сопутствующее ему повышение рН вызывает компенсаторное увеличение вентиляции вследствие стимуляции дыхательного центра. Напротив, уменьшение количества ионов водорода и повышение рН тормозят дыхательный центр. Таким образом, довольно быстро регулируется содержание протонов в системе.
Дыхательная система как физиологический буфер действует медленнее, чем любой из химических буферов, однако ее буферная емкость в 2 раза выше всех вместе взятых буферов внеклеточной жидкости. У нее довольно низкий коэффициент эффективности обратной связи, поэтому коррекция значений рН осуществляется в очень малых пределах, тем не менее, это позволяет выиграть время для стабилизации КОР с помощью выделительной системы.
При нарушениях функций дыхательной системы также происходит изменение уровня ионов водорода и соответственно показателя рН. При нарушении процесса нормальной вентиляции легких (например, при эмфиземе легких), снижается способность выведения СО2, в результате чего развивается дыхательный ацидоз. В такой ситуации коррекция КОР полностью перекладывается на выделительную систему.
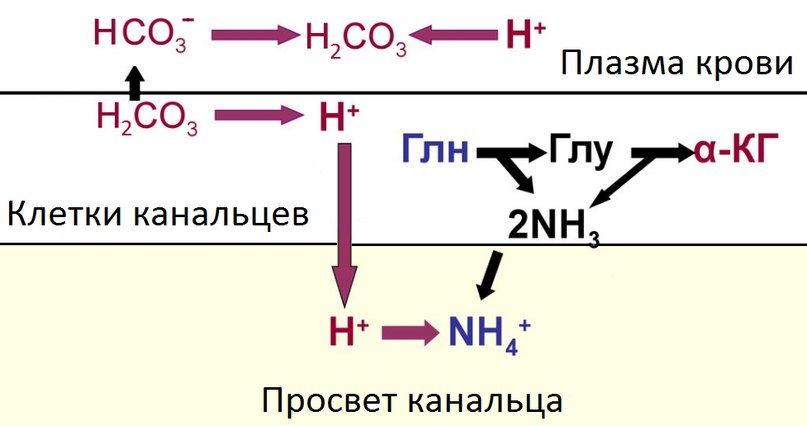
Выделительная система почек — осуществляют регуляцию КОР путем выделения кислых и основных продуктов обмена с мочой. В целом, принцип работы системы заключается в следующем: бикарбонат-ионы попадают в просвет канальцев с первичной мочой путем фильтрации, ионы водорода секретируются эпителиоцитами в просвет канальцев, где они связываются ионами бикарбоната и реабсорбируются обратно в кровь в форме угольной кислоты. Таким образом, осуществляется восполнение компонентов бикарбонатного буфера. Если количество протонов во внутриканальцевой жидкости превышает количество бикарбонат-ионов (при ацидозе), их избыток выводится с мочой, закисляя ее, и наоборот, избыток оснований способствует их выведению (при алкалозе). Эти процессы происходят во всех отделах канальцевой системы, исключая тонкий отдел петли Генле, при этом 80–90 % реабсорбции бикарбонатов и секреции протонов приходится на проксимальный каналец. В различных сегментах эти процессы осуществляются разными механизмами. Кроме того, с мочой выводятся нелетучие кислоты (те, которые не могут выделяться через дыхательную систему), полученные в ходе метаболических процессов, что в свою очередь увеличивает количество протонов в моче. Немаловажным механизмом регуляции КОР почками является образование новых ионов бикарбоната, опять же при участии карбоангидразы.
При выделении в мочу избытка протонов лишь небольшая их часть выводится в свободном виде, остальные связываются с буферными системами в просвете канальцев, способствуя выработке недостающего количества бикарбонатов внутри клеток канальцев с последующей их реабсорбцией в кровь при ацидозе. Наибольшее значение имеют фосфатная и аммонийная системы, меньшую роль играют цитратная и уратная.
Рисунок 6 | Схема работы аммонийной буферной системы
В заключение, приведенная в данной статье информация далеко не полная и не включает в себя многие нюансы, однако, прочитав данную информацию, можно получить общее представление о регуляции кислотно-основного равновесия в организме.