Что называют азеотропной смесью
АЗЕОТРОПНЫЕ СМЕСИ
(азеотропы) (от греч. а—приставка, означающая отрицание или отсутствие к.-л. свойства, 
А. с. встречаются как в двойных, так и в многокомпонентных системах. Нек-рые в-ва особенно склонны к образованию А. с., особенно с представителями к.-л. одного го-мологич. ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из разл. рядов могут образовывать между собой большое число двух- и многокомпонентных А. с., охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с А. с., что составляет примерно половину всех изученных смесей. Поэтому изучение св-в систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри. тич. состоянии. Такие сведения особенно важны для хим. и нефтехим. отраслей пром-сти, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с А. с., а технол. процессы часто проводятся при повыш. т-рах и давлениях, т. е. вблизи критич. параметров и в закритич. области.
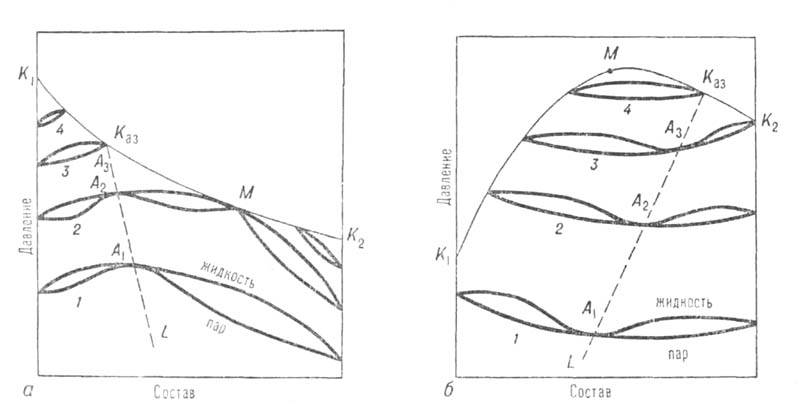
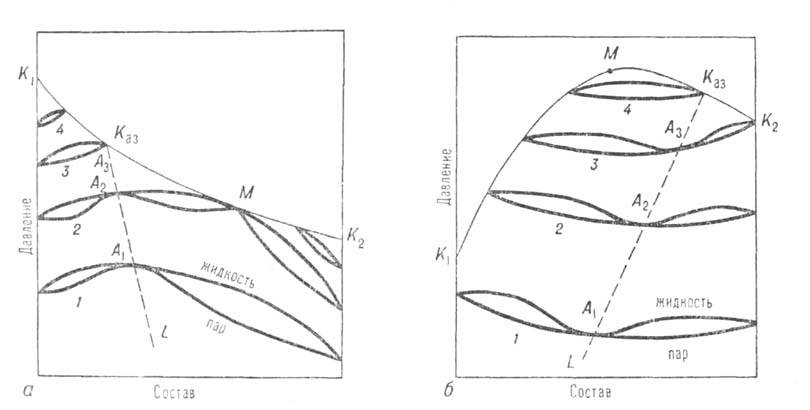
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной т-ре (изотермы общего давления) имеют максимумы или минимумы (точки А 1, А 2, А 3 на рис. 1). Соответственно на изобарах т-р кипения в этих точках имеются минимумы или максимумы (см. Коновалова законы). При максимуме на изотерме (минимуме на изобаре) азеотроп наз. положительным, при минимуме на изотерме (максимуме на изобаре)-отрицательным. Среди двойных систем с А. с. примерно 93% приходится на системы с положит. азеотропами. Известны случаи существования в одной системе двух азеотропов разного знака при S-образной изобаре т-р кипения (напр., в системе фторбензол-бензол).
А. с. возникают вследствие отклонения поведения системы от поведения, свойственного идеальным р-рам. Названия «положительный» и «отрицательный» азеотроп соответствуют положит. и отрицат. отклонениям от идеальности. А. с. могут образовываться даже при весьма малых отклонениях от идеальности, если изобарич. т-ры кипения обоих компонентов близки между собой. В этих случаях составы А. с. обычно ближе к эквимолярным, чем при значит. различии т-р кипения компонентов, когда А. с. могут располагаться и на концах концентрац. интервала системы, вблизи чистых компонентов. При составе, близком к 100% одного из компонентов, азеотроп наз. тангенциальным или почти тангенциальным.
Общих методов, позволяющих предсказать возможность образования в данной системе А. с. и ее параметры (состав, т-ру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
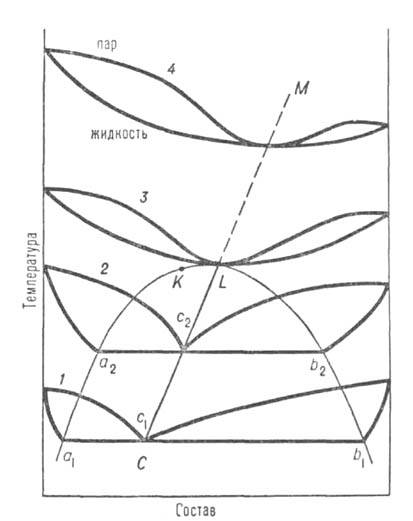
В расслаивающихся жидких смесях, т. е. при трехфазном равновесии жидкость-жидкость-пар, могут существовать т. наз. гетероазеотропы (псевдоазеотропы). В этих случаях составы равновесных паровых фаз (c1,c2 на рис. 2) лежат внутри интервала концентраций равновесных жидких фаз (
Азеотропная смесь
Азеотропная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз.
При изменении давления изменяется не только температура кипения, но и состав азеотропной смеси, этим они отличаются от чистых жидкостей.
Для разделения азеотропных смесей используют различные технологии:
См. также
Примечания
Полезное
Смотреть что такое «Азеотропная смесь» в других словарях:
АЗЕОТРОПНАЯ СМЕСЬ — (от a отрицательная приставка zeo киплю и trope поворот, изменение), жидкая смесь, которая при данном давлении не разделяется на компоненты путем перегонки. Напр., 96% ный водный раствор этилового спирта (спирт ректификат) перегонкой при… … Большой Энциклопедический словарь
азеотропная смесь — азеотропная смесь; отрасл. нераздельно кипящая смесь Раствор, образующий при равновесии пар того же состава … Политехнический терминологический толковый словарь
азеотропная смесь — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN azeotropic mixture … Справочник технического переводчика
азеотропная смесь — (от а. отрицательная приставка, zéō киплю и tropē поворот, изменение), жидкая смесь, которая при данном давлении не разделяется на компоненты путём перегонки. Например, 96% ный водный раствор этилового спирта (спирт ректификат) перегонкой… … Энциклопедический словарь
азеотропная смесь — azeotropinis mišinys statusas T sritis chemija apibrėžtis Skystasis mišinys, kurio distiliavimu esant tam pačiam slėgiui negalima perskirti į atskirus komponentus. atitikmenys: angl. azeotrope; azeotropic mixture; constant boiling mixture rus.… … Chemijos terminų aiškinamasis žodynas
Азеотропная смесь — (от а отрицательная частица, греческое zéō киплю и tropē поворот, изменение) нераздельно кипящая смесь; однородная жидкая смесь (См. Жидкие смеси), которая при перегонке не разделяется на фракции. Существование А. с. открыто в 1810 Дж.… … Большая советская энциклопедия
азеотропная смесь — (а. + гр. zed киплю + trope изменение) нераздельнокипящая смесь; однородная смесь двух или нескольких жидкостей, которая при перегонке не разделяется на фракции; около 50% жидких смесей промышленного значения образуют азеотропные смеси. Новый… … Словарь иностранных слов русского языка
АЗЕОТРОПНАЯ СМЕСЬ — (от а отрицат. приставка, zeo киплю и trope поворот, изменение), жидкая смесь, к рая при данном давлении не разделяется на компоненты путём перегонки. Напр., 96% ный вод. р р этилового спирта (спирт ректификат) перегонкой при норм. давлении… … Естествознание. Энциклопедический словарь
Азеотропная смесь — холод. техн. Смесь жидкостей, жидкая и газообразная фазы которой в условиях термодинамического равновесия имеют один и тот же состав. Температура кипения смеси постоянна … Универсальный дополнительный практический толковый словарь И. Мостицкого
азеотропная смесь — нераздельнокипящая смесь … Cловарь химических синонимов I
АЗЕОТРОПНЫЕ СМЕСИ
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) (от греч. а—приставка, означающая отрицание или отсутствие к.-л. свойства,
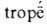
Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах. Нек-рые в-ва особенно склонны к образованию азеотропных смесей, особенно с представителями к.-л. одного го-мологич. ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из разл. рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрац. интервал.
Известно ок. 10 000 систем с азеотропными смесями, что составляет примерно половину всех изученных смесей. Поэтому изучение св-в систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии. Такие сведения особенно важны для хим. и нефтехим. отраслей пром-сти, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с азеотропными смесями, а технол. процессы часто проводятся при повыш. т-рах и давлениях, т.е. вблизи критич. параметров и в закритич. области.
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной т-ре (изотермы общего давления) имеют максимумы или минимумы (точки А1, А2, А3 на рис. 1). Соответственно на изобарах т-р кипения в этих точках имеются минимумы или максимумы (см. Коновалова законы). При максимуме на изотерме (минимуме на изобаре) азеотроп наз. положительным, при минимуме на изотерме (максимуме на изобаре)-отрицательным. Среди двойных систем с азеотропными смесями примерно 93% приходится на системы с положит. азеотропами. Известны случаи существования в одной системе двух азеотропов разного знака при S-образной изобаре т-р кипения (напр., в системе фторбензол-бензол).
Азеотропные смеси возникают вследствие отклонения поведения системы от поведения, свойственного идеальным р-рам. Названия «положительный» и «отрицательный» азеотроп соответствуют положит. и отрицат. отклонениям от идеальности. Азеотропные смеси могут образовываться даже при весьма малых отклонениях от идеальности, если изобарич. т-ры кипения обоих компонентов близки между собой. В этих случаях составы азеотропных смесей обычно ближе к эквимолярным, чем при значит. различии т-р кипения компонентов, когда азеотропные смеси могут располагаться и на концах концентрац. интервала системы, вблизи чистых компонентов. При составе, близком к 100% одного из компонентов, азеотроп наз. тангенциальным или почти тангенциальным.
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; Каз-критич. точка азеотропа; ЦСаз-линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критич. кривой, соотв. К1КазМК2 и К1МКазК2.
Рис. 2. Диаграмма равновесия жидкость-пар в системе с расслаивающейся жидкой смесью; аКb-пограничная кривая равновесия двух жидких фаз; кривые 1-4-изобары равновесия; c1, с2-составы пара, равновесного двум жидким фазам a1b1 и а2b2; CL-линия гетероазеотропов.
Общих методов, позволяющих предсказать возможность образования в данной системе азеотропной смеси и ее параметры (состав, т-ру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
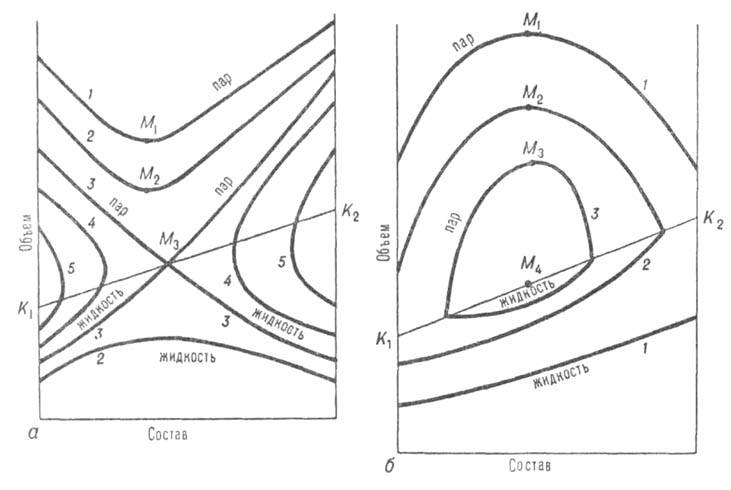
Отличит. черты систем с азеотропизмом не исчерпываются существованием в них азеотропной смеси, главная особенность к-рой состоит в том, что в термодинамич. отношении она ведет себя как чистое в-во независимо от числа компонентов. Наличие азеотропной смеси оказывает влияние на св-ва системы и за пределами существования азеотропной смеси. Особенно отчетливо это проявляется в объемном поведении системы. Из-за того что на изотермах общего давления пара имеются экстремумы, изотерма объема для паровой фазы обязательно имеет минимум у систем с положит. азеотропом и максимум у систем с отрицат. азеотропом (точки M1,М2, М3 на рис. 3). При этом составы, соответствующие экстремумам, вследствие неидеальности паровой фазы не совпадают с составами азеотропных смесей. При положит. азеотропе критич. состояние достигается сначала для смеси и на критич. кривой появляется температурный минимум, в к-ром равновесие жидкость-пар распадается на две области (точка М3 на рис. 3, а). В одной из них в нек-ром интервале т-р еще сохраняется азеотропная смесь; точка соприкосновения линии азеотропов с критич. кривой наз. критич. точкой азеотропа Каз (рис. 1, а). С повышением т-ры эти области постепенно уменьшаются, стягиваясь к критич. точкам чистых компонентов. При отрицат. азеотропе область равновесия жидкость-пар сохраняется при т-рах выше критич. т-р чистых компонентов, располагаясь в средней части концентрац. интервала (рис. 1, б и 3, б). При дальнейшем повышении т-ры эта область стягивается в точку, отвечающую максимуму т-ры на критич. кривой (точки М на рис. 3, б).
Рис. 3. Диаграммы равновесия жидкость-пар в координатах объем-состав для двойной системы с положит. (а) и отрицат. (6) азеотропами; 1-5-изотермы равновесия жидкой и паровой фаз; М1, М2, M3-минимумы (а) и максимумы (б) на изотерме паровой фазы; изотерма 3 соответствует температурному минимуму М3(а) и температурному максимуму М4(б) на критич. кривой, соотв. K1M3K2 и К1М4К2.
Термодинамич. поведение систем с азеотропными смесями резко отличается от поведения простых систем и в закритич. области. Зависимости объема, энтальпии и энтропии газовой смеси от состава при постоянных т-ре и давлении (изотермы-изобары) при составе, близком к Каз, имеют точки перегиба с вертикальной касательной. Значения этих величин изменяются с концентрацией очень сильно. Так, в системе аммиак-этан мольный объем газовой смеси при ничтожном изменении состава возрастает почти вдвое. Изотермы-изобары вышеуказанных величин проходят, кроме того, через резко выраженные максимумы. Эти и др. особенности систем с азеотропными смесями распространяются на значит. интервал т-р и давлений в закритич. области. Поэтому использование ур-ний состояния, применяемых обычно к газовым смесям в области невысоких т-р и давлений, невозможно, если нет сведений о наличии (или отсутствии) в данной системе азеотропной смеси и о пределах ее существования.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии азеотропных смесей в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах азеотропных смесей, причем вероятность появления тройного азеотропа тем больше, чем больше число азеотропных смесей в двойных системах.
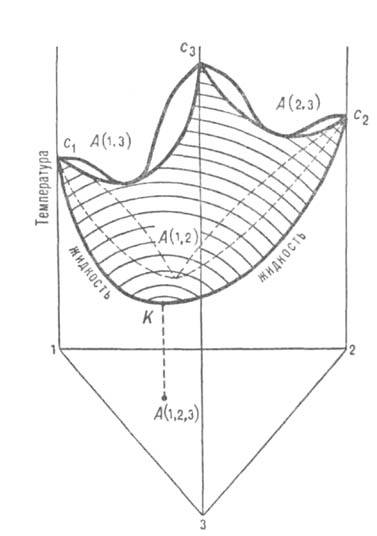
В тройных системах встречаются три типа азеотропных смесей. Положит. азеотроп характеризуется максимумом на изотермич. повети давления пара (соотв. минимумом на изобарич. пов-сти т-р кипения) в треугольной диаграмме равновесия (рис. 4). Эта диаграмма показывает зависимость концентраций компонентов, при к-рых имеется равновесие жидкость-пар, от т-ры (при постоянном давлении) или давления (при постоянной т-ре). Составы тройной системы представлены концентрац. треугольником. Изобарич. пов-сть с1А (1,2)с2А (2,3)с3А (1,3)К для равновесных жидких фаз имеет тройную азеотропную смесь в точке К. Концентрация азеотропной смеси соответствует точке А (1,2,3) на треугольнике составов. Положит. азеотропная смесь образуется в тех случаях, когда в исходных двойных системах имеются только положит. азеотропы [на рис. 4 каждая двойная система имеет азеотропы в точках А (1,2), А (2,3), А (1,3)]. Отрицат. азеотропная смесь образуется, когда в системе имеются только отрицат. двойные азеотропы. Ей соответствует минимум на изотермич. повети общего давления (максимум на изобарич. пов-сти т-р кипения).
Рис. 4. Диаграмма равновесия жидкость-пар в системе с тройным положительным азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарич. пов-сть равновесной жидкой фазы.
Составы тройных азеотропных смесей изменяются с т-рой (давлением). Соответствующая зависимость изображается пространств. кривой в изобарич. (изотермич.) призме. Кривая может доходить до критич. пов-сти системы, отграничивающей область существования двухфазного равновесия жидкость-пар, но может заканчиваться и ранее. Объемное поведение тройных систем очень сложно. Оно определяется не только наличием тройного азеотропа и его типом, но и типами двойных азеотропных смесей в исходных системах, поскольку обусловленные последними особенности св-в не исчезают скачком с прибавлением третьего компонента.
Эксперим. исследования систем с тройными азеотропными смесями очень трудоемки. Поэтому большую роль здесь играют теоретич. представления о возможных видах диаграмм состояния. Широко используется для этого правило азеотропии, к-рое качественно связывает кол-во и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарич. поверхности т-р кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
===
Исп. литература для статьи «АЗЕОТРОПНЫЕ СМЕСИ» : Свентославский В., Азеотропия и полиазеотропия, пер. с англ., М., 1968; Огородников С.К., Лестева Т.М., Коган В. Б., Азеотропные смеси. Справочник, Л., 1971; Маленко Ю.И., Молодснко П. Я., Диаграммы трехкомпонентных азеотропных систем, Л., 1975; Казакова Н. Е., Системы с азеотропизмом при высоких давлениях, М., 1978; Хазанова Н. Е., Соминская Е.Э., Захарова А.В., «Ж. физ. химии», 1981, т. 55, № 10, с. 2640-42. Н. Е. Хазанова.
Страница «АЗЕОТРОПНЫЕ СМЕСИ» подготовлена по материалам химической энциклопедии.
Что называют азеотропной смесью
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) (от греческого а—приставка, означающая отрицание или отсутствие к.-л. свойства,

Известно ок. 10 000 систем с АЗЕОТРОПНЫЕ СМЕСИ с., что составляет примерно половину всех изученных смесей. Поэтому изучение свойств систем с азеотропизмом необходимо для построения общего учения о фазовых равновесиях и кри.тич. состоянии. Такие сведения особенно важны для химический и нефтехимический отраслей промышлености, поскольку в их исходных материалах, промежуточных или конечных продуктах почти всегда имеются системы с АЗЕОТРОПНЫЕ СМЕСИс., а технол. процессы часто проводятся при повыш. температурах и давлениях, т.е. вблизи критической параметров и в закритической области.
Двухкомпонентные системы. Кривые зависимости общего давления от состава при постоянной температуре (изотермы общего давления) имеют максимумы или минимумы (точки А1, А2, А3 на рис. 1). Соответственно на изобарах температур кипения в этих точках имеются минимумы или максимумы (см. Коновалова законы). При максимуме на изотерме (минимуме на изобаре) азеотроп называют положительным, при минимуме на изотерме (максимуме на изобаре)-отрицательным. Среди двойных систем с АЗЕОТРОПНЫЕ СМЕСИс. примерно 93% приходится на системы с положит. азеотропами. Известны случаи существования в одной системе двух азеотропов разного знака при S-образной изобаре температур кипения (например, в системе фторбензол-бензол).
Рис. 1. Диаграмма равновесия жидкость-пар в двойной системе с положит. (а) и отрицат. (б) азеотропами; 1-4-изотермы равновесия жилкой и паровой фаз; A1, А2, А3-азеотропы; Каз-критической точка азеотропа; ЦСаз-линия азеотропов; М-точка, соответствующая температурному минимуму (а) и температурному максимуму (б) на критической кривой, соответственно К1КазМК2 и К1МКазК2.
Рис. 2. Диаграмма равновесия жидкость-пар в системе с расслаивающейся жидкой смесью; аКb-пограничная кривая равновесия двух жидких фаз; кривые 1-4-изобары равновесия; c1, с2-составы пара, равновесного двум жидким фазам a1b1 и а2b2; CL-линия гетероазеотропов.
Общих методов, позволяющих предсказать возможность образования в данной системе АЗЕОТРОПНЫЕ СМЕСИс. и ее параметры (состав, температуру кипения, давление пара), пока не существует, поэтому применяют ряд приближенных методов.
Отличит. черты систем с азеотропизмом не исчерпываются существованием в них АЗЕОТРОПНЫЕ СМЕСИс., главная особенность которой состоит в том, что в термодинамическое отношении она ведет себя как чистое вещество независимо от числа компонентов. Наличие АЗЕОТРОПНЫЕ СМЕСИ с. оказывает влияние на свойства системы и за пределами существования азеотропной смеси. Особенно отчетливо это проявляется в объемном поведении системы. Из-за того что на изотермах общего давления пара имеются экстремумы, изотерма объема для паровой фазы обязательно имеет минимум у систем с положит. азеотропом и максимум у систем с отрицат. азеотропом (точки M1,М2, М3 на рис. 3). При этом составы, соответствующие экстремумам, вследствие неидеальности паровой фазы не совпадают с составами АЗЕОТРОПНЫЕ СМЕСИ с. При положит. азеотропе критической состояние достигается сначала для смеси и на критической кривой появляется температурный минимум, в котором равновесие жидкость-пар распадается на две области (точка М3 на рис. 3, а). В одной из них в некотором интервале температур еще сохраняется АЗЕОТРОПНЫЕ СМЕСИс.; точка соприкосновения линии азеотропов с критической кривой называют критической точкой азеотропа Каз (рис. 1, а). С повышением температуры эти области постепенно уменьшаются, стягиваясь к критической точкам чистых компонентов. При отрицат. азеотропе область равновесия жидкость-пар сохраняется при температурах выше критической температур чистых компонентов, располагаясь в средней части концентрац. интервала (рис. 1, б и 3, б). При дальнейшем повышении температуры эта область стягивается в точку, отвечающую максимуму температуры на критической кривой (точки М на рис. 3, б).
Рис. 3. Диаграммы равновесия жидкость-пар в координатах объем-состав для двойной системы с положит. (а) и отрицат. (6) азеотропами; 1-5-изотермы равновесия жидкой и паровой фаз; М1, М2, M3-минимумы (а) и максимумы (б) на изотерме паровой фазы; изотерма 3 соответствует температурному минимуму М3(а) и температурному максимуму М4(б) на критической кривой, соответственно K1M3K2 и К1М4К2.
Термодинамич. поведение систем с АЗЕОТРОПНЫЕ СМЕСИ с. резко отличается от поведения простых систем и в закритической области. Зависимости объема, энтальпии и энтропии газовой смеси от состава при постоянных температуре и давлении (изотермы-изобары) при составе, близком к Каз, имеют точки перегиба с вертикальной касательной. Значения этих величин изменяются с концентрацией очень сильно. Так, в системе аммиак-этан мольный объем газовой смеси при ничтожном изменении состава возрастает почти вдвое. Изотермы-изобары вышеуказанных величин проходят, кроме того, через резко выраженные максимумы. Эти и др. особенности систем с АЗЕОТРОПНЫЕ СМЕСИ с. распространяются на значительной интервал температур и давлений в закритической области. Поэтому использование уравений состояния, применяемых обычно к газовым смесям в области невысоких температур и давлений, невозможно, если нет сведений о наличии (или отсутствии) в данной системе АЗЕОТРОПНЫЕ СМЕСИ с. и о пределах ее существования.
Тройные системы. Добавление к двойной неидеальной системе третьего компонента может как уменьшить, так и увеличить ее неидеальность. Поэтому в тройной системе может не быть тройного азеотропа и при наличии АЗЕОТРОПНЫЕ СМЕСИ с. в двойных системах, составляющих данную тройную. И наоборот, тройной азеотроп может появиться при отсутствии в двойных системах АЗЕОТРОПНЫЕ СМЕСИ с., причем вероятность появления тройного азеотропа тем больше, чем больше число АЗЕОТРОПНЫЕ СМЕСИ с. в двойных системах.
В тройных системах встречаются три типа АЗЕОТРОПНЫЕ СМЕСИ с. Положит. азеотроп характеризуется максимумом на изотермодинамически повети давления пара (соответственно минимумом на изобарич. поверхности температур кипения) в треугольной диаграмме равновесия (рис. 4). Эта диаграмма показывает зависимость концентраций компонентов, при которых имеется равновесие жидкость-пар, от температуры (при постоянном давлении) или давления (при постоянной температуре). Составы тройной системы представлены концентрац. треугольником. Изобарич. поверхность с1А (1,2)с2А (2,3)с3А (1,3)К для равновесных жидких фаз имеет тройную АЗЕОТРОПНЫЕ СМЕСИ с. в точке К. Концентрация А. с. соответствует точке А (1,2,3) на треугольнике составов. Положит. А. с. образуется в тех случаях, когда в исходных двойных системах имеются только положит. азео-тропы [на рис. 4 каждая двойная система имеет азеотропы в точках А (1,2), А (2,3), А (1,3)]. Отрицат. АЗЕОТРОПНЫЕ СМЕСИ с. образуется, когда в системе имеются только отрицат. двойные азеотропы. Ей соответствует минимум на изотермодинамически повети общего давления (максимум на изобарич. поверхности температур кипения).
Рис. 4. Диаграмма равновесия жидкость-пар в системе с тройным положит. азеотропом К состава А(1, 2, 3) и тремя двойными азеотропами А(1, 2), А(2, 3), А(1, 3). Заштрихована изобарич. поверхность равновесной жидкой фазы.
Составы тройных АЗЕОТРОПНЫЕ СМЕСИс. изменяются с температурой (давлением). Соответствующая зависимость изображается пространств. кривой в изобарич. (изотермодинамически) призме. Кривая может доходить до критической поверхности системы, отграничивающей область существования двухфазного равновесия жидкость-пар, но может заканчиваться и ранее. Объемное поведение тройных систем очень сложно. Оно определяется не только наличием тройного азеотропа и его типом, но и типами двойных А. с. в исходных системах, поскольку обусловленные последними особенности свойств не исчезают скачком с прибавлением третьего компонента.
Эксперим. исследования систем с тройными АЗЕОТРОПНЫЕ СМЕСИс. очень трудоемки. Поэтому большую роль здесь играют теоретич. представления о возможных видах диаграмм состояния. Широко используется для этого правило азеотропии, которое качественно связывает количество и типы двойных и тройных азеотропов в системе. Поскольку в тройных системах изобарич. поверхности температур кипения имеют хребты и впадины, то для проведения ректификации удобными становятся выделенные ими отдельные области параметров.
Химическая энциклопедия. Том 1 >> К списку статей