Что называют атомной орбиталью химия 10 класс
Атомная орбиталь
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера — доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Содержание
Квантовые числа и номенклатура орбиталей
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Геометрическое представление
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 0 | 0 |  |  | 0 |  |  |  |  |
| Линейная комбинация |  |  |  |  |  |  |  |  |  |
| Обозначение |  |  |  |  |  |  |  |  |  |
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Атомная орбиталь
Из Википедии — свободной энциклопедии
Атом каждого элемента имеет полный набор всех орбиталей на всех электронных уровнях. Орбитали существуют независимо от того, находится на них электрон или нет, их заполнение электронами происходит по мере увеличения порядкового номера то есть заряда ядра и, соответственно, числа электронов.
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемом ядром атома со всеми остальными электронами атома.
Сам Э. Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяло убеждений Шрёдингера: доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден был согласиться с доводами М.Борна, которому в 1954 году была присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояние электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Разница между атомной и молекулярной орбиталью
Главное отличие
Основное различие между атомной орбиталью и молекулярной орбиталью состоит в том, что атомная орбиталь содержит электроны, на которые влияет одно положительное ядро, тогда как молекулярная орбиталь содержит электроны, на которые влияет более двух ядер, в зависимости от количества атомов в молекуле.
Атомная орбиталь против молекулярной орбитали
Орбиталь атома считается областью, в которой существует наибольшая вероятность нахождения электрона в атоме. Напротив, молекулярная орбиталь считается областью с наибольшей вероятностью обнаружения электрона молекулы. Электронное облако вокруг атома отвечает за образование атомных орбиталей, тогда как слияние атомных орбиталей, состоящих из относительно одинаковой энергии, отвечает за образование молекулярных орбиталей.
Тип атомных орбиталей, такой как s, p, d или f, определяет форму атомных орбиталей; с другой стороны, форма атомных орбиталей, составляющих молекулу, определяет форму молекулярной орбитали. Уравнение Шредингера используется на атомных орбиталях, тогда как на молекулярных орбиталях обычно используется линейная комбинация атомных орбиталей.
На электронное облако на атомных орбиталях может воздействовать одно ядро, в то время как на электронное облако на молекулярных орбиталях могут воздействовать два или более ядер. Атомная орбиталь, как известно, моноцентрическая, поскольку она присутствует рядом с одним ядром, в то время как молекулярная орбиталь называется полицентрической, поскольку она находится рядом с двумя или многими различными ядрами.
Атомные орбитали представлены как a, p, d и f, в то время как молекулярные орбитали состоят из двух типов: связывающие молекулярные орбитали или антисвязывающие молекулярные орбитали. Электронная конфигурация внутри атомных орбиталей не влияет на постоянство атома, тогда как электронная конфигурация на молекулярной орбитали действительно влияет на стабильность молекулы.
Сравнительная таблица
| Атомная орбиталь | Молекулярная орбиталь |
| Научная цель, которая определяет волнообразное поведение отдельного электрона или пары электронов в атоме, известна как атомная орбиталь. | Научная цель, которая определяет волнообразное поведение отдельного электрона в молекуле, известна как молекулярная орбиталь. |
| Теория | |
| Область наибольшей вероятности обнаружения электрона в атоме. | Область наибольшей вероятности нахождения электрона молекулы. |
| Формирование | |
| Электронное облако вокруг атома отвечает за образование атомных орбиталей | Слияние атомных орбиталей, которые состоят из относительно одинаковой энергии, отвечает за образование молекулярных орбиталей. |
| Форма | |
| Тип атомных орбиталей, таких как s, p, d или f, определяет форму | Форма атомных орбиталей, составляющих молекулу, определяет форму |
| Описание электронной плотности | |
| Уравнение Шредингера используется для описания электронной плотности | Линейная комбинация атомных орбиталей (ЛКАО) обычно используется при описании электронной плотности. |
| Ядро | |
| Моноцентрический, поскольку он присутствует рядом с одним ядром | Полицентричный, поскольку он находится рядом с двумя или многими разными ядрами |
| Эффект ядра | |
| На электронное облако может воздействовать одно ядро | На электронное облако могут воздействовать два или более ядер. |
| Типы и номенклатура | |
| Найдено как a, p, d и f | Состоит из двух типов: связывающие молекулярные орбитали или разрыхляющие молекулярные орбитали. |
| Влияние электронной конфигурации | |
| Электронная конфигурация не влияет на стабильность атома. | Электронная конфигурация действительно влияет на стабильность молекулы. |
Что такое атомная орбиталь?
Область, в которой существует наибольшая вероятность обнаружения электрона, известна как атомная орбиталь. Возможность расположения атомного электрона можно объяснить с помощью квантовой механики. Но квантовая механика не может объяснить конкретную энергию электрона в определенный момент времени. Эта конкретная энергия объясняется принципом неопределенности Гейзенберга.
Решения уравнения Шредингера используются для определения электронной плотности данного атома. На атомной орбитали может находиться максимум два электрона. Атомная орбиталь классифицируется по подуровням как s, p, d и f. Орбитали этих подуровней имеют разную форму.
Орбиталь подуровня s оказывается сферической и содержит максимум два электрона и состоит только из одного подуровня энергии. По форме p-орбиталь представляет собой гантель и содержит до шести электронов. В нем присутствуют три субэнергетические стадии.
Орбитали d и f содержат более сложные формы, поскольку орбиталь d содержит пять подуровней энергии и до 10 электронов. В то время как f-орбиталь содержит семь подуровней энергии и максимум от десяти до пятнадцати электронов. Уровни энергии орбиталей присутствуют в направлении s
Что такое молекулярная орбиталь?
Теория молекулярных орбиталей объяснила свойства молекулярных орбиталей. Теория молекулярных орбиталей была впервые предложена Ф. Хундом и Р. С. Малликеном в 1932 г.
Согласно теории молекулярных орбиталей, когда атомы соединяются в молекулу, перекрывающиеся атомные орбитали обычно теряют свою форму из-за влияния ядер. Новые орбитали, которые встречаются в молекулах, теперь известны как молекулярные орбитали.
Слияние атомных орбиталей, которые состоят из относительно одинаковой энергии, отвечает за образование молекулярных орбиталей. Молекулярные орбитали не принадлежат только одному атому в молекуле, как в атомной орбитали, но они входят в ядра всех атомов, которые образуют молекулу. Итак, ядра многих разных атомов действуют как полицентрические ядра.
Окончательная форма молекулярных орбиталей сложна, потому что форма атомных орбиталей, из которых строятся молекулы, обычно определяет форму молекулярных орбиталей. В соответствии с правилом Ауфбау молекулярные орбитали обычно заполняются в порядке от низкоэнергетической орбитали к высокоэнергетической орбитали.
Ключевые отличия
Заключение
Вышеупомянутое обсуждение заключает, что свойства атомных орбиталей могут определяться одним ядром атомов. Напротив, свойства молекулярных орбиталей могут быть определены слиянием атомных орбиталей, из которого строится молекула.
Химия. 10 класс
§ 1. Строение атома. Состояние электрона в атоме. Атомная орбиталь
Строение атома. Состояние электрона в атоме. Атомная орбиталь
В центре атома находится положительно заряженное ядро. Заряд ядра равен атомному номеру элемента в периодической системе. Вокруг ядра движутся отрицательно заряженные электроны, образуя электронную оболочку. Положительный заряд ядра компенсируется отрицательным зарядом электронов, поэтому атом электронейтрален.
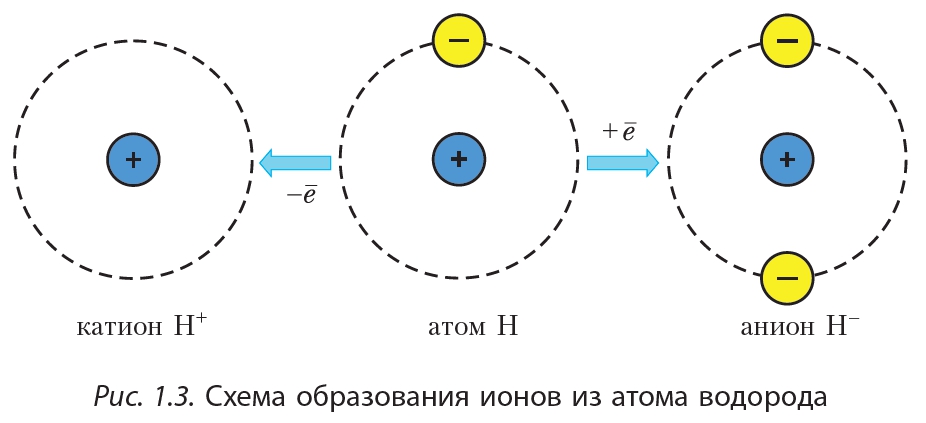
Например, атом водорода состоит из ядра, заряд которого равен 1+, и одного электрона. Заряд ядра атома гелия равен 2+, поэтому в атоме гелия два электрона (рис.1.2).
Если атом отдаёт электрон, то образуется положительно заряженный ион – катион. Если атом присоединяет электрон, то образуется отрицательно заряженный ион – анион (рис.1.3).
Глядя на рисунки 1.2 и 1.3, можно ошибочно предположить, что электроны вращаются вокруг атомного ядра подобно тому, как планеты вращаются вокруг солнца. В действительности траекторию движения электрона в атоме определить невозможно. Каждый электрон образует вокруг ядра облако отрицательного заряда определённой формы и размера – электронное облако. Например, единственный электрон в атоме водорода образует облако сферической формы (рис. 1.4).
Глядя на рисунки 1.2 и 1.3, можно ошибочно предположить, что электроны вращаются вокруг атомного ядра подобно тому, как планеты вращаются вокруг солнца. В действительности траекторию движения электрона в атоме определить невозможно. Каждый электрон образует вокруг ядра облако отрицательного заряда определённой формы и размера – электронное облако. Например, единственный электрон в атоме водорода образует облако сферической формы (рис. 1.4).
Чтобы лучше представить электронное облако, проведём мысленный эксперимент. Допустим, у нас есть возможность фотографировать атом водорода в различные моменты времени, тогда на фотографиях мы будем видеть электрон в различных положениях относительно ядра (рис. 1.5).
Если сделать много таких снимков и наложить фотографии друг на друга, по густоте точек мы увидим, насколько часто электрон оказывается в данной области пространства.
Из рисунка 1.5 видно, что электрон в атоме водорода чаще всего находится в непосредственной близости от ядра, по мере удаления от ядра вероятность обнаружить электрон резко снижается.
У электрона есть ещё одна особенность. В атоме водорода электрон может иметь не любые, а только определённые значения энергии. Эти значения энергии электрона в атоме водорода называются энергетическими уровнями. Энергетические уровни обозначаются номерами.
На рисунке 1.6 показаны энергетические уровни атома водорода.
Электрон может переходить с одного энергетического уровня на другой. При переходе с первого уровня на второй он поглощает порцию энергии, равную Е2 – Е1, при обратном переходе он излучает такую же порцию энергии.
Теперь мы можем уточнить понятие орбиталь, которое было введено в курсе химии 8-го класса. Мы уже знаем, что электрон в атоме может находиться только в определённых состояниях. Каждому состоянию соответствует определённое значение энергии и определённая форма электронного облака. Электронное состояние называется орбиталью.
| Атомная орбиталь – состояние электрона в атоме, характеризующееся определёнными значением энергии, формой и пространственной ориентацией электронного облака. |
Электронное облако не имеет чётких границ, поэтому при изображении формы орбитали приводят не всё электронное облако, а лишь ту область пространства, внутри которой вероятность обнаружить электрон достаточно большая.
Орбитали могут иметь различную форму. Орбитали сферической формы называются s-орбиталями:
В атомах имеются также d- и f-орбитали ещё более сложной формы, с ними можно ознакомиться, перейдя по ссылке в QR-коде.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Каждый электрон в атоме находится в состоянии с определённой энергией (занимает определённую атомную орбиталь).
Орбиталь характеризуется энергией и формой электронного облака.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.