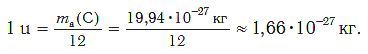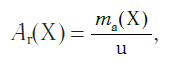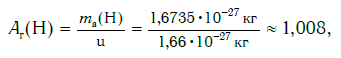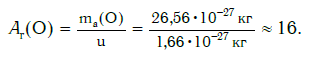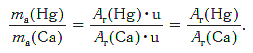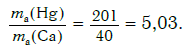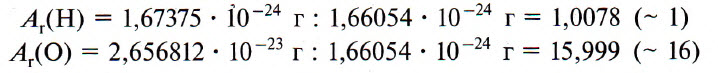Что называют атомной массой
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
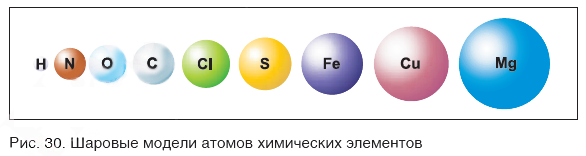
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
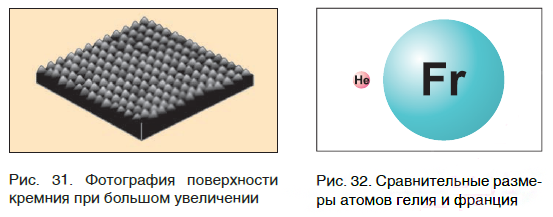
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
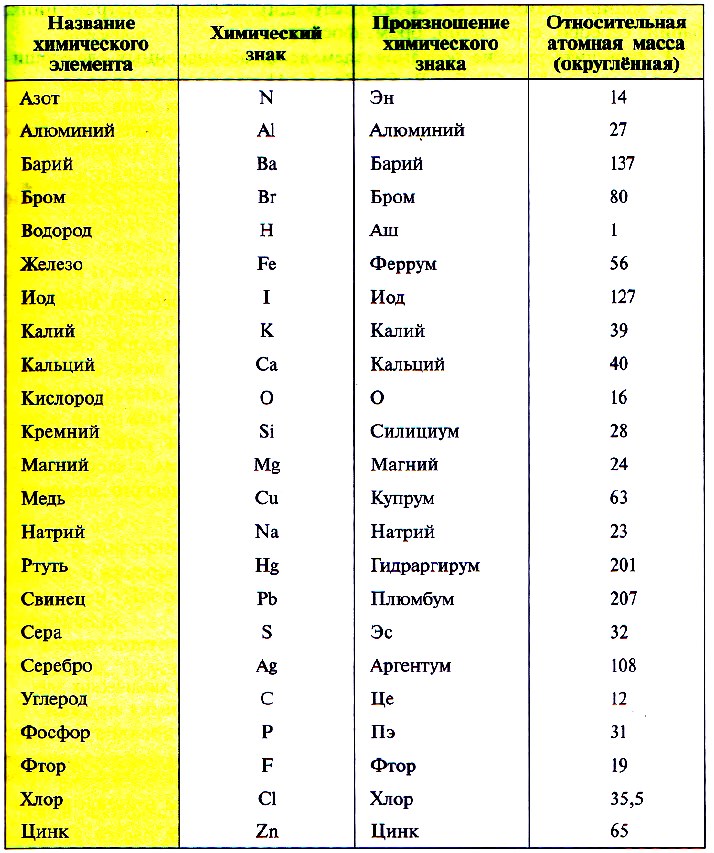
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Что называют атомной массой
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Относительная атомная масса элемента
Абсолютные массы атомов Одним из фундаментальных свойств атомов, является их масса. Абсолютная (истинная) масса атома – величина чрезвычайно малая. Взвесить атомы на весах невозможно, поскольку таких точных весов не существует. Их массы были определены с помощью расчетов.
Например, масса одного атома водорода равна 0,000 000 000 000 000 000 000 001 663 грамма!
Масса атома урана – одного из самых тяжелых атомов, составляет приблизительно 0,000 000 000 000 000 000 000 4 грамма. Записывать и читать эти числа непросто; можно ошибиться, пропустив ноль или добавить лишний. Существует другой способ записи – в виде произведения: 4 ∙ 10−22 (22 – количество нулей в предыдущем числе).
Точное значение массы атома урана – 3,952 ∙ 10−22 г, а атома водорода, самого легкого среди всех атомов, – 1,673 ∙ 10−24 г. Производить расчеты с малыми числами неудобно. Поэтому вместо абсолютных масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома (находить отношение их масс). С момента определения относительных атомных масс элементов использовались различные атомы в качестве сравнения. Своеобразными эталонами для сравнения в свое время были атомы водорода и кислорода.
Единая шкала относительных атомных масс и новая единица атомной массы, принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961). По сегодняшний день эталоном для сравнения является 1/12 часть массы атома углерода. Данное значение называют атомной единицей массы, сокращенно а.е.м
Атомная единица массы (а.е.м.) – масса 1/12 части атома углерода
Сравним, во сколько раз отличается абсолютная масса атома водорода и урана от 1 а.е.м., для этого разделим эти числа одно на другое:
Полученные при расчетах значения и являются относительными атомными массами элементов – относительно 1/12 массы атома углерода.
Так, относительная атомная масса водорода приблизительно равна 1, а урана – 238. Обратите внимание, что относительная атомная масса не имеет единиц измерения, так как при делении единицы измерения абсолютных масс (граммы) сокращаются. Относительные атомные массы всех элементов указаны в Периодической Системе химических элементов Д.И. Менделеева. Символ, при помощи которого обозначают относительную атомную массу – Аr (буква r – сокращение от слова relative, что означает относительный).
Значения относительных атомных масс элементов используются во многих расчетах. Как правило, значения, приведенные в Периодической Системе, округляются до целых чисел. Обратите внимание, что элементы в Периодической Системе размещены в порядке увеличения относительных атомных масс. Например, при помощи Периодической Системы определим относительные атомные массы ряда элементов:
Ar(Na) = 23;
Относительную атомную массу хлора принято записывать равной 35,5!
АТОМНАЯ МАССА
Полезное
Смотреть что такое «АТОМНАЯ МАССА» в других словарях:
АТОМНАЯ МАССА — масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы) … Большой Энциклопедический словарь
Атомная масса — Atomic mass масса атома химического элемента, выраженная в атомных единицах массы (а.е.м.). За 1 а.е.м. принята 1/12 часть массы изотопа углерода с атомной массой 12. 1 а.е.м.=1,6605655·10 27 кг. Атомная масса складывается из масс всех протонов и … Термины атомной энергетики
атомная масса — – масса атомов элемента, выраженная в атомных единицах массы. Масса такого количества элемента, в котором содержится то же число атомов, что и в 12 г изотопа 12C. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
АТОМНАЯ МАССА — безразмерная величина. А. м. масса атома хим. элемента, выраженная в атомных единицах (см.) … Большая политехническая энциклопедия
АТОМНАЯ МАССА — (устаревший термин атомный вес), относительное значение массы атома, выраженное в атомных единицах массы (а. е. м.). А. м. меньше суммы масс составляющих атом ч ц на дефект масс. А. м. была взята Д. И. Менделеевым за осн. хар ку элемента при… … Физическая энциклопедия
атомная масса — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN atomic weight … Справочник технического переводчика
Атомная масса — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей. Атомная масса, относительная атомная масса (устаревшее название атомный вес) значение масс … Википедия
атомная масса — масса атома, выраженная в атомных единицах массы. За атомную массу химического элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания (эта величина приведена в периодической… … Энциклопедический словарь
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Cheminio elemento vidutinės masės ir nuklido ¹²C atomo masės 1/12 dalies dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse … Penkiakalbis aiškinamasis metrologijos terminų žodynas
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas