Что называется установочным раствором
Рабочие растворы, их приготовление. Установочные (исходные) вещества. Поправочный коэффициент
Рабочие растворы, или титранты, получают растворением точной навески (точно взвешенного вещества) хорошо очищенного исходного вещества в определенном объеме воды в мерной колбе и доводят водой до метки. Такие растворы можно приготовить только в том случае, если первичный стандарт, т.е. вещество, из которого готовят такой раствор, отвечает целому ряду требований: имеет хорошо известный состав, точно отвечающий химической формуле; устойчиво при хранении; легко растворяется в воде; обладает большой молярной массой (чем больше масса моля данного исходного вещества, тем меньше ошибка при взвешивании). Лишь немногие вещества удовлетворяют или почти удовлетворяют этим требованиям, и поэтому число веществ, пригодных в качестве первичных стандартов, ограничено.
Например, растворы НСl, H2SO4, HNO3 нельзя приготовить из точных навесок, так как эти исходные вещества содержат некоторое количество воды. Растворы NaOH или КОН поглощают СО2 и воду из воздуха, и их растворы также нельзя приготовить из точных навесок. Растворы этих веществ готовят приблизительно, а затем приготовленные растворы стандартизируют, т.е. устанавливают концентрацию точно. Эти растворы называются вторичными стандартами. Для их стандартизации применяют первичные стандарты. В качестве первичных стандартов используется декагидрат тетрабората натрия Na2B4O7 • 10Н2О, оксалат натрия Na2C2O4, дихромат калия К2Сr2O7 и др.
Для приготовления рабочих растворов применяются также стандарт-титры, или фиксаналы. Это стеклянные ампулы, которые содержат точно известное количество вещества. Содержимое ампулы количественно переносят в мерную колбу на 1 л, после чего растворяют вещество и доводят объем водой до метки. Фиксаналы выпускаются промышленностью.
Иногда для выражения точной концентрации рабочего раствора пользуются так называемым поправочным коэффициентом К. Поправочный коэффициент равен отношению экспериментально найденной точной молярной концентрации эквивалента C1(1/zX) рабочего раствора к предполагаемой молярной концентрации эквивалента C2(1/zX).
Поправочный коэффициент показывает, на какое число следует умножить объем раствора предполагаемой молярной концентрации эквивалента, чтобы получить его точную концентрацию. Например, имеется приблизительно 0,1 н. раствор, для которого К = 1,146. Тогда точное значение нормальности раствора равно: 0,1 • 1,146 = 0,1146 н.
Это означает, что 0,1 н. раствор НСl при К = 1,146 в 1,146раз более концентрирован, чем 0,1 н. раствор. Следовательно, 1мл данного раствора соответствует 1,146мл 0,1 н. раствора. Если известна навеска растворенного х.ч. вещества и объем раствора, то поправка может быть вычислена из отношения:
К = Точно взятая навеска вещества
Рассчитанная навеска вещества
Пример. Из 1,340 г х.ч. NaCl приготовлено 200 мл раствора. Вычислите поправку этого раствора к 0,1 н. раствору.
Решение.В 200 мл 0,1 н. раствора NaCl должно содержаться:
58,45 • 0,1 • 200 / 1000 = 1,169 г
К = 1,340 / 1,169 = 1,146.
Если рабочий раствор приготовлен точно заданной концентрации из фиксанала или по точно взятой навеске, то К = 1.
Поправочный коэффициент очень удобен при серийных определениях.
Дата добавления: 2014-11-13 ; просмотров: 75 ; Нарушение авторских прав
Иодометрия. Рабочие растворы, установочные вещества, индикаторы, условия титрования метода.



Билет
1. Стандартные растворы, способы их приготовления. Примеры.
Стандартный раствор, титрованный раствор, раствор с точно известной концентрацией реактива химического. Стандартный раствор применяется в методах титриметрического анализа для установления количества определяемого вещества посредством титрования до точки эквивалентности, обычно фиксируемой по изменению окраски индикатора химического или титруемого раствора. Для расчетов результатов устанавливают количество (объём, иногда масса) стандартного раствора, затраченного на взаимодействие с определяемым веществом. Точность определений зависит от правильности установления концентрации стандартного раствора. Обычно её выражают нормальностью. Для практических целей пользуются также титром.
Первичный стандартный раствор можно приготовить сразу с точно известной концентрацией и не стандартизировать.
Способы приготовления первичных стандартных растворов: 1. Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки. Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле :
m(A) =C( 

C( 

m(Na2B4O7 ∙ 10Н2О)=C( 

перенесли ее в мерную колбу вместимостью 100,0 мл, растворили и довели дистиллированной водой до метки. Рассчитаем точную концентрацию полученного первичного стандартного раствора:
C( 

Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стан- дартного раствора, приготовленного из фикса- нала в мерной колбе вместимостью V, находят по формуле: C( 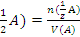
Вторичный стандартный раствор готовят в два этапа. 1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями). 2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора. Например, рабочие растворы HCl и NaOH можно приготовить как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 × 2H2O. Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
2. Объективные ошибки фотометрии, рассмотреть на примере зависимости А от t°, С, τ, РН – среды.
. Реакцию переведения определяемого иона в окрашенное соединение можно представить уравнением : Х + R* ХR
· Например, ион железа (III) слабожелтый, ион роданида бесцветный, а роданидный комплекс железа ярко-красный. Характер светопоглощения при образовании комплекса может сильно изменяться, примером такого изменения могут служить спектрофотометрические кривые.
Интенсивность окраски раствора, зависящая от соотношения концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, так как при этом происходит одновременное изменение степени диссоциации. В результате при разбавлении или при концентрировании растворов наблюдаются отклонения от основного закона фотометрии.
· Большинство окрашенных соединений чувствительно к концентрации ионов водорода. При изменении рН раствора происходит изменение молярного коэффициента поглощения, а очень часто изменение и кривой светопоглощения.
3. Полярные и неполярные молекулы.Факторы, определяющие полярность молекулы.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3(молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
| H δ+ → Cl δ− | B δ+ → F δ− |
| C δ− ← H δ+ | N δ− ← H δ+ |
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
На полярность молекулы влияет величина дипольного момента, ориентация молекулы и ее деформация.
4. Особенности коллоидных ПАВ.Солюбилизация.
Коллоидными ПАВ называют поверхностно-активные вещества, способные в растворах образовывать мицеллы, т.е. ассоциаты, состоящие из большого количества молекул ПАВ (от 20 до 100).
Высокая поверхностная активностьзависит от длины углеводородного радикала. Увеличение длины на одну группу СН2 приводит к возрастанию поверхностной активности в 3,2 раза (правило Дюкло-Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ. Для органических сред это правило обращается, то есть с увеличением длины у/в радикала поверхностная активность уменьшается.
Билет
Иодометрия. Рабочие растворы, установочные вещества, индикаторы, условия титрования метода.
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия.
Установочное вещество-это устойчивые, химически чистые соединения точно известного состава.  11265
11265
7)Что называют титрантом (стандартным раствором). Указать основные способы приготовления титранта. Можно ли приготовить стандартный раствор NaOH по точной массе?
Способы приготовления:
а) Первичный стандартный раствор (исходный) – это раствор, приготовленный из стандартного (установочного) вещества, концентрация которого известная по массе этого вещества в определенном объеме раствора. С помощью этих растворов устанавливают концентрацию рабочих растворов.
б) Рабочий раствор (вторичный стандартный раствор) – это раствор, концентрация которого установлена стандартизацией. С помощью рабочих растворов проводят титриметрические определения
Титрант этих растворов готовят приблизительной концентрации, разбавляя водой 50%-ный раствор (растворимость карбоната натрия в концентрированном растворе NaOH мала), а затем стандартизируют его по дигидрату щавелевой кислоты.
б)Нельзя приготовить. Если вещество, используемое для приготовления стандартного раствора, содержит примеси, нестойкое, гигроскопично или поглощает СО2 из воздуха как например NaOH, KOH, то концентрация раствора, приготовленного из такого вещества, будет приблизительной. Точную концентрацию его устанавливают титрованием другим стандартным раствором известной концентрации.
8)Объясните, как готовится рабочий раствор HCl.
4) В мерную колбу на 250 мл налить дистиллированной воды, отмерьте при помощи мерного цилиндра рассчитанный объем концентрированного раствора и осторожно вылить его в мерную колбу, ополоснуть мерный цилиндр 2-3 раза дистиллированной водой, сливая промывную жидкость в ту же колбу, затем довести объем раствора до 250 мл дистиллированной водой. Полученный раствор тщательно перемешайте и определяют точную концентрацию HCl в полученном растворе.
Установка концентрации соляной кислоты по тетраборату натрия, образованным сильным основанием и слабой кислотой:
В основе метода стандартизации рабочего раствора HCl лежат следующие реакции:
а) гидролиз тетрабората натрия (бура): Na2B4O7 + 7H2O = 2NaOH + 4H3BO3 с образованием эквивалентного количества щелочи, которую и оттитровывают раствором HCl в присутствии индикатора метилрота;
б) взаимодействие образованной щелочи с хлороводородной кислотой: HCl + NaOH = NaCl + H2O. Суммарно уравнение реакции имеет вид: Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3.
9)Классификация методов титриметрического анализа. Приведите примеры.
2.Метод оксидиметрии (окислит.- восстановит. Титрование. В основе метода лежат ОВР.)по характеру титранта:
Титранты: растворы KMnO4,K2Cr2O7,I2,Na2S2O3
Определяемые вещества: окислители и восстановители.
3.Метод комплексометрия. В основе метода лежит реакция комплексообразования
Например:
Если в качестве титранта используются комплексоны (трилон Б), то такой метод называется комплексонометрия.
Определяющие вещества: катионы металлов.
4.Метод осаждения.
Основу метода состовляет реакция с образованием осадка. Наибольшее практическое значение имеют методы, основанные на осаждении нитратом серебра и нитратом ртути.
В титриметрическом анализе используют следующие способы титрования: а) прямое; б) обратное; в) заместительное (титрование заместителя).
Прямое титрование – титрование, при котором к раствору определяемого вещества непосредственно прибавляют из бюретки раствор титранта до состояния эквивалентности (резкое изменение цвета раствора или выпадение осадка). В этом случае расчет концентрации определяемого вещества в растворе проводят по формуле: c( fэкв A)*V(A) = c( fэкв В)*V(В)
Обратное титрование (титрование по остатку) – титрование непрореагировавшего вещества, которое прибавлено в избытке к анализируемому раствору в виде стандартного раствора.
Обратное титрование используют в том случае, если определяемое вещество летучее или неустойчивое, и поэтому при прямом титровании возможна потеря определяемого вещества, либо реакция протекает медленно, либо отсутствует подходящий индикатор.
Заместительное титрование (косвенное титрование) – титрование, при котором определяемое вещество не реагирует с титрантом непосредственно или реагирует, но не в стехиометрическом соотношении, а определяется косвенно в результате использования стехиометрически протекающей реакции с образованием другого вещества, количественно реагирующего с титрантом.
11)Какие вещества называют установочными? Каким требованиям они должны отвечать? Приведите примеры.
Примеры:
Какие растворы называются рабочими?
Титриметрический анализ. Кислотно-основное титрование
В чем сущность титриметрического анализа?
Титриметрия (титриметрический анализ) – это количественный химический метод анализа, основанный на точном измерении объема стандартного раствора (титранта), вступающего в реакцию с определяемым веществом.
Стандартнымназывается раствор реагента с точно известной концентрацией. Стандартный раствор добавляется из бюретки по каплям к определенному объему анализируемого раствора. Этот процесс называется титрованием.
Состояние системы, когда количество добавляемого титранта эквивалентно количеству определяемого вещества, называется точкой эквивалентности,или теоретической точкой конца титрования. Для фиксирования точки эквивалентности используют различные индикаторы или инструментальные методы. Резкое изменение окраски индикатора соответствует конечной точке титрования, которая, строго говоря, не всегда совпадает с точкой эквивалентности.
Титриметрия как метод анализа имеет ряд достоинств. Во-первых, этовысокая скорость и точность анализа, а также применимость для определения различных количеств веществ. Во-вторых,этим методом в одном и том же растворе часто можно определять одновременно несколько веществ. Еще одно достоинство –возможность автоматизировать титрование.
В титриметрии применяются реакции, удовлетворяющие следующим требованиям.
Что такое точка эквивалентности и конечная точка титрования? Чем они отличаются?
Точка эквивалентности и конечная точка титрования. Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, прибавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором.
В каких единицах и с какой точностью принято измерять обьем в титриметрическом анализе?
Обьем растворов, затраченных на титрование измеряются в мл, и записываются с точностью 0,02-0,03 мл.
Каким требованиям удовлетворяют стандартные вещества?
1. Стандартное вещество должно иметь кристаллическую структуру и отвечать определенной химической формуле.
2. Химический состав вещества должен отвечать формуле.
3. Стандартное вещество не должно содержать посторонних примесей больше, чем допустимые границы для веществ квалификации “х.ч.”.
4. Способы очистки стандартного вещества от сопутствующих примесей (кристаллизация, экстракция, возгонка и т.д.) должны быть доступными в аналитической лаборатории.
5. Стандартное вещество не должна быть гигроскопическим, но должно сравнительно хорошо растворяться.
6. Растворы стандартного вещества не должны изменять своего титра при хранении и контакте с воздухом.
7. Стандартное вещество должно иметь по возможности большую эквивалентную массу. Чем большая эквивалентная масса вещества, тем большая точность установления титра раствора, так как при взвешивании вещества с большой молекулярной массой погрешность взвешивания окажется незначительной.
Какие растворы называются рабочими?
Рабочим раствором называется раствор, с помощью которого проводится титриметрическое определение, т. е. это раствор, которым титруют.
Применяемые в титриметрическом анализе рабочие растворы точно известной концентрации готовят несколькими способами:
· из фиксаналов. Этим термином называют запаянную стеклянную ампулу, в которой содержится определенное количество реагента, обычно 0,1000 моль эквивалента. Фиксаналы готовят в заводских условиях. Если в лаборатории количественно перенести содержимое фиксанала в мерную колбу на 1000 мл и довести растворителем до метки, получится литр точно 0,1000 н раствора. Приготовление фиксанальных растворов не только экономит время аналитика, но и позволяет готовить растворы с точно известной концентрацией из таких веществ, которые не обладают комплексом свойств, необходимых для первичных стандартов (например, фиксанальные растворы соляной кислоты, аммиака или иода).
· по приблизительно известной навеске химического реактива, взятой на технических весах. Эту навеску растворяют в приблизительно известном количестве растворителя. Затем проводят дополнительную операцию – стандартизацию полученного раствора. Например, титруют полученным раствором точную навеску другого вещества (первичного стандарта). Можно поступить и по-другому: взять известный объем (аликвоту) приготовленного раствора и оттитровать его подходящим стандартным раствором. По объему, пошедшему на титрование, рассчитывают точную концентрацию приготовленного раствора. Такие растворы называют стандартизованными. Например, раствор КОН стандартизуют по навеске щавелевой кислоты или с помощью фиксанального раствора соляной кислоты. Если вещество в лаборатории имеется в виде концентрированного раствора приблизительно известной концентрации (например, соляная кислота), то вместо его взвешивания отмеривают некоторый, заранее рассчитанный объем концентрированного раствора. Это требует знания плотности исходного раствора. Затем, как и в предыдущем случае, стандартизуют полученный раствор.
Приготовление растворов с точно известной концентрацией требует использования целого набора специальной мерной посуды, позволяющей измерять объемы с требуемой точностью. Это мерные колбы, пипетки и бюретки. В руководствах к лабораторным работам приводятся описания мерной посуды и правила работы с ней.
ТИТРИМЕТРИЧЕСКИЕ (ОБЪЕМНЫЕ) МЕТОДЫ АНАЛИЗА, точное измерение объемов веществ
ТИТРИМЕТРИЧЕСКИЕ (ОБЪЕМНЫЕ) МЕТОДЫ АНАЛИЗА, точное измерение объемов веществТЕМА 8
Техника выполнения титриметрического анализа.
Приготовление раствора по точной навеске вещества. Молярные растворы.
Затем на аналитических весах взвешивают три навески (равные вычисленной массе) с точностью до 0,0001 г. Эти навески переносят в чистые колбы и растворяют в дистиллированной воде (по 0,25 мл) или в отдельных случаях в кислоте. После полного растворения навески растворы титруют раствором титранта, титр которого необходимо установить.
Расчет титра раствора титранта (Тт) проводят по формуле
В 3-х опытах титр рассчитывают для каждой навески отдельно и по найденным значениям определяют его среднее значение и по полученной величине находят среднее значение нормальности Nпр и коэффициента нормальности К титранта по формулам
Нормальность рассчитывают по формуле
График зависимости рН раствора от количества прибавленного титранта наз-ся кривой титрования. Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и помогают сделать правильный выбор индикатора.
Построение кривой титрования сводится к вычислению рН и концентрации титруемого вещества, соли и избыточного титранта в точках, когда к 100 мл титруемого раствора прибавлено 0; 10; 50; 90; 99; 100; 101; 110; 150; 190; 200 мл титранта.
Вычисления концентрации компонентов производят по формулам:
В нулевой точке концентрация титруемого раствора задается условиями задачи. рН рассчитывается по формулам: для сильных кислот:
т.е. рН равняется отрицательному десятичному логарифму концентрации к-ты; для сильных гидроксидов
смесь растворов слабого гидроксида и его соли (щелочной буферный
Элементы титриметрического анализа. Основные понятия термины и формулы.
Если известны нормальности 2-х растворов и их объемы, при которых достигается точка эквивалентности, то можно вычислить количества эквивалента кислоты и щелочи:
где V (Н2SО4) и V(NаОН) выражены в миллилитрах.
Таким образом, при подстановке правых частей 2-х последних уравнений в предыдущее равенство получим очень важное для титриметрического анализа выражение принципа эквивалентности:
В общем виде для любых случаев титрования это соотношение имеет следующее выражение:
Из этого соотношения следует:
Если известен объем анализируемого раствора, то по последнему уравнению можно рассчитать его нормальность:
Вычислив по результатам титрования нормальность анализируемого раствора из вышеприведенных уравнений можно определить массу вещества в любом объеме раствора.
При рассмотрении большинства химических реакций удобно пользоваться понятиями эквивалента и фактора эквивалентности.
К реакциям, протекающим в стехиометрических отношениях, применим закон эквивалентов. Поэтому, если реакция проведена до конца, число эквивалентов определяемого компонента равно числу эквивалентов реагента. Т. е. моль эквивалента любой кислоты способен нейтрализовать моль эквивалента любого основания. Таким образом, и при титровании, поскольку его заканчивают в точке эквивалентности, всегда затрачиваются одинаковые количества эквивалента титруемого и титрующего веществ. Например, в точке эквивалентности титрования раствора Н2SО4 раствором щелочи (Н2SО4 +2NаОН =Nа2SО4 +2Н2О) количества эквивалентов Н2SО4 и NаОН равны между собой: n(1/2Н2SО4=n(NаОН).
Методы титриметрического анализа.
Следовательно, на реакцию израсходовали
По уравнению реакции нетрудно вычислить какой массе NаОН, находящегося в растворе, соответствует эта масса кислоты:
Преимущество титриметрического анализа перед гравиметрическим состоит в скорости, т. е. быстроте определения. В гравиметрическом анализе осаждение (выполнение реакции) для получения осаждаемой формы является лишь началом определения, в титриметрическом анализе выполнение реакции (титрование) и заканчивает определение. Практически одинакова и точность этих анализов.
Стандартные и стандартизированные растворы.
Титрованные растворы могут быть получены разными способами и поэтому различают стандартные (приготовленные) и стандартизированные (установленные) р-ры. Стандартные р-ры. Точную навеску в-ва переносят в мерную колбу определенной емкости, растворяют и доводят объем р-ра водой до метки. В этом случае титр р-ра равен навеске (m, г), деленной на объем р-ра (V, мл): Т = m/V. Чтобы перейти к молярной концентрации эквивалента (с), достаточно титр рас-ра умножить на 1000 и разделить на молярную массу эквивалента растворенного в-ва. Например, если 0,5312 г карбоната натрия Nа2СО3 растворили в мерной колбе вместимостью 100 мл, то титр раствора равен Т=0,5312/100=0,005312 г/мл, а молярная концентрация эквивалента с=0,005312· 1000/53,0=0,1002. Титрованные растворы, полученные по точной навеске вещества, называют стандартными (приготовленными).
Подобным способом могут быть приготовлены р-ры, отвечающие определенным требованиям: они должны быть хч; устойчивыми при хранении как в твердом виде, так и в растворе; состав их должен строго соответствовать определенной химической формуле. Такие р-ры называют первичными стандартами для установления титра других рабочих растворов. Примеры, для установки титра кислот служат тетраборат натрия Nа2В4О7· 10Н2О и карбонат натрия Nа2СО3. Титры (или нормальные концентрации) растворов оснований устанавливают по таким исходным стандартным веществам, как щавелевая Н2С2О42Н2О или янтарная Н2С4Н4О4. Таким образом, теперь следует объяснить, что такое стандартизированные растворы. Как можнопонять из вышесказанного к ним относятся вещества, не обладающие вышеперечисленными свойствами стандартных растворов. Это минеральные кислоты, щелочи, перманганат калия, тиосульфат натрия. Точные их растворы не возможно приготовить по навеске, т. к. продажные минеральные к-ты имеют непостоянный состав, а выделить их в чистом виде невозможно. А щелочи NаОН и КОН даже при взвешивании поглощают С (1V) и воду из воздуха, т. е. изменяют свой состав Перманганат калия и тиосульфат изменяются при растворении, взаимодействуя с примесями воды.
Рассказать, как готовят раствор из фиксанала (боек, воронка, промывалка). Титрованные растворы обычно хранятся несколько месяцев, если нет специальных указаний, особенно требовательны в этом отношении едкие щелочи, при хранении их необходимо предохранять от контакта с воздухом, их хранят в полиэтиленовой плотно закрытой посуде. Для титрования стандартными растворами есть специальные столы и титровальные установки, которые используются при серийных анализах. При этом стандартные или установочные растворы не контактируют с воздухом и с помощью специальных сифонов раствор поступает в бюретку, есть специальные автоматические бюретки. При пользовании мерной посудой существуют определенные правила пользования и мойки. Для бюреток: каждое титрование начинают с конечного деления шкалы, т. к. при этом лучше всего компенсируются погрешности калибрования бюретки.
Выпускают раствор из бюретки не очень быстро (не более 3-4 капель в секунду). Иначе раствор не будет вовремя стекать со стенок и отсчет окажется неверным. Объем расходуемого на тирование р-ра не должен превышать вместимость одной бюретки и не превышать 20 мл для 25 мл бюретки и 30 мл для бюретки на 50 мл. Ошибка на +- 0,02 мл составит 0,02·100 / 10мл = 0,2%. После окончания работы сливают раствор из бюретки, моют, наполняют дистиллированной водой и накрывают пробиркой для предохранения от пыли. Правила заполнения раствором бюретки и удаление пузырьков воздуха. Пипетки. Не следует выдувать или вытряхивать последние капли жидкости из пипетки, моют пипетки обычным способом, перед употреблением ополаскивают рабочим раствором, с которым будут работать. Проверка мерной посуды взвешиванием и бюреток по 5 мл р-ра и с учетом плотности воды и поправки на температуру. Вычисления в титриметрическом анализе.
Главный принцип: вещества реагируют друг с другом всегда в эквивалентных количествах. Так на титрование до точки эквивалентности всегда расходуется одинаковое число эквивалентных масс кислоты и основания. Следовательно при одинаковой нормальной концентрации растворов реагирующих веществ реакции идут между их равными объемами. Например, на титрование 10 мл 0,1н. р-ра всякой кислоты расходуется такой же объем 0,1 н. р-ра любой щелочи. В этом также удобство использования нормальных растворов.
Для расчета используют уравнение с1V1=с2V2. Задача: в мерную колбу внесли 0,6504 г продажной щавелевой к-ты. Растворили и довели объем до метки 100 мл. Пипеткой брали по 10 мл полученного р-ра и титровали 0,1026 н. р-ром гидроксида натрия, расход которого составил в среднем 9,85 мл. Определить массовую долю (%) щавелевой к-ты в продажном препарате. Вычисляем нормальную концентрацию раствора щавелевой к-ты: с(Н2С2О42Н2О) 10,00= 0,1026. 9,85; с =0,1026. 9,85/10,00 =0,1011. Затем находим массу щавелевой к-ты в 0,1 л р-ра. При этом исходить следует из того, что щавелевая к-та превращается в щавелевокислый натрий, следовательно, молярная масса эквивалента ее равна ½ молярной массы, т.е.126,6: 2=63,03 г/моль.
Поэтому m=0,1011. 63,03.0,1=0,6372 г. Следовательно, массовая доля (%) щавелевой к-ты равна: ω (Н2С2О42Н2О)= m (Н2С2О42Н2О)/ m(навески)= 0,6372/0,6504=0,9797, или 97,97%. В случае использования метода отдельных навесок уравнение с1V1=с2V2 не может быть использовано, т. к. навеску растворяют в произвольном объеме воды. Вычисляют результат, исходя из того, что при титровании в-ва взаимодействуют эквивалентными количествами. Какова массовая доля (%) Н2С2О42Н2О в образце щавелевой к-ты, если на титрование 0,1500 г его пошло 25,60 мл 0,09002 н. р-ра NаОН? Вычисляют, сколько молярных масс эквивалента NаОН содержалось в 25,60 мл раствора и участвовало в реакции: 1000 мл р-ра NаОН содержит 0,09002 молярных масс эквивалента NаОН, а 25,60 мл NаОН содержат х молярных масс NаОН, Х = 25,60. 0,09002 / 1000 = 0,002305 молярных масс эквивалента NаОН. Но при титровании 1 эквивалент в-ва взаимодействует с 1 эквивалентом другого. Т. е. Это означает, что в реакции участвовало также 0,002305 молярных масс эквивалента Н2С2О42Н2О. Молярная масса эквивалента щавелевой к-ты равна 63,03 г/моль. Следовательно, анализируемый раствор содержит 0,002305. 63,03 = 0,1453 г Н2С2О42Н2О. В массовых долях (%) это составляет: ω (Н2С2О42Н2О) = m (Н2С2О42Н2О)/m (образца) = 1,1435 г / 0,1500 г = 0,9686 (96,86%). Во многих случаях для уточнения результатов анализа (из-за неточности навесок при приготовлении растворов или исследуемого вещества) вводят понятие поправочного коэффициента.
Следовательно, для расчетов следующие основные правила:
Массу навески в-ва можно вычислить по формуле:



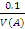

 11265
11265