Что называется термодинамическим процессом
Термодинамика
Лекция 1. Предмет технической термодинамики и ее методы
1. Предмет термодинамики
2. Основные параметры состояния тела
3. Понятие о термодинамическом процессе
4. Гомогенные и гетерогенные термодинамические системы
5. Термодинамическое равновесие
1. Предмет термодинамики
Термодинамика наука о превращениях различных видов энергии из одного в другой, и о наиболее общих макроскопических свойствах материи. Она изучает различные как физические, так и химические явления, обусловленные превращениями энергии. Применение закономерностей термодинамики позволяет анализировать свойства веществ, предсказывать их поведение в различных условиях. Термодинамика дает возможность исследовать различные процессы от простых в однородных средах до сложных с физическими и химическими превращениями, биологических и др.
Слово «термодинамика» происходит от греч. «therme» – тепло и «dynamis» – сила. Название науки возникло в период ее основания – в начале XIX в. В настоящее время слово «термодинамика» трактуют так: наука «о силах, связанных с теплотой».
Термодинамика основана на двух, экспериментально установленных законах (началах).
Первый закон (начало) является по существу законом преобразования и сохранения энергии применительно к процессам, изучаемым в термодинамике; невозможен процесс возникновения или исчезновения энергии.
Второй закон (начало) – определяет направление течения реальных (неравновесных) процессов; невозможен процесс, имеющий единственным своим результатом превращение теплоты в работу.
Термодинамический метод исследования основан на законах (началах) термодинамики и представляет собой их логическое и математическое развитие.
Объект исследования в термодинамике называют термодинамической системой или, в простом случае, термодинамическим телом. Одна из особенностей метода термодинамики состоит в том, что система (тело) противопоставляется всем другим телам, которые называют окружающей средой. Термодинамика построена дедуктивно: частные выводы получены из общих законов (начал).
Принято разделять термодинамику на физическую, или общую, химическую и техническую.
Физическая термодинамика разрабатывает метод термодинамики и применяет его для изучения фазовых превращений термоэлектрических и магнитных явлений, излучения, поверхностных явлений и т. п.
Химическая термодинамика изучает процессы с физическими и химическими превращениями с помощью метода термодинамики.
Техническая термодинамика устанавливает закономерности взаимного преобразования теплоты и работы, для чего изучает свойства газов и паров (рабочих тел) и процессы изменения их состояния; устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, протекающими в тепловых двигателях и холодильных установках. Одна из основных ее задач – отыскание наиболее рациональных способов взаимного превращения теплоты, и работы.
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС
всякое изменение, происходящее в термодинамич. системе и связанное с изменением хотя бы одного из её параметров состояния. Различают обратимые процессы, необратимые процессы и квазистатические процессы. Частные случаи Т. п.: адиабатный процесс, изобарический процесс, изотермический процесс, изохорический процесс, изоэнтальпийный процесс и изоэнтропийный процесс.
Смотреть что такое «ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС» в других словарях:
термодинамический процесс — термодинамический процесс; процесс Изменение состояния системы, характеризующееся изменением ее термодинамических параметров … Политехнический терминологический толковый словарь
термодинамический процесс — Изменение состояния термодинамической системы, характеризующееся изменением ее параметров. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика EN … Справочник технического переводчика
термодинамический процесс — – переход термодинамической системы из одного состояния в другое. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
термодинамический процесс — [thermodynamic process] процесс в макроскопической системе, связанный с переходом ее из одного равновесного состояния в другое в результате внешних воздействий. Различают следующие основные виды термодинамического процесса: адиабатный,… … Энциклопедический словарь по металлургии
термодинамический процесс — termodinaminis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Termodinaminių parametrų pokyčio sukeltas sistemos būsenos kitimas. atitikmenys: angl. thermodynamic process vok. thermodynamischer Prozess, m rus.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
термодинамический процесс — termodinaminis procesas statusas T sritis chemija apibrėžtis Termodinaminių parametrų pokyčio sukeltas sistemos būsenos kitimas. atitikmenys: angl. thermodynamic process rus. термодинамический процесс … Chemijos terminų aiškinamasis žodynas
термодинамический процесс — termodinaminis vyksmas statusas T sritis fizika atitikmenys: angl. thermodynamic process vok. thermodynamischer Prozeß, m rus. термодинамический процесс, m pranc. processus thermodynamique, m … Fizikos terminų žodynas
термодинамический процесс — termodinaminis procesas statusas T sritis Energetika apibrėžtis Makroskopinės sistemos pradinės būsenos virsmas galine būsena, būsenos kitimas dėl sistemos termodinaminių parametrų kitimo. atitikmenys: angl. thermodynamic process vok.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
термодинамический процесс — ▲ процесс ↑ теплота термодинамические процессы процессы энергетического взаимодействия вещества. расширение. < > сжатие. диссипация. экзотермический. < > эндотермический. изотонический. изоэнтропический. ↓ изотерма. изотермический (#… … Идеографический словарь русского языка
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Термодинамический процесс



Лекция 2
ПДК выбрососв АЭС 0,05 Зв/год для персонала0,005Зв/год для населения вблизи
Мы будем рассматривать только равновесные термодинамические процессы, протекающие в равновесных системах. Равновесным состояниемсистемы называется состояние, когда во всех точках системы давления и температуры одинаковы. Система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Процесс, проходящий через чередующиеся равновесные состояния системы называется равновесным процессом.
В противном случае система неравновесна. Все процессы, протекающие в реальном времени, как правило, неравновесны. Допущение о существовании равновесных систем основано на том, что любая система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией, а промежуток времени, в течение которого реальная система возвращается в состояние равновесия, называется временем релаксации. Если реальный процесс протекает медленнее, чем идёт релаксация, то процесс является равновесным. Дли разных процессов и разных параметров время релаксации различно. Внутренними процессами, компенсирующими нарушение равновесия при изменение состояния тела и восстанавливающими термодинамическое равновесие, являются элементарные процессы обмена энергией при столкновении молекул.
Интересно отметить, что превращение энергии поступательного движения молекул в энергию вращательного движения и обратно при столкновении молекул происходит весьма быстро. Так, давление в объёме выравнивается со скоростью звука (более 340 м/с в воздухе при нормальных физических условиях). Температура – значительно медленнее. Связано это с тем, что превращение энергии поступательного или вращательного движения молекул в колебательное при росте температуры осуществляется сравнительно медленно. Вообще все процессы обмена энергии, в которых участвуют колебательные степени свободы движения молекул, требуют для своего осуществления сравнительно большого времени.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным.
Теоретически равновесный процесс можно осуществить только при бесконечно медленном изменении состояний системы и внешних условий. В этом смысле время как действующий физический фактор в равновесных процессах не применяется.
Уравнение состояния F (Р, v, Т) = 0 в трёхосной системе координат Р, v и Т представляют собой поверхность, называемую термодинамической поверхностью. Если рассечь эту поверхность (рис. 1.8) плоскостями параллельными осям координат, то получим кривые. Например, сечение плоскостью Т = const даёт линию изменения давления в зависимости от объёма в координатах Р и v, Описываемый процесс называется изотермным.
В термодинамике чаще всего применяют двухосную систему с координатами Р и v (рис. 1.9).
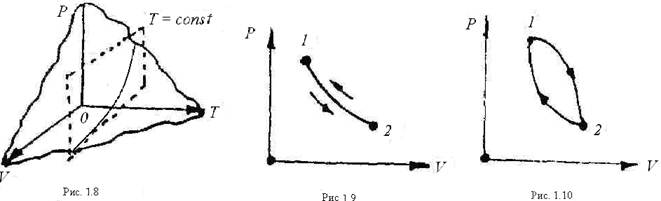 |
Процесс может быть прямым и обратным. Если система с параметрами Р1 и v1 (точка 1) переходит в состояние 2 с параметрами Р2 и v2, а затем возвращается в состояние 1, то такой процесс называется обратимым (рис. 1.9).Обратимым называется равновесный процесс, проходящий в прямом и обратном направлениях через ряд одинаковых состояний. В обратной последовательности состояний равновесного процесса рабочее тело и внешняя среда возвращаются в исходное состояние.
Процессы, не соответствующие этому условию, называются необратимыми. Все реальные процессы необратимы.
В начальном курсе термодинамики рассматриваются равновесные обратимые процессы, происходящие в закрытых (ΔМ = 0) системах:
1) изохорный, протекающий при неизменном объеме (v = const);
2) изобарный, протекающий при неизменном давлении (p = const);
3) изотермный, протекающий при неизменной температуре (Т = const);
4) адиабатный, совершающийся при отсутствии теплообмена (ΔQ =0);
5) политропный, обобщающий, процесс, частными случаями котоpoгo являются первые четыре процесса.
Особое значение имеют замкнутые процессы (или круговые). Это такие процессы, при которых система проходит ряд последовательных состояний, возвращаясь к первоначальному. Иначе такой процесс называется циклом (рис. 1.10).
2.1.Теплоёмкость идеальных газов
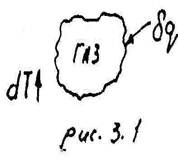
Отношение элементарного количества теплоты δQ, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела dT называется теплоёмкостью рабочего тела в данном процессе:
(Причина применения разных символов δ или d приэлементарных количествах теплоты и температуры будет объяснена ниже).
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от + ∞ до — ∞. При этом разница является суммой разниц внутренней энергии и работ процессов.
—удельную массовую теплоёмкость с, отнесенную к 1 кг вещества, Дж/(кг-К);
—удельную мольную теплоёмкость сμ, отнесенную к одному киломолю вещества, Дж/(кмоль-К).
Массовая удельная теплоёмкость (с) равна:
Молярная теплоёмкость µс равна:.
Зависимость между удельными теплоёмкостями устанавливается очевидными соотношениями:
Здесь ρн — плотность газа при нормальных условиях, [кг / м 3 ].
Из уравнения (1): δqx = сх · dТ
можно найти количество тепла, сообщённого телу в течение процесса
Изохорная теплоёмкость
В термодинамических расчетах большое значение имеет теплоемкость при постоянном объеме
Она равна отношению количества теплоты δqv, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела dТv;
— теплоемкость при постоянном давлении
| Теплоёмкость некоторых газов при температуре 0 0 С | |||
| Газ | Число степеней свободы | Мольная тепло- емкость, кДж/ (кмоль- К) | k=Cр / Cv |
| Гелий Не | 3 | 12,60 | 1,660 |
| Аргон Аr | 3 | 12,48 | 1,660 |
| Кислород О2 | 5 | 20,96 | 1,397 |
| Водород Н2 | 5 | 20,30 | 1,410 |
| Азот N2 | 5 | 20,80 | 1,400 |
| Метан СH4 | 6 | 26,42 | 1,315 |
| Аммиак NH3 | 6 | 26,67 | 1,313 |
| Диоксид угле- рода СО2 | 6 | 27,55 | 1,302 |
| Перегретый водяной пар Н2О | 6 | 1,30 |
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы. Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур, однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекул. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Выведем уравнение изохорной теплоёмкости. Первый закон термодинамики для равновесного процесса записывается так:
δq = du + p • dv (3)
Так как удельная внутренняя энергия u является полным дифференциалом, то можно её определить в зависимости от двух любых параметров, например от Т и v: и = f (T, v), тогда можно записать;
du = ( ∂u/∂T)v • dT + (∂u/∂υ)т • dυ (4)
Подставим значение du из (4) в уравнение'(3):
δq = (∂u/∂T)v · dT + (∂u/∂υ)т · dυ + p · dυ
δq = (∂u/∂T)v · dT + [p + (∂u/∂υ)т] · dυ (4′)
Так как в изохорном процессе υ = const, то dυ = 0. Тогда имеем:
а теплоёмкость в изохорном процессе равна:
Используя выражения (3), (5), (6) можно записать:
To есть в процессе при v = const, когда тело не совершает внешней работы вся теплота, подведённая к телу расходуется на изменение его удельной внутренней энергии.
Принимая сv = const, можно записать из (7):
q1-2, v = u2 – u1 = cv · (T2 – T1) (8)
Таким образом, изменение удельной внутренней энергии идеального газа равно произведению теплоёмкости сv при постоянном объеме, на разность температур тела.
Из уравнения (4′) при р = const имеем:
Учитывая выражение (9) можно записать:
Ср = (ди/ дТ)v + [ р + (ди / дυ)т ] • (дυ/dT)р
Используя уравнение (6 ’ ) запишем:
Для идеального газа. (дu / дv)T= 0, а так как R = р · v I T, то
дифференцируя его при р = const, имеем:
Подставляя (12) в (11) имеем окончательно:


















