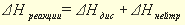Что называется тепловым эффектом реакции при каких условиях
Тепловой эффект химической реакции
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Содержание
Стандартная энтальпия образования (стандартная теплота образования)
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв) 0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж) 0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Температурная зависимость теплового эффекта (энтальпии) реакции
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):
Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
где ΔCp(T1,Tf) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; ΔCp(Tf,T2) — изменение теплоемкости в интервале температур от температуры фазового перехода до конечной температуры, и Tf — температура фазового перехода.
Стандартная энтальпия сгорания
Стандартная энтальпия растворения
Под энтальпией гидратации — ΔHгидр, понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор.
Стандартная энтальпия нейтрализации
Стандартная энтальпия нейтрализации — ΔHнейтр о энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
HCl + NaOH = NaCl + H2O H + + OH − = H2O, ΔHнейтр° = −55,9 кДж/моль
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствие изменения значения ΔHгидратации° ионов при разбавлении.
§ 19. Тепловые эффекты химических реакций
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 19. Тепловые эффекты химических реакций |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 12 Декабрь 2021, 14:45 |
Оглавление
Протекание химических реакций всегда сопровождается выделением или поглощением энергии.
Тепловой эффект реакции — это количество теплоты Q, выделяющейся или поглощающейся в ходе превращения, если количества реагентов (моль) соответствуют стехиометрическим коэффициентам уравнения реакции.
От чего зависит величина теплового эффекта химической реакции?
В качестве примера определим значение теплового эффекта реакции образования оксида азота(II) из простых веществ:
| Уравнение реакции | N2 | + | O2 | = | 2NO |
| Стехиометрическое количество | 1 моль | 1 моль | 2 моль | ||
| Энергия связи | 945 кДж/моль ∙ 1 моль | 494 кДж/моль ∙ 1 моль | 632 кДж/моль ∙ 2 моль | ||
| Изменение энергии | Затрачено на разрыв связей 1443 кДж | Выделилось при образовании связей 1264 кДж | |||
Общий тепловой эффект реакции Q равен сумме тепловых эффектов Q1 и Q2:
Отрицательное значение теплового эффекта показывает, что данная реакция является эндотермической и протекает в соответствии с термохимическим уравнением:
Термохимическими называют уравнения, в которых указаны значения тепловых эффектов.
Для осуществления эндотермических реакций необходимо постоянно передавать системе энергию в виде теплоты, электромагнитного излучения (свет, ультрафиолетовое излучение), электричества и др. Так, эндотермические реакции либо протекают при высоких температурах (например, разложение карбонатов, нитратов и гидроксидов щёлочноземельных металлов), либо требуют подведения электрической энергии (электролиз, образование NO в грозовом разряде) или энергии света (образование озона в атмосфере под действием ультрафиолетового излучения). Эндотермическим процессом является фотосинтез, в котором энергия солнечного света поглощается и запасается в виде химической энергии продуктов — кислорода и глюкозы:
Экзотермические реакции либо не требуют нагревания, либо для начала реакции нужно небольшое нагревание: например, водород со фтором реагирует мгновенно, а для взаимодействия водорода с кислородом смесь газов необходимо нагреть.
Величина теплового эффекта реакции определяется экспериментально в специальном приборе — калориметре, уже знакомом вам по урокам физики в 8-м классе. Результаты измерений приводят к определённым условиям. Обычно это давление 100 кПа и температура 25 °С ( 298,15 K ), что необходимо для сравнения и обобщения экспериментальных данных.
Рассмотрим примеры термохимических расчётов.
Пример 1. Рассчитайте количество теплоты, выделяющейся в результате полного сгорания в кислороде метана объёмом 6,72 м 3 ( н. у. ) в соответствии с термохимическим уравнением:
Урок №3. Тепловой эффект химических реакций. Экзо- и эндотермические реакции
I. Тепловой эффект химической реакции.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
2 H 2 (г) + O 2 (г) = 2 H 2 О(ж) + 572 кДж
2 H 2 (г) + O 2 (г) = 2 H 2 О(ж) + Q
Реакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского «экзо» – наружу). Например, горение метана:
CH 4 + 2O 2 = CO 2 + 2H 2 O + Q
C + H 2 O = CO + H 2 – Q
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис.).
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
I. Расчёты по термохимическим уравнениям (ТХУ)
Химия. 11 класс
§ 19. Тепловые эффекты химических реакций
Протекание химических реакций всегда сопровождается выделением или поглощением энергии.
Тепловой эффект реакции — это количество теплоты Q, выделяющейся или поглощающейся в ходе превращения, если количества реагентов (моль) соответствуют стехиометрическим коэффициентам уравнения реакции.
От чего зависит величина теплового эффекта химической реакции?
В качестве примера определим значение теплового эффекта реакции образования оксида азота(II) из простых веществ:
| Уравнение реакции | N2 | + | O2 | = | 2NO |
| Стехиометрическое количество | 1 моль | 1 моль | 2 моль | ||
| Энергия связи | 945 кДж/моль ∙ 1 моль | 494 кДж/моль ∙ 1 моль | 632 кДж/моль ∙ 2 моль | ||
| Изменение энергии | Затрачено на разрыв связей 1443 кДж | Выделилось при образовании связей 1264 кДж | |||
Общий тепловой эффект реакции Q равен сумме тепловых эффектов Q1 и Q2:
Отрицательное значение теплового эффекта показывает, что данная реакция является эндотермической и протекает в соответствии с термохимическим уравнением:
Термохимическими называют уравнения, в которых указаны значения тепловых эффектов.
Для осуществления эндотермических реакций необходимо постоянно передавать системе энергию в виде теплоты, электромагнитного излучения (свет, ультрафиолетовое излучение), электричества и др. Так, эндотермические реакции либо протекают при высоких температурах (например, разложение карбонатов, нитратов и гидроксидов щёлочноземельных металлов), либо требуют подведения электрической энергии (электролиз, образование NO в грозовом разряде) или энергии света (образование озона в атмосфере под действием ультрафиолетового излучения). Эндотермическим процессом является фотосинтез, в котором энергия солнечного света поглощается и запасается в виде химической энергии продуктов — кислорода и глюкозы:
Экзотермические реакции либо не требуют нагревания, либо для начала реакции нужно небольшое нагревание: например, водород со фтором реагирует мгновенно, а для взаимодействия водорода с кислородом смесь газов необходимо нагреть.
Величина теплового эффекта реакции определяется экспериментально в специальном приборе — калориметре, уже знакомом вам по урокам физики в 8-м классе. Результаты измерений приводят к определённым условиям. Обычно это давление 100 кПа и температура 25 °С ( 298,15 K ), что необходимо для сравнения и обобщения экспериментальных данных.
Рассмотрим примеры термохимических расчётов.
Пример 1. Рассчитайте количество теплоты, выделяющейся в результате полного сгорания в кислороде метана объёмом 6,72 м 3 ( н. у. ) в соответствии с термохимическим уравнением:
Что называется тепловым эффектом реакции при каких условиях
Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты химических реакций называется термохимией. Все химические процессы сопровождаются выделением или поглощением теплоты. Реакции, сопровождающиеся выделением теплоты из системы в окружающую среду, называются экзотермическими, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими. Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а противоположная ему по знаку величина, описывающая изменение состояния системы в результате протекания реакции энтальпией реакции 
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в химических реакциях принято пользоваться так называемыми термохимическими уравнениями. Термохимические уравнения записываются как обычные уравнения химических реакций, но с указанием величины и знака теплового эффекта реакции. В случае экзотермических реакций с правой стороны уравнения отмечают количество выделившейся теплоты со знаком «плюс», а в случае эндотермических реакций — количество поглощенной теплоты со знаком «минус». При этом у формулы каждого вещества индексом указывается его физическое состояние: газообразное (г), жидкое (ж), кристаллическое (к) или раствор (р-р).Существует термодинамический способ записи термохимических уравнений — когда в самом уравнении тепловой эффект не указывается, а изменение энтальпии реакции (
В данной реакции Q > 0, соответственно, 
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:






Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна 
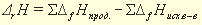
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – :
Табличные значения энтальпий образования (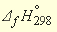




–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
в действительности идет следующая реакция:
которой соответствует энтальпия 
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н + 
2) и нейтрализации возникающих при этом ионов H + :
H + + ОН – = Н2О 
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
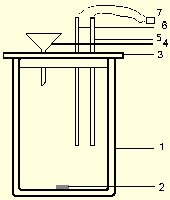
Общий вид используемой калориметрической установки
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
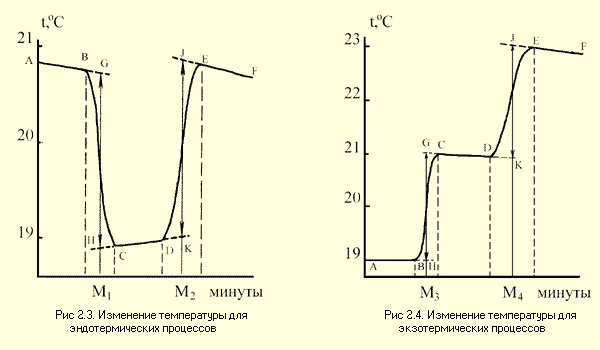
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует собственно реакции: экзндотермической на рис. 2.3 и экзотермической на рис.2.4. В результате реакции наблюдается значительное изменение температуры калориметра (
Наличие небольшого наклона на графике температурной зависимости в начальном (АВ) и конечном (СD) периодах, свидетельствует о том, что во время опыта имеет место некоторый теплообмен калориметра с окружающей средой. В расчетах теплообмен учитывается следующим образом. Прямая AB экстраполируется вправо, а прямая CD влево. Интервал времени от B до C делится пополам и через эту точку проводится перпендикуляр к оси абсцисс до пересечения его с экстраполированными участками прямых АВ и СД (точки H,G). Величина отрезка HG соответствует изменению температуры калориметрической системы 
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
Тепловое значение калориметра:
K = qэл/
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
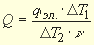
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется работать вдвоем. Один студент следит за показаниями температуры и времени на дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» и диктует эти данные второму студенту, который заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку «ВКЛ» (рис.2 Приложения) на измерительном преобразователе «ЭКСПЕРТ-001-3» (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя «ЭКСПЕРТ-001-3» показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3» нажмите кнопку «Ф2» и далее кнопку «ЧИСЛ». Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку «ВВОД».
Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР».
Начните выполнение опыта, нажав кнопку «ИЗМ». На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, о С |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу «ОТКЛ» на клавиатуре измерительного преобразователе «ЭКСПЕРТ-001-3».
Выполните команду «Стоп» на экране монитора компьютера.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Опыт 2. Определение теплоты растворения безводной соли CuSO4
Взвесьте с точностью до 0,01 г
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками «стрелка влево» или «стрелка вправо» выберите режим «ТЕРМОМЕТР» и начните выполнение опыта, нажав кнопку «ИЗМ».
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду «СТАРТ» в меню программы«Expert001.exe» измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши «ОТКЛ». Выполните команду «Стоп» на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Рк +
Чему равна энтальпия образования пентахлорида фосфора?