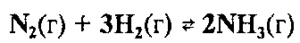Что называется смещением сдвигом химического равновесия
Что гласит принцип Ле Шателье? Что такое смещение равновесия?
Содержание:
Что гласит принцип Ле Шателье? Что такое смещение равновесия?
Андри Луи Ле Шателье – французский ученый в области физики и химии. Был одним из химиков, систематически проводившим фундаментальные исследования в области металлургической и химико-технологической промышленности. Он стал создателем не только знаменитого принципа динамического равновесия, но и теории затвердевания цемента (кристаллизации).
Ле Шателье сформулировал термодинамический принцип подвижного равновесия, который позже обобщил немецкий физик Карл Фердинант Браун. Этот закон также называют принципом Ле Шателье-Брауна или принципом Ле Шателье. Он справедлив во всех системах равновесия, существующим на нашей планете.
Работа принципа Ле Шателье
Формулировка принципа: если находящаяся в химическом равновесии система подвергается внешнему воздействию, в ней возникают процессы, стремящиеся ослабить это воздействие.
В результате взаимодействия двух простых веществ образуется новое третье вещество (продукт). Существуют обратимые реакции, в которых продукт стремится вернуться в исходные вещества. Например, реакция взаимодействия азота и водорода обратима.
Каждая система стремится к обретению равновесия. Например, если ее нагревать, то она сместится в сторону охлаждения. Если систему, наоборот, охлаждать, то она стремится в теплое место.
Параметры химического равновесия
Равновесие можно сместить с помощью нескольких параметров. Принцип Ле Шателье кратко и понятно можно изложить на примере взаимодействия азота и водорода.
Смещение химического равновесия. Принцип Ле Шателье



Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Процесс перехода системы от одного равновесного состояния к другому называется смещением или сдвигом химического равновесия.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции (V ® > V ¬ ), то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано:
— изменением концентрации одного из реагентов;
Остановимся на влиянии каждого из этих факторов на состояние химического равновесия более подробно.
Изменение концентрации. При увеличении концентрации какого-либо из веществ равновесие смещается в сторону расхода этого вещества, а уменьшение концентрации какого-либо вещества смещает равновесие в сторону его образования.
Например, для реакции 2HCl(г) Û H2(г) + Cl2(г) увеличение концентрации хлороводорода приводит к смещению равновесия вправо (в сторону протекания прямой реакции). Этот же результат можно получить при уменьшении концентрации водорода или хлора.
Изменение давления. Если в реакции участвует несколько газообразных веществ, то при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газовой смеси и, соответственно, в сторону уменьшения давления в системе. Наоборот, при понижении давления равновесие смещается в сторону образования большего количества молей газа, что вызывает увеличение давления в системе.
Пример:
1 моль + 3 моль Û 2 моль
При увеличении давления в системе равновесие данной реакции смещается вправо (в сторону протекания прямой реакции).
Если в прямой и обратной реакциях участвует одинаковое количество молей газообразных веществ, то изменение давления не вызывает смещения химического равновесия.
Катализатор на смещение равновесия влияния не оказывает, он только ускоряет наступление химического равновесия.
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Содержание:
В химии есть обратимые и необратимые химические реакции. Они протекают по разному принципу и имеют свои особенности. Равновесие в реакции способно смещаться под воздействием определенных факторов.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами.
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: [A], [B], [C], [D]. Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= [C] x ×[D] y /[A] a ×[B] b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Смещение химического равновесия под действием различных факторов
О подвижности равновесия говорили ученые еще в XIX веке. В то же время активно проводились исследования, чтобы доказать свои предположения. Анри Ле-Шателье был первым, кто попытался рассказать об этом в своих трудах. Позже его исследования обобщил Карл Браун. Принцип Ле-Шателье говорит о:
Если на систему, находящуюся в равновесии оказывается влияние, то равновесие смещается в ту сторону, которое ослабляет это влияние
Влияние температуры
В обратимых реакциях прямая и обратная сторона процесса противоположны по температуре друг другу. В зависимости от температурного коэффициента реакции подразделяются на экзотермические (температура в процессе реакции выделяется). При повышении температуры в такой системе равновесие будет смещаться в сторону обратной реакции.
Эндотермические реакции (которые протекают при нагревании) наоборот, если нагревать такую реакцию, то будет протекать быстрее прямая реакция.
Это значит, если в прямой стороне наблюдается показатель +Q-экзотермический процесс, то в обратной будет –Q – эндотермический процесс. Если увеличить температуру исходных продуктов, то химическое равновесие сместиться в ту сторону, в которой наблюдается пониженная температура.
Влияние концентрации
По принципу Ле-Шателье, увеличение концентрации реагентов вызывает смещение равновесие в сторону, где они расходуются, в прямом процессе. А если концентрация веществ понижается, то химическое равновесие снижается в сторону обратных процессов.
Такой же принцип действует и на увеличение концентрации продуктов реакции. Химическое равновесие смещает в ту сторону, где происходит расход реагентов, значит в сторону обратной реакции. Если концентрацию продуктов понизить, то равновесие сместиться в сторону прямого процесса.
Влияние давления
Давление меняет равновесие не во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Важно! На состояние равновесия процессов с твердыми веществами давление не влияет.
При разной концентрации газообразных веществ слева и справа реакции, повышение давления приведет к смещению химического равновесия. Смещается в ту сторону, где количество газообразных веществ уменьшается, а показатели давления повышаются.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки, в виде соединений и комплексов, которые ускоряют процесс образования продуктов. Их добавление никак не влияет на химическое равновесие. В некоторых процесс способствует быстрому уравновешиванию сторон.
Таблица химического равновесия
Химическое равновесие. Смещение химического равновесия. Принцип Ле-Шателье.



· Химическое равновесие— состояние химической системы, в котором обратимо протекает одна или несколько химических
реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
· Смещение химического равновесия.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
Температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
Давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
Концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
Катализаторы не влияют на смещение химического равновесия!
· Принцип Ле-Шателье.Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии,
воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Гомогенный и гетерогенный катализ.
· Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
· Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1.Диффузия реагирующих веществ к поверхности твердого вещества
2.Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3.Химическая реакция между реагирующими молекулами
4.Десорбция продуктов с поверхности катализатора
5.Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод)
Химическое равновесие и способы его смещения



Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют:
Концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое либо внешнее воздействие, тов системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
В) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азоти водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции