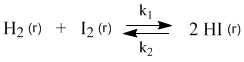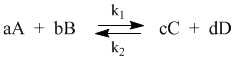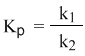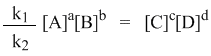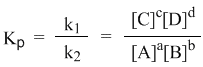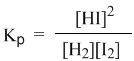Что называется сдвигом химического равновесия
Химическое равновесие
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. [1]
Содержание
Смещение химического равновесия
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ.
Катализаторы не влияют на смещение химического равновесия!
См. также
Примечания
Ссылки
Полезное
Смотреть что такое «Химическое равновесие» в других словарях:
химическое равновесие — Термодинамическое равновесие, устанавливающееся в химически реагирующей системе. Примечание Химическое равновесие в однофазной системе называется «гомогенным химическим равновесием», а в системе из двух или более фаз —… … Справочник технического переводчика
химическое равновесие — – состояние химической системы, в котором скорости прямой и обратной реакции одинаковы. Общая химия : учебник / А. В. Жолнин [1] Химическое равновесие – термодинамическое равновесие в системе, при котором при постоянной температуре соблюдается… … Химические термины
ХИМИЧЕСКОЕ РАВНОВЕСИЕ — ХИМИЧЕСКОЕ РАВНОВЕСИЕ, равновесие в ОБРАТИМОЙ РЕАКЦИИ, когда две противоположных реакции развиваются с постоянными и равными скоростями, и в системе не происходят окончательные изменения. Исходная скорость падает по мере уменьшения концентрации… … Научно-технический энциклопедический словарь
ХИМИЧЕСКОЕ РАВНОВЕСИЕ — состояние реагирующей системы, при котором в ней протекают только обратимые реакции. Параметры состояния системы при химическом равновесии не зависят от времени; состав такой системы называют равновесным … Большой Энциклопедический словарь
химическое равновесие — [chemical equilibrium] состояние системы, в которой обратимо протекает одна или несколько химических реакций, причем для каждой из них скорости прямой и обратной реакции равны, вследствие чего состав системы остается постоянным, пока сохраняются… … Энциклопедический словарь по металлургии
химическое равновесие — термодинамическое равновесие в системе, между компонентами которой происходят химические реакции. Параметры состояния системы при химическом равновесии не зависят от времени; состав такой системы называется равновесным. * * * ХИМИЧЕСКОЕ… … Энциклопедический словарь
химическое равновесие — cheminė pusiausvyra statusas T sritis chemija apibrėžtis Būsena, kurios metu reakcijos produktai vienodu greičiu susidaro ir virsta pradinėmis medžiagomis. atitikmenys: angl. chemical equilibrium rus. химическое равновесие … Chemijos terminų aiškinamasis žodynas
химическое равновесие — cheminė pusiausvyra statusas T sritis fizika atitikmenys: angl. chemical equilibrium vok. chemisches Gleichgewicht, n rus. химическое равновесие, n pranc. équilibre chimique, m … Fizikos terminų žodynas
химическое равновесие — cheminė pusiausvyra statusas T sritis Energetika apibrėžtis Reaguojančios sistemos būsena, kai tiesioginės ir atvirkštinės reakcijų spartos susilygina ir nusistovi nekintama cheminė sistemos sudėtis, išliekanti, kol nepasikeičia jos būsenos… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
химическое равновесие — Равновесие в системе, установившееся в результате двусторонней химической реакции … Политехнический терминологический толковый словарь
Химическое равновесие и способы его смещения



Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют:
Концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое либо внешнее воздействие, тов системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
В) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азоти водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 
Химическое равновесие





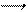
Величина Кр как отношение постоянных величин есть величина постоянная, называемая константой равновесия. Концентрации реагентов при установившемся равновесии называются равновесными концентрациями.
Например: 2СO + O2 = 2СO2, 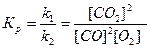
Концентрации реагирующих веществ не влияют на константу равновесия, так как константы скорости реакций, отношением которых она является, не зависят от концентрации. Но k1 и k2 зависят от температуры и меняются с изменением температуры по-разному, поэтому Кр зависит от температуры.
При неизменных внешних условиях состояние (положение) равновесия сохраняется сколь угодно долго. При изменении внешних условий положение равновесия изменяется, так как нарушается равенство Vпр. = Vобр. Через некоторое время после изменения условий установится новое равновесие, но при других равновесных концентрациях. Переход системы из одного равновесного состояния в другое называется смещением равновесия(сдвигом равновесия).
Закономерное влияние внешних условий (концентраций реагентов, температуры, давления) на положение равновесия обратимых химических реакций было установлено в 1847 году французским ученым Ле-Шателье. Принцип Ле-Шательезвучит следующим образом: “Если на систему, находящуюся в равновесном состоянии, оказать какое-либо внешние воздействие (изменение температуры, давления, концентрации), то равновесие в системе сместиться в сторону той реакции, которая сводит это воздействие к минимуму”
1. При увеличении концентрации какого-либо вещества, участвующего в равновесии, равновесие смещается в сторону расхода данного вещества, а при уменьшении концентрации – в сторону его образования.
Например, в системе 2СO + O2 = 2СO2 при увеличении концентрации кислорода равновесие сместится в сторону его расходования, т.е. вправо, в сторону образования СО2.
2. При увеличении давления путем сжатия системы равновесие смещается в сторону меньшего числа молекул газа, т.е. в сторону понижения давления, а при уменьшении давления равновесие сместится в сторону большего числа молекул газа, т.е. в сторону увеличения давления.
Например, в системе 2СO + O2 = 2СO2 при увеличении давления равновесие сместится в сторону меньшего числа молекул газа, т.е. вправо, в сторону образования СО2, так как в левой части три молекулы газа, а в левой всего две. ся в равновесном состоянии, оказать какое-либо внешние воздействие ( на положение равновесия обратимых химических реакций был

3. При увеличении температуры равновесие смещается в направлении эндотермической реакции, а при уменьшении – в направлении экзотермической реакции.
Экзотермической реакций называется реакция, идущая с выделением тепла (ΔН 0).
При увеличении температуры в данной системе равновесие сместится влево, в сторону исходных реагирующих веществ, так как обратная реакция является эндотермической.
Принцип Ле-Шателье подтверждается и распространяется не только на химические, но и на различные физико-химические равновесные процессы. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация и растворение, происходит в соответствии с данным принципом.
Растворы
Растворы имеют огромное значение в минеральной и органической жизни Земли, в науке, технике, строительстве.
 Т в е р д ы е (минералы, сплавы) Т в е р д ы е (минералы, сплавы) |
| Растворы |
| Ж и д к и е (раствор NaCl в воде) |
| Г а з о о б р а з н ы е (воздух – 21 % О2 + 78 % N2 + 1 % др. газов) |
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкость) и растворенного вещества. Например: раствор газа в жидкости – кислород в воде; раствор твердого вещества в жидкости – сахар в воде; раствор жидкости в жидкости – серная кислота в воде. В случае смеси жидкостей растворителем является жидкость, которая содержится в большем количестве. Кроме того, жидкими растворами являются и те, в которых растворитель не вода, а другая жидкость (спирт, ацетон, толуол, керосин и др.).
Помимо наличия кристаллогидратов, доказательством того, что растворение хими- ческий процесс, является тепловой эффект при растворении. Например, если поместить в стакан с водой твердую соль NH4NO3, то в результате растворения последней темпе- ратура раствора понижается так сильно, что стакан примерзает к поверхности,на которой стоит, если она смочена водой; при добавлении H2 SO4 в стакан с водой последний заметно нагревается.
Установлено, что тепло поглощенное при растворении (отрицательный тепловойэффект ) затрачивается на разрушение кристаллической решетки и диффузия раство- ряющегося вещества на весь объем раствора (физический
процесс). Причиной положительного теплового эффектаслужит образование сольватов (химический процесс).
Любой растворитель характеризуется параметрами: давление насыщенного пара, осмотическое давление, температуры кипения и замерзания. Для разбавленных растворов неэлектролитов аналогичные свойства изменяются пропорционально концентрации растворенного вещества и описываются законами Ф. Рауля и Я. Вант-Гоффа.
I закон Рауля
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом чем больше концентрация растворенного вещества, тем больше понижается давление пара над раствором.
II закон Рауля
Растворы замерзают при более низкой температуре, чем чистый растворитель. При этом, чем выше концентрация растворённого вещества, тем ниже температура замерзания
DТзам = К×С,
где С – концентрация раствора; Е – эбулиоскопическая постоянная, которая равна повышению температуры кипения при растворении 1 моля вещества в 1 кг растворителя; К – криоскопическая постоянная, которая численно равна понижению температуры замерзания при растворении 1 моль вещества в 1 кг растворителя.
Закон Вант-Гоффа
Осмотическое давление равно такому давлению, которое нужно приложить к раствору для предотвращения проникновения в него растворителя
Химическое равновесие

Всего получено оценок: 262.
Всего получено оценок: 262.
Химическое равновесие – это такое состояние системы, где обе реакции – прямая и обратная – имеют одинаковые скорости. Чем характеризуется это явление, и какие факторы влияют на химическое равновесие?
Химическое равновесие. Общая характеристика
Под химическим равновесием можно понимать состояние химической системы, при котором исходное количество веществ в реакции не изменяется в течение времени.
Химическое равновесие можно разделить на три вида:
Смещение равновесия в химических реакциях
Химическое равновесие находится в зависимости от трех параметров: температуры, давления, концентрации вещества. Французский химик Анри Луи Ле Шателье в 1884 году сформулировал принцип динамического равновесия, согласно которому равновесная система при внешнем воздействии стремится вернуться в состояние равновесия. То есть при внешнем воздействии равновесие сместится таком образом, чтобы это воздействие нейтрализовалось.
Принципы сформулированные Ле Шателье еще называют принципами «смещения равновесия в химических реакциях».
На химическое равновесие влияют следующие факторы:
Реакция поглощения называется эндотермической реакцией, а реакция выделения – экзотермической.
Катализатор не относится к факторам, влияющих на смещение химического равновесия.
Что мы узнали?
При химическом равновесии скорости в каждой паре реакций равны между собой. Химическое равновесие, изучаемое в 9 классе, можно разделить на три вида: истинное, метастабильное (кажущееся), заторможенное (ложное). Впервые термодинамическая теория химического равновесия была сформулирована ученым Ле Шателье. На равновесие системы влияют всего три фактора: давление, температура, концентрация исходного вещества.
Что называется сдвигом химического равновесия
§9.7 Химическое равновесие. Принцип Ле Шателье.
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:
У этой равновесной системы есть замечательное свойство: ее состав не зависит от способа получения. Можно нагревать смесь газообразных водорода и йода, а можно взять для опыта чистый HI – результат будет одним и тем же: образуется равновесная смесь трех веществ (H2, I2, HI) одного и того же состава. Для внешнего наблюдателя в такой системе химические превращения не происходят, но на самом деле здесь постоянно идут прямая и обратная реакции. Рассмотрим эту систему с точки зрения химической кинетики.
Допустим, для опыта взяли газообразные водород и йод. В первый момент времени еще нет HI, поэтому идет только прямая реакция, скорость которой (vпр) выражается кинетическим уравнением:
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. В данном конкретном случае кинетические уравнения соответствуют химическим уравнениям прямого и обратного процессов. Скорость обратной реакции (vобр) выражается кинетическим уравнением с константой скорости k2:
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Химическое равновесие носит динамический характер. Например, в приведенной реакции HI постоянно образуется и расходуется. Если добавить в такую равновесную смесь радиоактивный йод-131, то он быстро распределяется между молекулами I2 и HI. Это говорит о постоянном переходе атомов йода из исходного вещества в продукт реакции и обратно.
Можно ли изменить состояние химического равновесия? Иными словами – можно ли сдвинуть равновесие в сторону образования продуктов или в сторону образования исходных веществ?
Ответ на этот вопрос подсказывают кинетические уравнения прямой и обратной реакций. Если добавлять в равновесную систему извне «лишний» водород, то возрастет величина молярной концентрации [H2] в кинетическом уравнении прямой реакции. Следовательно, увеличится скорость прямой реакции vпр, а скорость обратной реакции vобр останется неизменной. В итоге израсходуется какая-то часть добавленного водорода, а равновесие сместится вправо, т.е. в сторону образования продукта реакции. Такой же эффект даст и введение в систему дополнительных порций I2.
Мы можем заметить важную закономерность: при попытке воздействовать на равновесную систему она «сопротивляется» такому воздействию. Действительно, добавление в равновесную систему H2 или I2 приводит к увеличению их расходования в прямой реакции. В итоге H2 или I2 в системе окажется меньше, чем было добавлено, зато возрастет количество HI. Наоборот, добавление HI приводит к более быстрому его расходованию в обратной реакции. Такая способность равновесных систем «сопротивляться» внешним воздействиям носит общий характер и известна под названием принципа Ле Шателье:
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
** Анри Луи Ле Шателье (1850-1936) – французский физикохимик, Президент Французского химического общества, член многих академий, в том числе Петербургской АН. Был почетным членом и АН СССР. Независимо от немецкого химика Ф. Габера в 1901 г. нашел условия синтеза аммиака (см. ниже).
Приведем пример реакции, в которой важным для положения равновесия фактором является давление. Она тоже происходит в газовой фазе:
2 NO2 (г) 
При комнатной температуре NO2 – темно-коричневый газ (часто его называют «бурым» газом). Продукт его димеризации N2O4 бесцветен. Оба газа при обычных условиях присутствуют в смеси, т.е. находятся в химическом равновесии. Если увеличивать в такой равновесной химической системе давление, то равновесие сдвигается вправо – в сторону образования N2O4. Дело в том, что при одновременном увеличении концентрации [NO2] и [N2O4] преимущество получает прямая реакция. В ее кинетическое уравнение концентрация [NO2] входит в квадрате:
Происходящий при этом сдвиг равновесия вправо можно наблюдать экспериментально: при сжатии смеси газов она светлеет, поскольку уменьшается концентрация окрашенного NO2 и возрастает концентрация бесцветного N2O4 (рис. 9-13).
Рис. 9-13. При увеличении давления (Р2 > Р1) общее количество молекул в равновесной смеси уменьшается – система «сопротивляется» повышению давления: а) в системе больше молекул NO2 (смесь интенсивно окрашена); б) после увеличения давления молекул NO2 становится меньше (окраска ослабевает).
Но на равновесные реакции в растворах изменение давления не оказывает заметного влияния, если только в реакции не выделяется какой-нибудь газ. Дело в том, что жидкости почти не сжимаются под давлением, и концентрации растворенных в них реагирующих веществ практически не изменяются (если это не газообразные реагирующие вещества).
С помощью кинетических уравнений прямой и обратной реакций можно вывести закон действующих масс для химического равновесия. Пусть происходит обратимая реакция:
Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:
В предыдущем уравнении достаточно перенести в левую часть k2
а из полученного уравнения уже легко получается выражение для константы равновесия Кр:
Это не что иное, как математическая запись закона действующих масс для химического равновесия. Например, для рассмотренной выше реакции
Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ.
** Интересно, что в отличие от закона действующих масс для скорости реакции, в математическом выражении для константы равновесия показатели степени a, b, c, d всегда равны стехиометрическим коэффициентам в равновесной реакции. Это связано с тем, что как бы не были сложны механизмы прямой и обратной реакций, в состоянии равновесия они должны обеспечить перенос исходных веществ в продукты реакции и обратно в точном соответствии с коэффициентами перед этими веществами в суммарном уравнении.
Можно качественно предсказывать направление смещения равновесия по кинетическим уравнениям. Например, для сложной гетерогенной химической реакции
Fe3O4 (тв) + СО (г) 
можно предсказать, что изменение давления не приведет к смещению равновесия. Здесь скорости прямой и обратной реакции зависят в основном от концентраций газов (которые при изменении давления меняются одинаково), а твердые вещества не входят в кинетические уравнения.
Теплоту тоже можно рассматривать как «продукт» реакции. Следовательно, нагревание такой равновесной смеси должно приводить к активизации обратной реакции и смещению равновесия влево – в сторону образования исходных Fe3O4 и CO.
Наоборот, отведение образующегося тепла (понижение температуры) будет уменьшать скорость обратной реакции и равновесие сдвинется вправо – в сторону продуктов FeO и CO2.
Можно не пользоваться для решения таких вопросов кинетическими уравнениями, а прямо применить принцип Ле Шателье. Действительно, при нагревании равновесной системы с оксидами железа она должна сопротивляться этому воздействию – то есть замедлять прямую реакцию, идущую с выделением тепла. Точно так же (без кинетических уравнений) можно решать вопрос о смещении равновесия при увеличении давления в системе
2 NO2 (г) 
Для того, чтобы «сопротивляться» увеличению давления, эта система должна активизировать реакцию, приводящую к уменьшению общего числа молекул в смеси. Такой реакцией является прямая реакция, в которой из двух молекул газа получается одна. Следовательно, преимущество получит прямая реакция и равновесие сдвинется вправо.
Способы смещения химического равновесия играют большую роль в химической промышленности. Например, синтез аммиака является обратимой, экзотермической, каталитической реакцией:
Принцип Ле Шателье позволяет качественно подобрать условия, наиболее подходящие для сдвига равновесия вправо, т.е. в сторону максимально возможного содержания аммиака в равновесной смеси. Это имеет большое практическое значение – ведь чем больше равновесие сдвинуто вправо, тем больше аммиака можно получать в промышленной установке.
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию концентрации газов – для этого активизируется прямая реакция превращения четырех молекул газа (одной молекулы азота и трех водорода) в две молекулы газообразного аммиака. Во-вторых, необходимо отводить образующееся в реакции теплоту, т.е. понижать температуру. Если температуру повышать, то обратная реакция ускорится в большей степени, поскольку она идет с поглощением теплоты. Однако если охлаждать реактор слишком сильно, то обе реакции замедляются и равновесие устанавливается слишком медленно.
В промышленности находят компромисс – давление в аппаратах синтеза аммиака держат настолько высоким, насколько может выдержать их конструкция, а температуру выбирают средней, при которой равновесие в системе наступает достаточно быстро и в то же время не слишком сильно смещено в сторону исходных веществ – азота и водорода. Этой же цели служит и железный катализатор – он ускоряет наступление химического равновесия. Как вы уже знаете, катализаторы одинаково хорошо ускоряют как прямую, так и обратную реакции, поэтому добавление катализатора не может изменить положение равновесия, но способствует более быстрому его достижению.
Промышленное получение аммиака из атмосферного азота имеет огромное значение для современной цивилизации. Азот – весьма инертное вещество и его соединения в виде полезных ископаемых (селитр) встречаются очень редко. В то же время растения нуждаются в азоте, поэтому современное сельское хозяйство требует интенсивного применения все большего количества азотных удобрений, которые делают на основе аммиака. Также аммиак служит сырьем для производства азотной кислоты, а уже с участием HNO3 осуществляются многие другие важнейшие промышленные процессы – от получения лекарств и взрывчатых веществ до переработки ядерного топлива.
9.22. В каких реакциях изменение давления окажет влияние на смещение равновесия?
9.23. В какой из реакций предыдущей задачи повышение давления приводит к сдвигу равновесия влево?
9.24. ** (ФМШ) Реакция протекает по уравнению: 2 А 
9.25. Рассчитайте, во сколько раз изменятся скорости прямой и обратной реакции в равновесной системе
2 NO (г) + О2 (г) 
9.26. Примените принцип Ле Шателье к условиям и вопросу задачи 9.24. Убедитесь в том, что вывод о направлении смещения равновесия качественно совпадает с результатом количественного расчета.
9.27. В какой из четырех реакций равновесие больше всего сместится вправо при одновременном повышении температуры и понижении давления?
** Подсказка к задаче 9.24. Необходимо найти равновесные концентрации [А]р и [В]р. Пусть [В]р = x моль/л. Подумайте, чему в таком случае будет равна [А]р? Учтите, что на образование одной молекулы В надо «потратить» две молекулы А. Когда [А]р и [В]р будут выражены через «х», подставьте их в выражение для константы равновесия. Получится квадратное уравнение, решением которого будут два корня. Один из них имет неправдоподобное значение и может считаться ложным. Зато другой корень позволяет получить решение задачи. Сделайте проверку: подставьте полученные значения [А]р и [В]р в константу равновесия и убедитесь, что получается именно 0,25.