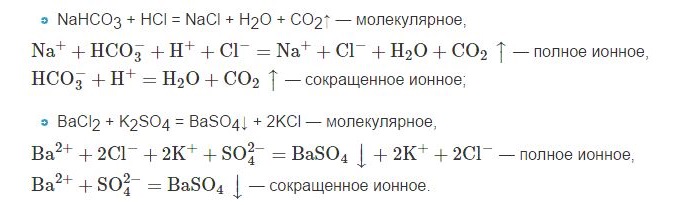Что называется реакцией ионного обмена
Реакции ионного обмена
Содержание:
Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.
Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле. Этот французский химик сформулировал его в 1803 г.
Следует помнить, что это правило справедливо при взаимодействии ненасыщенных растворов.
Особенности РИО. Суть необратимого процесса
Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
Эти уравнения получили названия:
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.
Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
Примеры РИО с выделением газа и выпадением осадка
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Вывод:
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
Полное и сокращенное уравнение будут иметь вид:
Реакции ионного обмена
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
б) Нерастворимые основания и амфотерные гидроксиды не взаимодействуют со слабыми кислотами. Правило, действующее в большинстве случаев: реакция протекает, если предполагаемый продукт растворим. Исключение – взаимодействие с фосфорной кислотой, с ней реагируют даже оксиды и гидроксиды металлов, образующих нерастворимые ортофосфаты.
CuO + H2S реакция не идет, так как H2S – слабая кислота и сульфид меди нерастворим.
2) Обменные процессы с участием солей:
а) Растворимые соли взаимодействуют с другими растворимыми солями и гидроксидами, если в результате образуется газ или осадок:
BaSO4 + K2CO3 реакция не идет, так как реагент сульфат бария нерастворим
MnSO4 + KNO3 реакция не идет, так как не образуется ни газа, ни осадка, ни малодиссоциирующего вещества.
б) Соли взаимодействуют с кислотами, если в результате сильная кислота может вытеснить из соли слабую или нелетучая ‑ летучую:
CH3COONa + HCl → NaCl+CH3COOH
CaCO3 + H2SO4 → CaSO4 + H2O + CO2↑
CaSO4 + HCl реакция не идет, так как серная кислота – сильная и вытеснить ее из соли другой кислотой нельзя.
в) Соли многоосновных кислот взаимодейсвуют с той же кислотой с образованием кислых солей:
г) Растворимые кислые соли нейтрализуются щелочами:
KHCO3 + KOH → K2CO3 + H2O
Итого:
если вещество растворимо, оно легко вступает в реакцию обмена.
Если же нерастворимо, то оно вступает в обменный процесс только в агрессивной среде: сильная кислота или щелочь (только для амфотерных соединений).
Потренируйтесь:
Закончить уравнения реакций ионного обмена (внимание, идут не все реакции!)
Реакции ионного обмена
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка.
Введение, правило Бертолле
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода). В таких случаях реакции будут практически не обратимы.
Изображение реакций ионного обмена
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Правила написания реакций двойного обмена
Полезное
Смотреть что такое «Реакции ионного обмена» в других словарях:
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Химические реакции — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — (р ции окисления восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в в. При окислении в в степень окисления элементов возрастает, при восстановлении понижается. Первоначально окислением называли… … Химическая энциклопедия
Ионный обмен — Ионный обмен это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита. Ионный обмен может происходить как в гомогенной среде (истинный раствор нескольких электролитов),… … Википедия
Геобаротермометрия — Возможно, эта статья содержит оригинальное исследование. Добавьте ссылки на источники, в противном случае она может быть выставлена на удаление. Дополнительные сведения могут быть на странице обсуждения. (11 мая 2011) … Википедия
Актиноиды — Общие сведения Состав группы торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий … Википедия
Химическая реакция — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не… … Википедия
Катионный обмен — Ионный обмен обмен ионов между двумя электролитами. Ионный обмен может происходить как в гомогенной среде (истинный раствор нескольких электролитов), так и в гетерогенной, в которой один из электролитов является твёрдым (при контакте раствора… … Википедия
Химический процесс — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
Нитрат меди(II) — Нитрат меди(II) … Википедия
Химическое преобразование, где участвуют вещества, находящиеся в виде вводных растворов – это реакция ионного обмена.
В данном процессе степень окисления составляющих веществ остается неизменной. Это объясняется тем, что этими веществами являются электролиты.
Условия протекания реакций между электролитами
В химии такие взаимодействия называют гидролизом. Этот процесс можно описать по правилам составления уравнений.
Их суть заключается в следующем:
должны быть уравнены суммы электрических зарядов ионов в правой и левой стороне уравнения;
в растворах компонентами являются вещества в виде ионов;
если в уравнении описывается нерастворимый компонент, то это означает, что он в природе слаборастворимый;
если в решение уравнения включены не растворяющиеся в водной среде вещества, то это значит что они не диссоциируют.
Молекулярные уравнения реакций
В таких уравнениях компоненты описываются в виде молекул. Их записывают таким образом:
Из формулы видно, что к положительному заряду одного компонента добавляется противоположный заряд другого вещества.
Стрелка вниз указывает, что реакция химических компонентов образует осадок. Если в результате преобразований происходит выделение газа, то ставят стрелку вверх.
Алгоритм взаимодействия других ионов описывается по той же схеме.
Важно помнить, что составить ионное уравнение возможно на основе молекулярной формулы. Должна быть четкая последовательность.
Полные ионные уравнения
Практически с помощью молекулярного уравнения нельзя в полном объеме описать химическую реакцию.
Например, реакция соляной кислоты с гидроксидом натрия записывается в молекулярном виде:
HCl + NaOH = NaCl + H2O.
Но по этой формуле невозможны расшифровки процесса в полном объеме. Точно это записывают так:
Теперь видно, что все необратимые реакции разбиты по отдельным частицам. Такая разбивка на ионы называется полной формулой ионного обмена.
Сокращенные ионные уравнения
На практике реакцию ионного обмена нельзя описать полностью полным уравнением. Это объяснятся присутствием с обеих сторон идентичных составляющих – катионов.
Из этого становится понятным, что происходит нейтрализация воды. К этому все сводится. Хотя все описанные правила имеют одинаковую цель – полностью описать химические процессы.