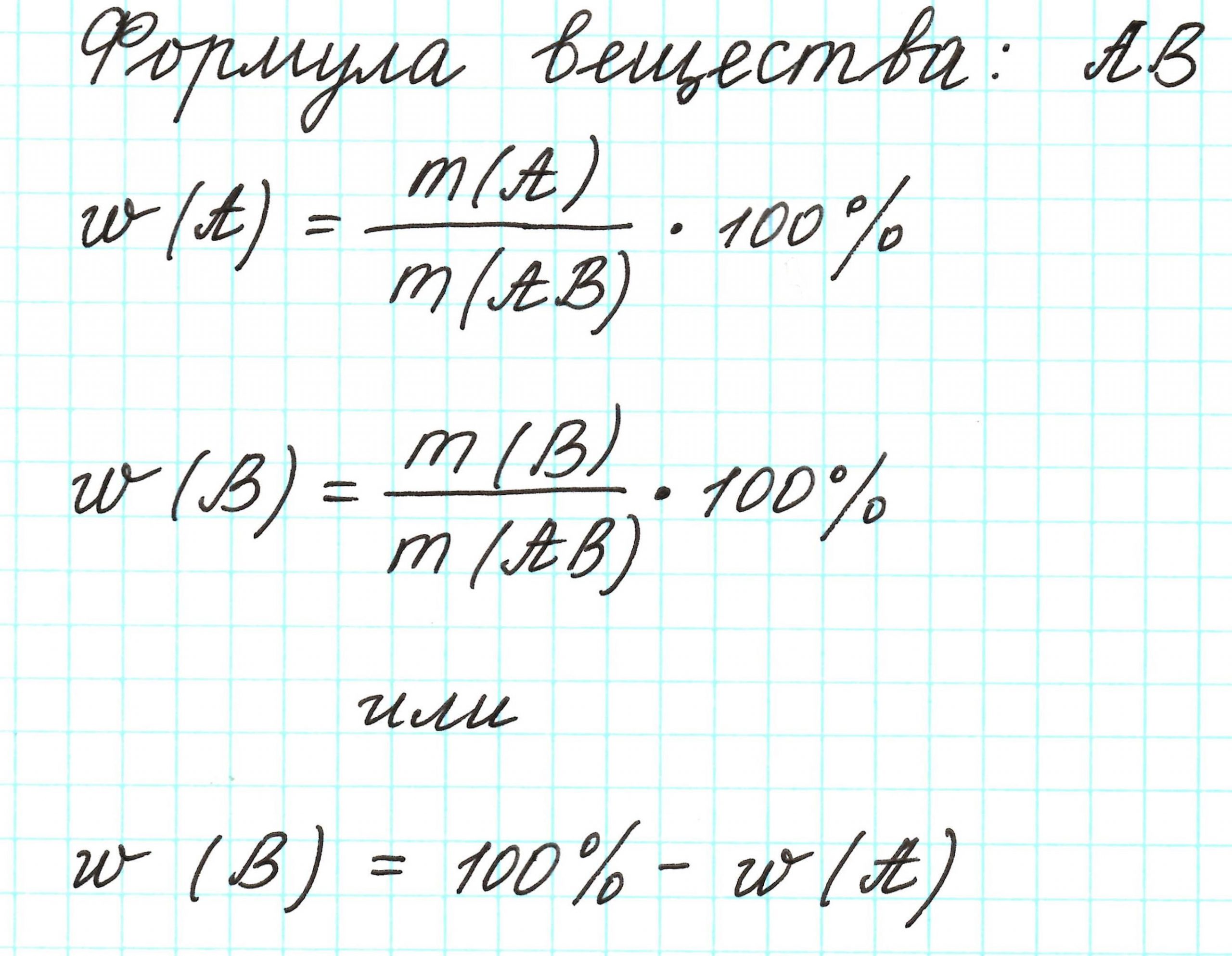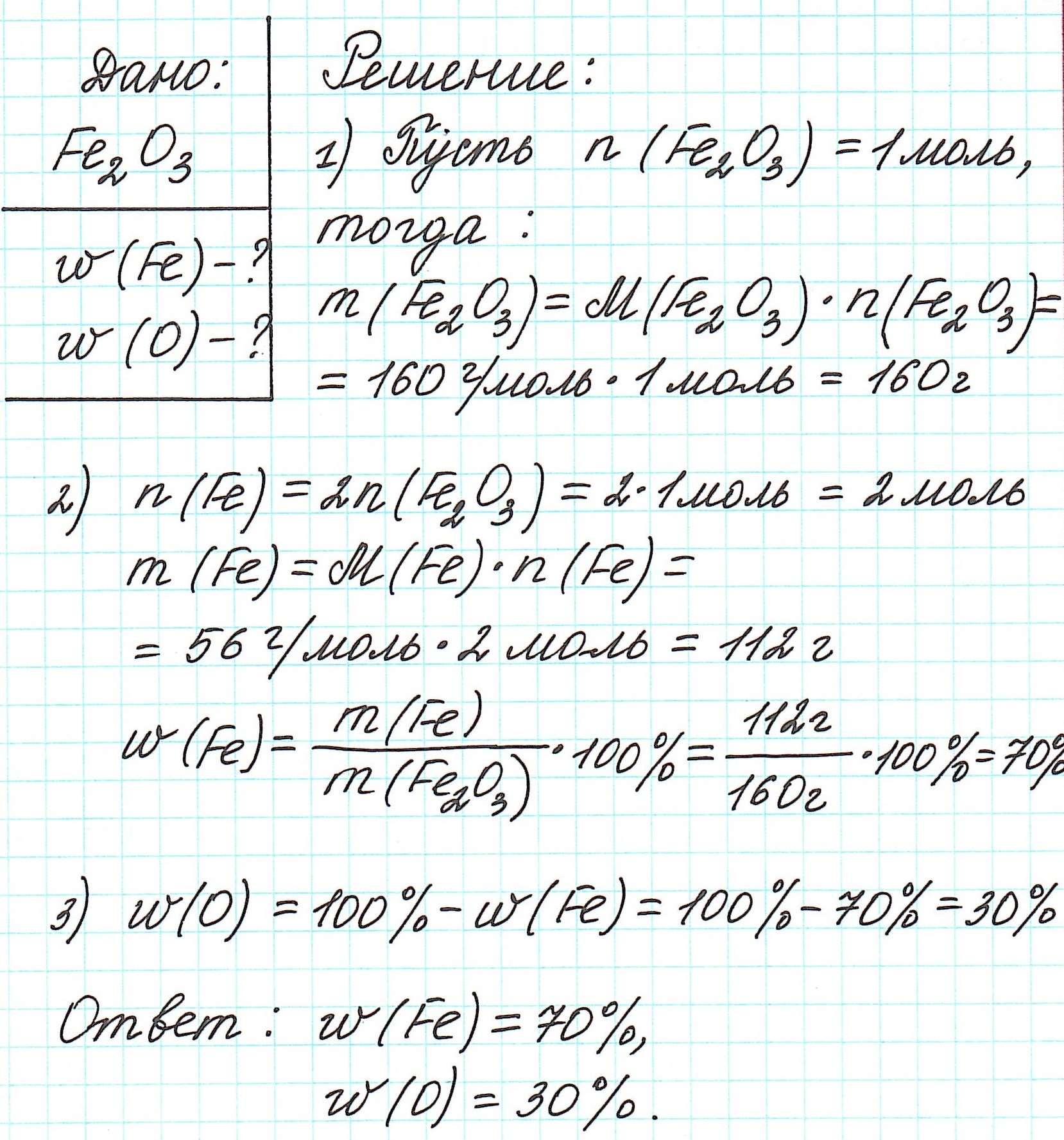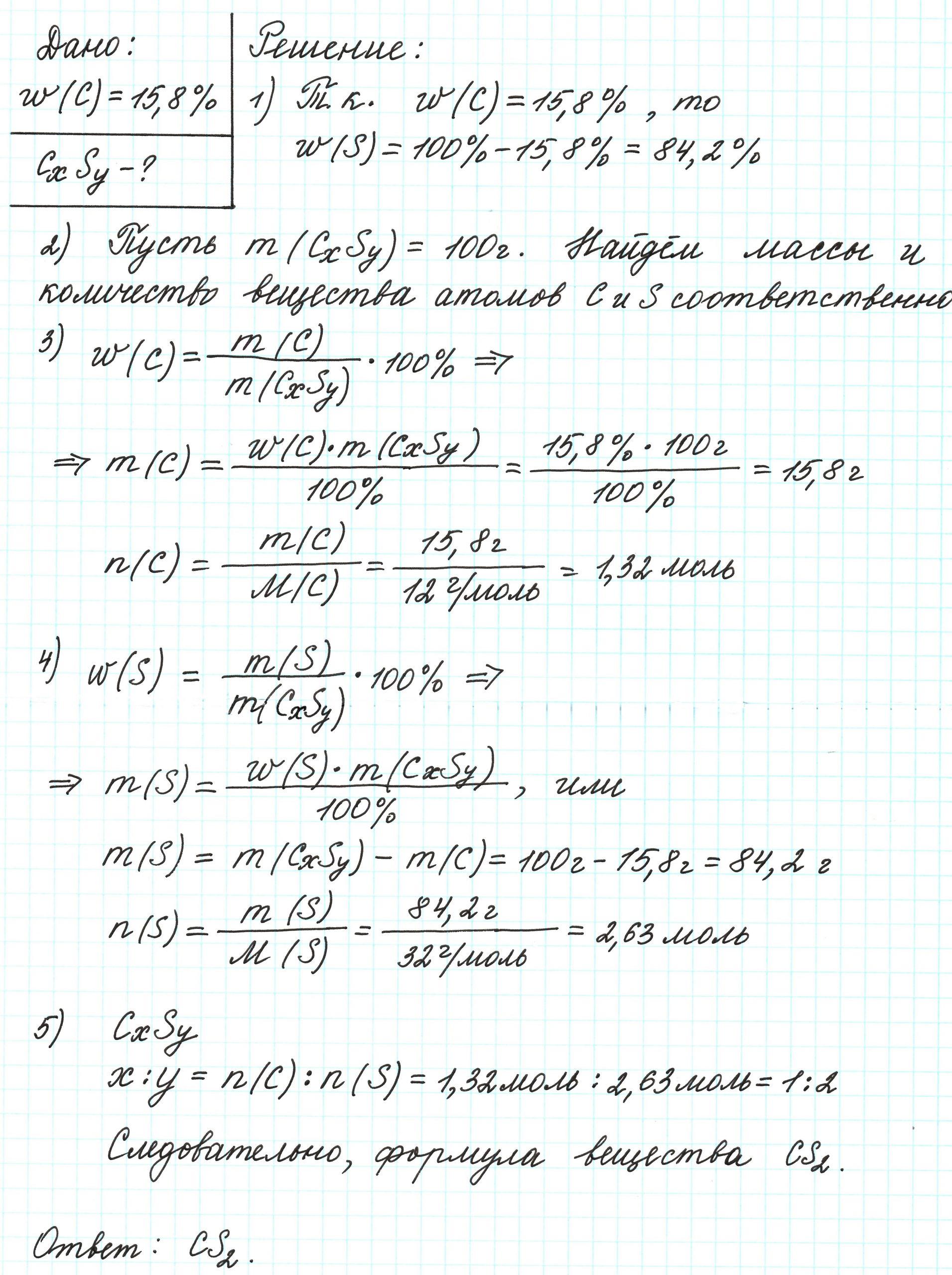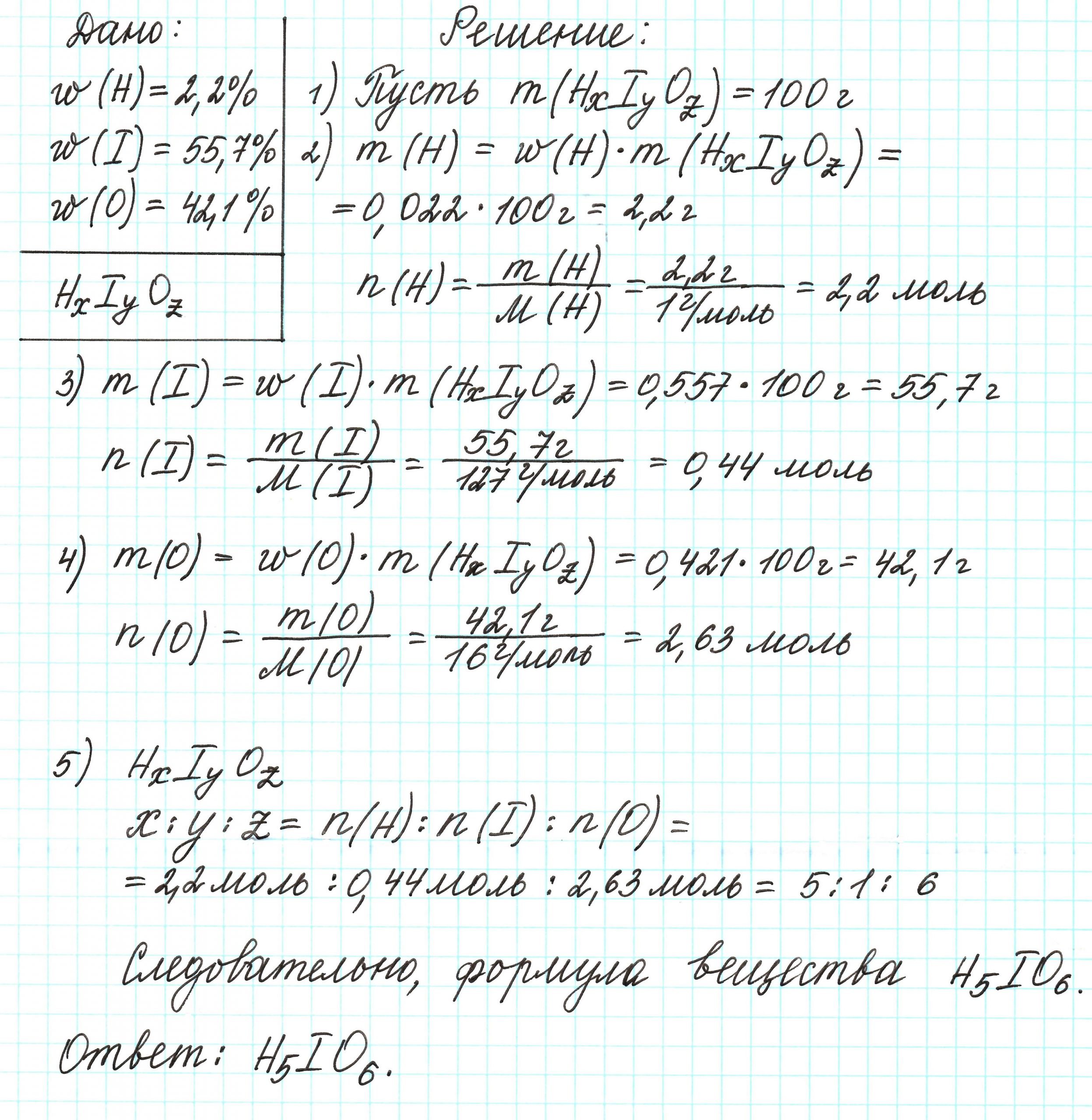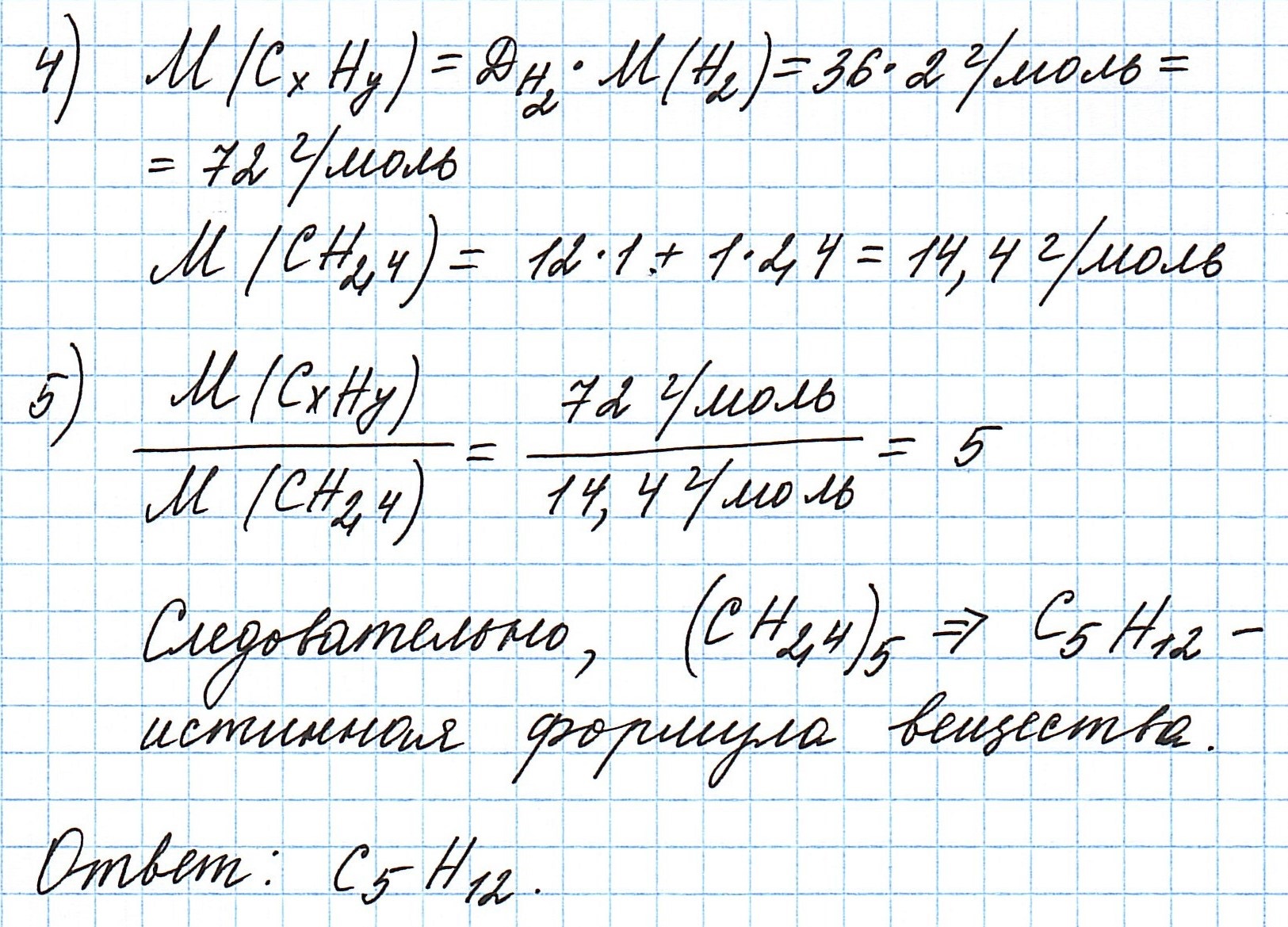Что называется простейшей эмпирической формулой как определить ее
Урок 12. Элементный анализ
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.
Анализ химического состава вещества
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
Аналогичный расчет содержания H в воде дает
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
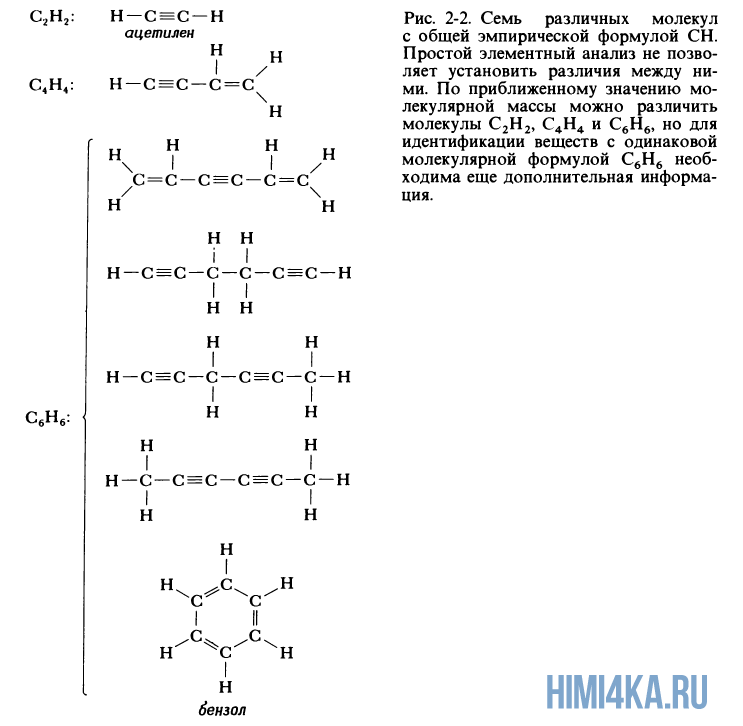
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.
Эмпирическая формула
Содержание
В экономике
Эмпирические формулы не выводятся математически и не имеют особого смысла в научном понимании. Они только «подгоняют» теоретические значения к эмпирическим, полученным опытным путем. Форму такой зависимости подбирает исследователь. Он же определяет конкретные значения параметров эмпирической формулы.
В химии
В физике
Эмпирической формулой называется математическое уравнение, полученное опытным путём, методом проб и ошибок или как приближённая формула из экспериментальных данных. Таким образом, на момент открытия оно не имеет известного теоретического обоснования. В частности, размерности используемых и вычисляемых в формуле величин не соответствуют друг другу. Другой характерной особенностью таких формул, выражающих эмпирические закономерности, является наличие эмпирических коэффициентов — специально подобранных параметров эмпирической формулы. Эмпирическая формула также может являться простым аналогом более сложного точного теоретического соотношения. В большой степени понятия эмпирическая и феноменологическая формула пересекаются.
Эмпирические формулы широко распространены в прикладных исследованиях, также они появляются в быстро развивающихся отраслях науки, но в этом случае они со временем заменяются точными формулами при накоплении достаточного количества знаний. Одним таким примером является формула Ридберга для длин волн спектральных линий водорода. Предложенная в 1888 году, она прекрасно предсказывала длины волн лаймановской серии, хотя никто не знал, почему она работает, пока Бор в 1913 году не создал свою модель атома водорода.
Ссылки
Примечания
Полезное
Смотреть что такое «Эмпирическая формула» в других словарях:
эмпирическая формула — — [Л.Г.Суменко. Англо русский словарь по информационным технологиям. М.: ГП ЦНИИС, 2003.] Тематики информационные технологии в целом EN cut and try formula … Справочник технического переводчика
эмпирическая формула — empirinė formulė statusas T sritis chemija apibrėžtis Formulė, rodanti junginio elementų paprasčiausią kiekybinį santykį. atitikmenys: angl. empirical formula rus. эмпирическая формула … Chemijos terminų aiškinamasis žodynas
эмпирическая формула — empirinė formulė statusas T sritis fizika atitikmenys: angl. empirical formula vok. empirische Formel, f rus. эмпирическая формула, f pranc. formule empirique, f … Fizikos terminų žodynas
Формула Ридберга — в том виде, в котором она была представлена в ноябре 1888 года Формула Ридберга эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и предста … Википедия
Формула Дарси — Формула Вейсбаха[1] в гидравлике эмпирическая формула, определяющая потери напора или потери давления при развитом турбулентном течении несжимаемой жидкости на гидравлических сопротивлениях (предложена Юлиусом Вейсбахом (англ.) в 1855… … Википедия
Формула Прони — Формула Прони это исторически важная формула в гидравлике, применявшаяся для расчётов потерь напора на трение при течении жидкости по трубам. Это эмпирическая формула, полученная французом Гаспаром де Прони в XIX веке: где hf потери… … Википедия
Формула Хазена — Вильямса эмпирическая формула, устанавливающая связь свойств потока воды в трубопроводе с физическими свойствами трубы и падением давления вследствие трения. Формула используется при конструировании водопроводных систем[1], таких как… … Википедия
Формула перемен — Формула перемен эмпирическая формула, описывающая модель для оценки сил, влияющих на успех или неудачу программы организационных изменений. Была разработана Ричардом Бекхардом и Дейвидом Глейтчером и иногда называется Формулой Глейчера. D x … Википедия
ФОРМУЛА — (1) символическая запись, состоящая из цифр, букв и специальных знаков, расположенных в определённом порядке, и являющаяся точным определением какого либо закона, отношения, процесса, явления и т. п., которое приложимо в определённых условиях ко… … Большая политехническая энциклопедия
Формула Борда — В гидродинамике, формула (теорема) Борда Карно это эмпирическая формула, описывающая потери энергии (или напора) жидкости, происходящие при местном расширении потока. Эта формула, в отличие от уравнения Бернулли для идеальной жидкости … Википедия
Вывод эмпирических формул
Молекулярная химическая формула отражает качественный и количественный состав молекул вещества.
| Эмпирическая формула — формула, отражающая простейшее целочисленное отношение элементов, которые содержатся в веществе |
Для вывода эмпирической формулы достаточно знать массовые доли элементов вещества (его количественный состав).
Пример 1. Написать эмпирическую формулу оксида марганца MnxOy, в котором марганца содержится 63,5%.
Как видим, составление эмпирической формулы вещества является достаточно простой задачей.
Немного более сложной задачей является составление молекулярной (или истинной) формулы вещества.
Для составления молекулярной формулы необходимо знать, кроме количественного состава вещества, еще его молекулярную массу.
Примеры составления молекулярных формул приведены на странице «Написание формулы по массовым долям».
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
КАК ВЫЧИСЛИТЬ ФОРМУЛУ ВЕЩЕСТВА
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
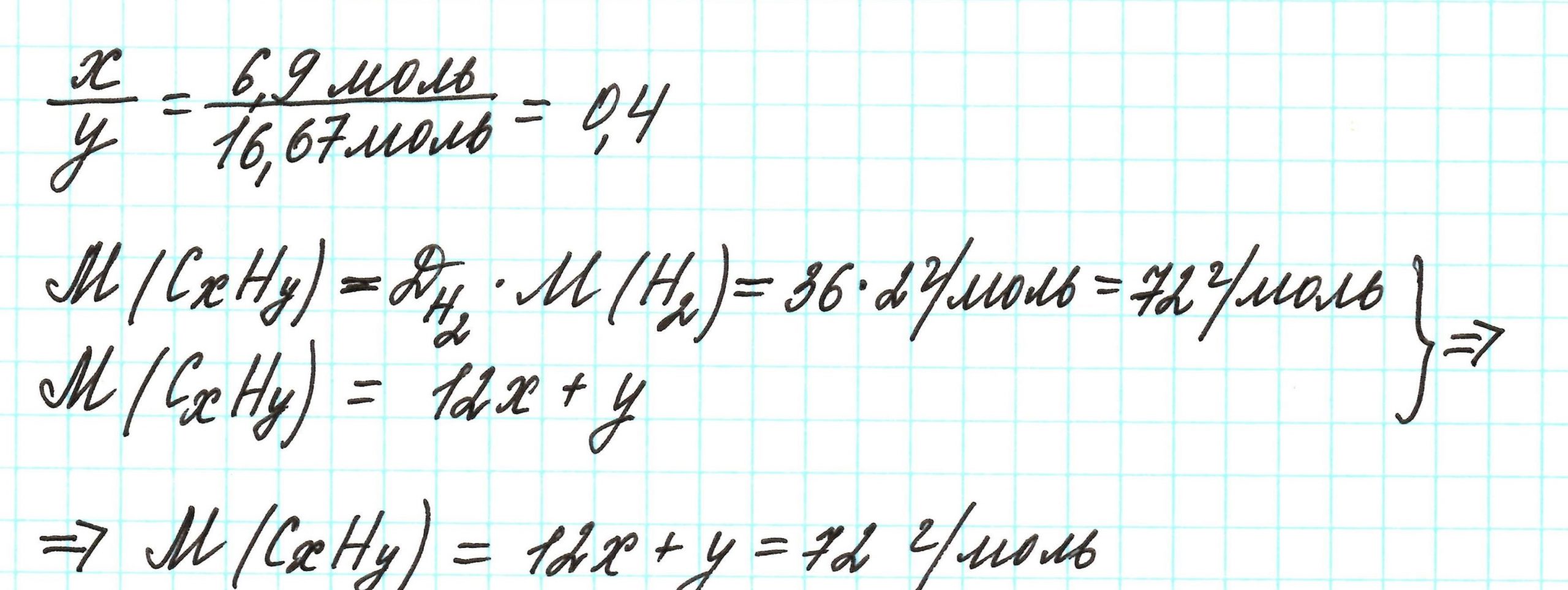
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
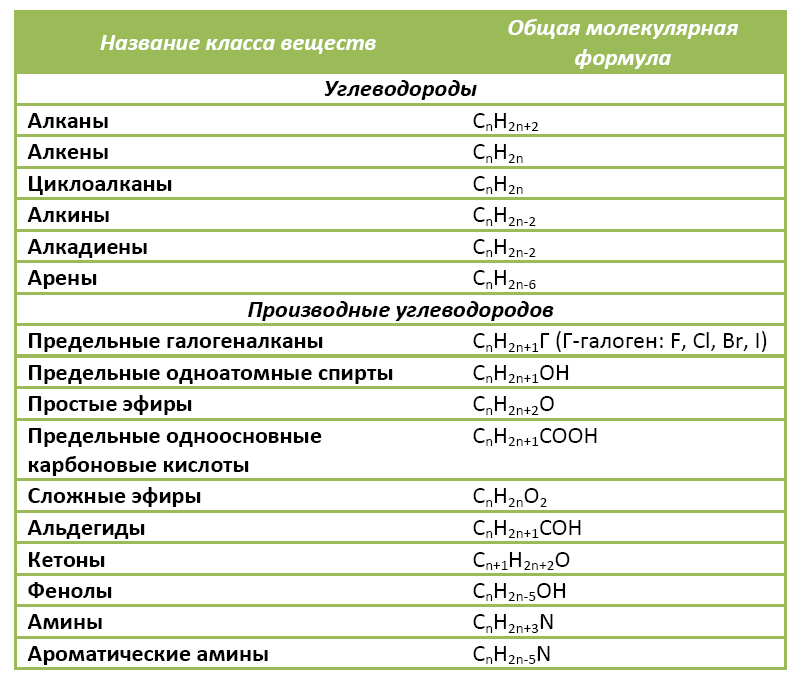
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
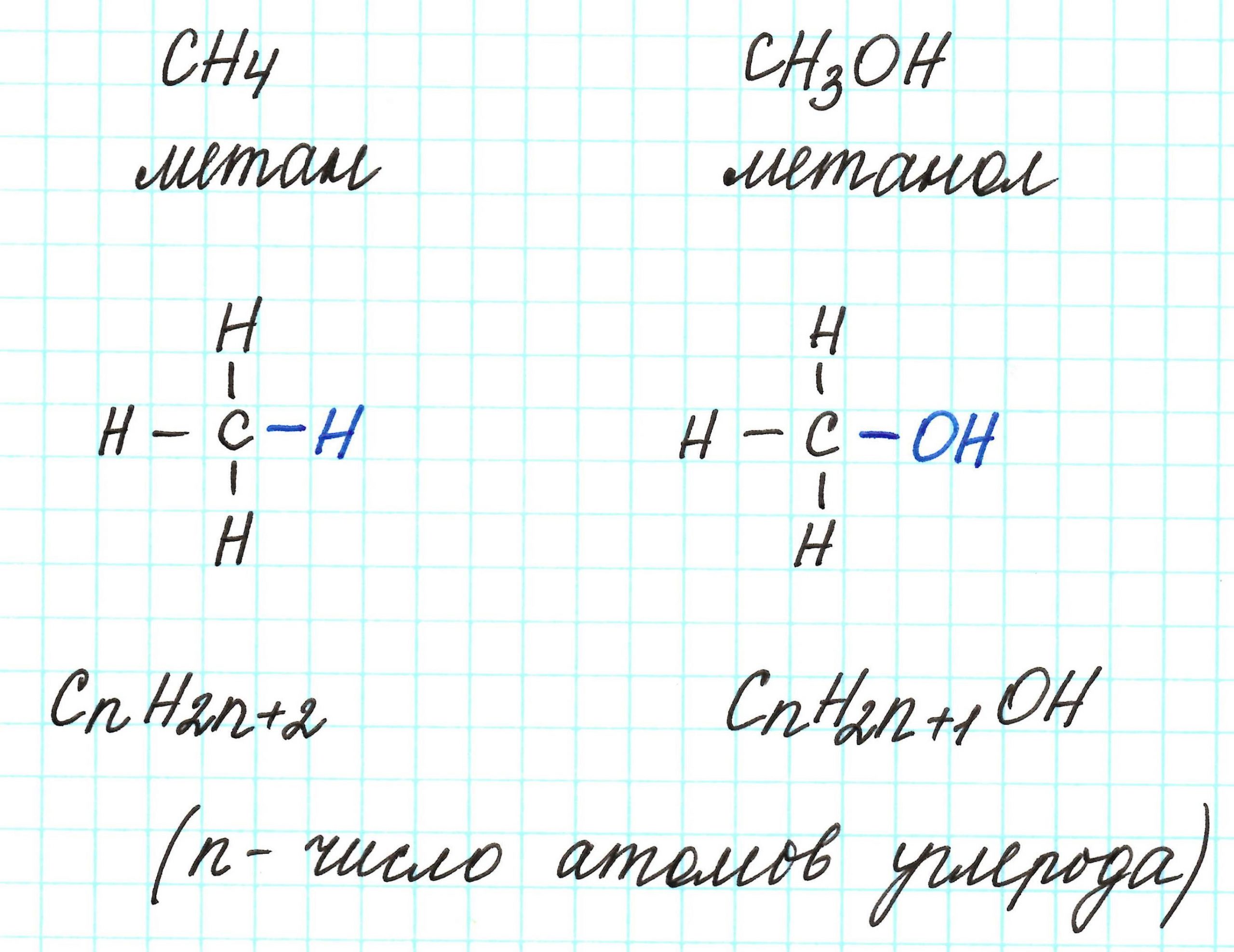
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь в нашу группу ВКонтакте.
Пожалуйста, оцените публикацию