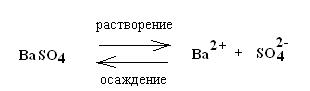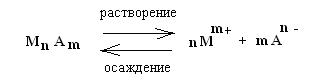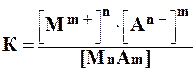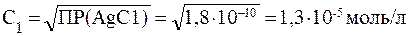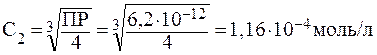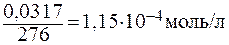Что называется произведением растворимости
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ.



В химии часто используются гетерогенные (неоднородные) системы, состоящие из двух и более фаз, например, реакции осаждения.
Особенность реакций осаждения заключается в том, что в результате растворения образуется новая фаза – твердое вещество и возникает гетерогенная двухфазная система: раствор – осадок (существует равновесие между осадком, образующимся при осаждении, и раствором, соприкасающимся с осадком соответствующего вещества).
Основные закономерности для случая, когда осадок образован малорастворимым электролитом, кристаллическая решетка которого построена из ионов, можно представить следующим образом:
К такой системе применим закон действующих масс:
Константа равновесия не зависит от абсолютного количества твердой фазы и при данной температуре является величиной постоянной.
При установившемся равновесии скоростей осаждения и растворения осадка в насыщенном растворе малорастворимого электролита при данной температуре и давлении произведение концентраций (активностей) его ионов есть величина постоянная. Эту константу называют произведением растворимости ПР (Lp – в немецкой литературе, Sp – в английской) или произведением активностей :
ПР(MnAm) = [M m+ ] n · [A n- ] m (3.2)
Под растворимостью обычно понимают концентрацию ионов металла в насыщенном растворе малорастворимой соли.
Соотношения (3.2) и (3.3) позволяют рассчитывать значения ПР по известной растворимости веществ и, наоборот, растворимость веществ по известным ПР при Т= const.
ПРИМЕР 3.2 Определите ПР фторида магния, если его растворимость (S) в воде равна 0,001 моль/л при некоторой температуре.
Решение: Пересчитаем концентрацию Ag2CO3, выраженную по условию задачи в граммах на литр, в моль на литр. Для этого разделим растворимость Ag2CO3 в единицах моль/л на молярную массу Ag2CO3:
Составляем уравнение диссоциации соли:
Вычисляем ПР:
В общем случае для осадка МmАn растворимость в воде вычисляют по формуле:
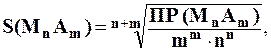
где m + n – суммарное число катионов и анионов;
ПР – произведение растворимости вещества;
m – число молей катионов в уравнении диссоциации вещества;
n – число молей анионов в уравнении диссоциации вещества.
Формула (3.4) справедлива в том случае, если можно пренебречь влиянием ионной силы раствора и протеканием конкурирующие реакций.
В реальных условиях анализа сравнительно редко приходится иметь дело с насыщенными растворами малорастворимых соединений, не содержащими каких-либо посторонних ионов, которые способны взаимодействовать с ионами осадка. Эти конкурирующие реакции приводят к увеличению растворимости.
Так, катионы осадка могут вступать во взаимодействие с каким-либо лигандом, образуя комплексы, анионы осадка в свою очередь могут подвергаться протонизации.
Правило постоянства произведения концентраций следует из применения закона действия масс к насыщенному раствору малорастворимого электролита. Однако это правило имеет приближенный характер, потому что равновесие между осадком и раствором характеризуется более сложной зависимостью.
При введении в насыщенный раствор труднорастворимой соли постороннего электролита состояние равновесия нарушается, часть твердой фазы будет переходить в раствор и растворимость осадка увеличится.
Процесс растворения твердой фазы проходит до тех пор, пока активность ионов в растворе, т. е. их способность к взаимным столкновениям, не станет такой же, как и до введения в раствор постороннего электролита. После этого снова установится динамическое равновесие между осадком и ионами раствора. Поэтому постоянной величиной является не произведение концентрации ионов, а произведение их активности.
Активность – величина, учитывающая отклонения от законов идеальных растворов, связанные с различными взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя.
Правило произведения растворимости: в насыщенном растворе малорастворимой соли произведение активностей ионов при постоянной температуре и давлении является величиной постоянной.
Величину ПА называют произведением активности; она, в отличие от произведения растворимости, не зависит от концентрации посторонних ионов в растворе. Формулу (3.5) используют, если нельзя пренебречь влиянием ионной силы раствора.
Связь между произведением растворимости и произведением активности можно установить, исходя из следующей зависимости:
Для расчета коэффициентов активности применяют правило ионной силы раствора:
где I – ионная сила раствора;
СВ – концентрация иона В. моль/л;
Тогда коэффициент активности можно рассчитать по формуле:
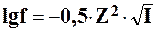
Решение: Растворимость осадка в моль/л без учёта коэффициентов активностей вычисляют непосредственно по произведению растворимости:
В присутствии посторонних электролитов коэффициенты активности ионов, которые зависят от ионной силы раствора, всегда меньше единицы. Отсюда можно заключить, что произведение растворимости, а также и растворимость малорастворимых соединений увеличивается в растворах с повышением концентрации сильных электролитов.
При добавлении реактива, в котором содержатся ионы, одноименные с ионами осадка, растворимость осадка уменьшается. Этим широко пользуются в химическом анализе.
Факторы растворимости
Растворимость
Растворимость — это свойство вещества образовывать с различными растворителями гомогенные смеси. Количество растворяемого вещества, необходимое для получения насыщенного раствора и определяет растворимость этого вещества.
В связи с этим растворимость имеет ту же меру, что и состав, например, массовая доля растворенного вещества в его насыщенном растворе или количество растворенного вещества в его насыщенном растворе.
Все вещества с точки зрения его растворимости можно классифицировать на:
Известно, что если полярность растворяемого вещества схожа с полярностью растворителя, то оно скорее всего растворится. Если же полярности разные, то с большой долей вероятности раствора не получится. Почему же так происходит?
Процесс растворения
Полярный растворитель – полярное растворяемое вещество.
Для примера опишем раствор поваренной соли в воде. Как мы уже знаем, молекулы воды имеют полярную природу с частичным положительным зарядом на каждом атоме водорода и частичным отрицательным – на атоме кислорода. А твердые ионные вещества, вроде хлорида натрия, содержат катионы и анионы. Поэтому, когда поваренную соль помещают в воду, частичный положительный заряд на атомах водорода молекул воды притягивается отрицательно заряженным ионом хлора в NaCl. Аналогично, частичный отрицательный заряд на атомах кислорода молекул воды притягивается положительно заряженным ионом натрия в NaCl. И, поскольку притяжение молекул воды для ионов натрия и хлора сильнее взаимодействия, удерживающего их вместе, соль растворяется.
Неполярный растворитель – неполярное растворяемое вещество.
Попробуем растворить кусочек тетрабромида углерода в тетрахлориде углерода. В твердом состоянии молекулы тетрабромида углерода удерживаются вместе благодаря очень слабому дисперсионному взаимодействию. При помещению его в тетрахлорид углерода его молекулы будут располагаться более хаотично, т.е. увеличивается энтропия системы и соединение растворится.
Равновесия при растворении. Произведение растворимости
Рассмотрим раствор малорастворимого соединения. Для того, чтобы между твердым веществом и его раствором установилось равновесие, раствор должен быть насыщенным и соприкасаться с нерастворившейся частью твердого вещества.
Например, предположим, что равновесие установилось в насыщенном растворе хлорида серебра:
AgCl(тв)=Ag + (водн.) + Cl — (водн.)
Рассматриваемое соединение является ионным и в растворенном виде присутствует в виде ионов. Нам уже известно, что в гетерогенных реакциях концентрация твердого вещества остается постоянной, что позволяет включить ее в константу равновесия. Поэтому выражение для константы равновесия будет выглядеть следующим образом:
K = [Ag + ][ Cl — ]
Такая константа называется произведением растворимости ПР, при условии, что концентрации выражаются в моль/л.
ПР = [Ag + ][ Cl — ]
Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении равновесия.
Следует отличать понятие растворимости и произведения растворимости.
Растворимость вещества может меняться при добавлении в раствор еще какого-либо вещества, а произведение растворимости не зависит от присутствия в растворе дополнительных веществ. Хотя эти две величины взаимосвязаны, что позволяет зная одну величину, вычислить другую.
Зависимость растворимости от температуры и давления
Вода играет важную роль в нашей жизни, она способна растворять большое количество веществ, что имеет большое значение для нас. Поэтому основное внимание уделим именно водным растворам.
Влияние давления на растворимость
Растворимость газов повышается при росте давления газа над растворителем, а растворимость твердых и жидких веществ зависит от давления несущественно.
Уильям Генри впервые пришел к выводу, что
количество газа, которое растворяется при постоянной температуре в заданном объеме жидкости, прямо пропорциональна его давлению.
Данное утверждение известно как закон Генри и выражается оно следующим соотношением:
С = k·P,
где С – растворимость газа в жидкой фазе
Р – давление газа над раствором
k – постоянная Генри
Влияние температуры на растворимость
На следующем рисунке приведены кривые зависимости растворимости некоторых газов в воде от температуры при постоянном давлении газа над раствором (1 атм)
Как видно, растворимость газов уменьшается с ростом температуры, в отличие от большинства ионных соединений, растворимость которых растет с увеличением температуры.
Влияние температуры на растворимость зависит от изменения энтальпии, которое происходит при процессе растворения. При протекании эндотермического процесса происходит увеличение растворимости с ростом температуры.
Это следует из уже известного нам принципа Ле – Шателье: если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Представим, что мы имеем дело с раствором, находящимся в равновесии с частично растворившимся веществом. И этот процесс является эндотермическим, т.е. идет с поглощением теплоты из вне, тогда:
Вещество + растворитель + теплота = раствор
Согласно принципу Ле – Шателье, при эндотермическом процессе, равновесие смещается в направлении, способствующее уменьшению поступления теплоты, т.е. вправо. Таким образом, растворимость увеличивается.
Если же процесс экзотермический, то повышение температуры приводит к уменьшению растворимости.
Далее на рисунке показаны зависимости растворимости некоторых ионных соединений от температуры.
Известно, что существуют растворы жидкостей в жидкостях. Некоторые из них могут растворяться друг в друге в неограниченных количествах, как вода и этиловый спирт, а другие — растворяются лишь частично.
Так, если попробовать растворить четыреххлористый углерод в воде, то при этом образуются два слоя: верхний — насыщенный раствор воды в четыреххлористом углероде и нижний — насыщенный раствор четыреххлористого углерода в воде.
При повышении температуры, в основном, взаимная растворимость таких жидкостей увеличивается. Это происходит до тех пор, пока не будет достигнута критическая температура, при которой обе жидкости смешиваются в любых пропорциях. От давления растворимость жидкостей практически не зависит.
При вводе в смесь, состоящую из двух несмешивающихся между собой жидкостей, вещества, которое может растворяться в любой из этих двух жидкостей, его распределение между этими жидкостями будет пропорционально растворимости в каждой из них.
Согласно закону распределения вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества:
где С1 и С2 – концентрации вещества в двух жидкостях
Произведение растворимости в химических реакциях — правило и формула вычисления
Определение и суть
При определённой температуре, зависящей от вида раствора электролита между кристаллами и его содержанием, устанавливается равновесие. Оно является динамическим, так как скорость прямой и обратной реакции совпадают, то есть время растворения и кристаллизации равны. Главным условием для наступления такого процесса является содержание в жидкости малорастворимого электролита.
Протекающая реакция характеризуется двумя константами:
Общей формулой произведения растворимости в химии является выражение: ПР = [Ky]x * [Ax-]y. Таким образом, определяется взаимосвязь между постоянной растворимости и равновесия. То есть это гетерогенное равновесие между кристаллами Кх Ау и раствором.
Любое соединение, образующее раствор, может быть насыщенным или ненасыщенным. Первым называют взаимодействие при определённой температуре, когда можно растворить ещё какую-то часть продукта, а вторым — раствор, в котором скорости реакции и осаждения равны. Существует и третий вид раствора — перенасыщенный. Это состояние реакции, при которой образуется осадок.
Эти три состояния можно описать формулами:
Это термин, определяющий соотношение между термодинамическим равновесием исходных продуктов и элементов, находящихся в химическом равновесии. Для общего случая формула имеет вид: Σ ViAi ← → Σ VtAt, где: vi, vt — стехиометрические числа исходных продуктов и реакции, активность которых определяется ai, at. Отсюда константа равновесия равна отношению операторов произведения: Ka = П aVt At / П aVi Ai. Это выражение, по сути, описывает закон действующих масс в математической форме.
Константа связана и с перераспределением энергии Гиббса. Эта зависимость объединяет температуру, давление и газовую постоянную. Так как свободная энергия — это мощность, равная изменению системы внутри неё, то потенциал Гиббса характеризуется полной энергией, которая используется для химического превращения и позволяет определить возможность прохождения реакции. Находится она по формуле: G = U + PV — TS. Изменение мощности можно описать выражением: ΔG = R * T * LtKa.
Зависимость константы от температуры и давления описывается соотношением: (ΔltKa / ΔT) p = ΔH0 / RT2 и (ΔltKa / ΔP) t = ΔV0 / Rt2. В формуле ΔH 0 и ΔV0 используются определённые изменения объёма и тепловой функции. Количественное значение постоянной зависит от выбора установленного состояния для каждого вещества, участвующего в реакции. Для ненасыщенных растворов в качестве такого состояния принимают гипотетическое при единичной концентрации. Поэтому при максимальном разбавлении значение константы будет зависеть только от природы растворителя.
Если во взаимодействии принимают участие как твёрдые, так и жидкие компоненты, то такое состояние называют стандартным. Активность таких веществ равна единице и не входит в уравнение константы. Для газов же учитывают летучесть. В этом случае постоянная обозначается Kf. Если газ считать идеальным, то смесь компонентов равна парциальному давлению. Выразив через него константу равновесия, можно получить формулу молярной концентрации: Cj = (pj / RT)ΔV. Две константы равновесия между собой связываются отношением: Kf = Ka/(RT).
Определение влияния константы равновесия и решение уравнений электронного баланса даёт возможность найти равновесные составы уравнений, что важно для описания термодинамических процессов.
Правило активности ионов
В аналитической химии по выпадению осадка часто определяют, какие продукты содержатся в растворе. На изучении осадка построен качественный анализ. В природе не существует веществ абсолютно нерастворимых, поэтому всегда образуются выпавшие частицы или ионы. Для изучения системы осадок-раствор и используют правило произведения растворимости.
Сформулировал этот закон в 1889 году Нернст. Согласно утверждению химика, в высококонцентрированном растворе малорастворимого соединения произведение активностей частиц с их стехиометрическими коэффициентами определяется константой, характерной для растворителя. При этом на показатель также влияет температура.
По факту это правило является следствием второго начала термодинамики применительно к равновесной системе. По сути, осадок представляет двухфазную систему. Правило произведения было установлено эмпирическим путём при изучении слаборастворимых веществ. Его нельзя применять, например, к солям KCl, TaTO3 и другим.
Полный расчёт обычно довольно сложен, так как необходимо определить коэффициенты активности. Поэтому используют упрощённый подход. Расчёт выполняют только для слаборастворимых веществ, у которых активность ионов равна концентрации. Следовательно, она составляет единицу. А также при отсутствии дополнительных кислот или оснований пренебрегают гидролизом.
В качественном анализе большую часть электролитов охватывают следующие типы солей:
Экспериментально установленные значения являются справочными данными и берутся из таблицы произведений растворимости. Зная их величину, вычислить растворимость слаборастворимых продуктов при установленных условиях не составляет труда.
При росте ионной силы растворимость осадка будет возрастать, так как величина коэффициентов активностей уменьшается. Использование в соединении сильного электролита без одноимённого иона приводит к количественному возрастанию осадка. Связано это со снижением активности. Для такого случая уравнение примет вид: ПР = amA * atB = (mS)m * (tS)t * fam * fbt = mm * tt * sm+t * fam * fbt. Эта формула учитывает так называемый солевой эффект.
Экспериментальное подтверждение
Для эксперимента нужно поместить в химическую колбу любую труднорастворимую соль, например, AgCl, и перемешать с ней дистиллированную воду. Так как ионы Ag+ и Cl- взаимодействуют с диполями H2O, то через время они начнут отрываться от кристаллической решётки и насыщать раствор.
Сталкиваясь, освободившиеся ионы начнут создавать хлорид серебра и выпадать в виде осадка. Это приводит к тому, что в системе возникают два противоположных друг другу процесса. В итоге наступает динамическое равновесие. То есть за единицу времени в раствор поступает столько частиц серебра и хлора, сколько и выпадает в осадок. После того как отрыв ионов прекратится, раствор станет насыщенным. Таким образом, получится раствор, где будет находиться осадок труднорастворимой соли с находящимся в жидком состоянии соединении этого же вещества.
Процесс образования соединения будет сопровождаться:
Исходя из того, что эта система находится в состоянии равновесия, верным будут следующие выражения: V1 = V2 и K1 = K2. То есть [Ag + ] [Cl — ], где: [ Cl — ] = k 2 / k 1 = cotst, для реакции, протекающей при постоянной температуре. Поэтому можно утверждать, что произведение количества ионов в концентрированном растворе малорастворимого электролита будет постоянной величиной, но только при постоянной температуре: ПР AgCl = [ Ag + ] * [ Cl — ].
В рассмотренном примере одинаковых ионов нет. Когда же диссоциация происходит в электролите, содержащем два и более одинаковых вещества, то для расчета произведения растворимости нужно концентрацию ионов возвести в степень. Поэтому для общего случая и используют формулу: ПР A x B e = [A] x [B] y.
Но необходимо учитывать и влияние различных факторов. К ним относят концентрацию раствора, количество осадителя, температуру, присутствие одноимённого иона. Правило произведения важно при растворении осадков в растворе. С его помощью можно заранее узнать выпавшую в осадок часть. Для часто используемых соединений существует таблица, куда внесены экспериментально полученные результаты при температуре 250С.
Примеры решения задач
Произведение растворимости
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
Константа этого равновесия рассчитывается по уравнению:
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
Константа равновесия такого процесса называется произведением растворимости.
где [A n+ ] и [B m- ] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1·10 −4 моль/л необходимо использовать произведение активностей:
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
где: m+n — суммарное количество молей катионов и анионов m — количество молей катиона n — количество молей аниона Ksp — произведение растворимости S — растворимость вещества (моль/л)
Литература
Ссылки
Полезное
Смотреть что такое «Произведение растворимости» в других словарях:
произведение растворимости — tirpumo sandauga statusas T sritis Standartizacija ir metrologija apibrėžtis Blogai tirpstančio elektrolito sočiojo tirpalo jonų molinių koncentracijų sandauga. atitikmenys: angl. solubility product vok. Löslichkeitsprodukt, n rus. произведение… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
произведение растворимости — tirpumo sandauga statusas T sritis chemija apibrėžtis Blogai tirpaus elektrolito sočiojo tirpalo jonų molinių koncentracijų sandauga. atitikmenys: angl. solubility product rus. произведение растворимости … Chemijos terminų aiškinamasis žodynas
произведение растворимости — tirpumo sandauga statusas T sritis fizika atitikmenys: angl. solubility product vok. Löslichkeitsprodukt, n rus. произведение растворимости, n pranc. produit de solubilité, m … Fizikos terminų žodynas
Произведение растворимости — произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита. Показатели степени для концентраций, входящих в П. р., равны коэффициенту при соответствующем ионе в уравнении диссоциации электролита. Для… … Большая советская энциклопедия
произведение растворимости — см. константа растворимости … Химические термины
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ — см. Произведение активностей … Химическая энциклопедия
произведение растворимости — ионное произведение … Cловарь химических синонимов I
ПРОИЗВЕДЕНИЕ АКТИВНОСТЕЙ — (ПА), произведение термодинамич. активностей ионов в насыщ. р ре электролита (соль, гидроксид и т. п.) в данном р рителе. Растворение твердого в ва AkBl с образованием ионов Az+ и В z записывается как р ция: AkBl (тв) kAz+ (р р) + lВ z (р р).… … Химическая энциклопедия
Произведение активности — см. Произведение растворимости … Большая советская энциклопедия
ионное произведение — произведение растворимости … Cловарь химических синонимов I