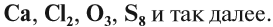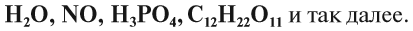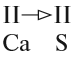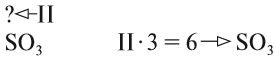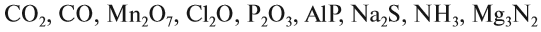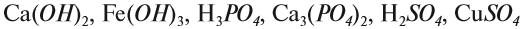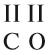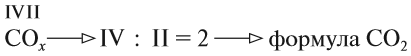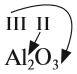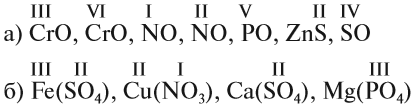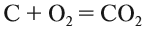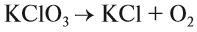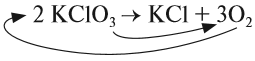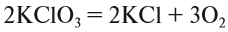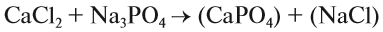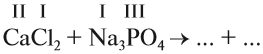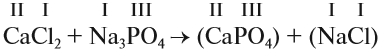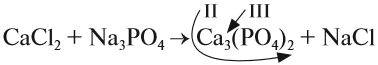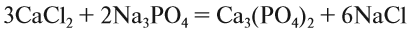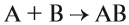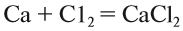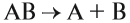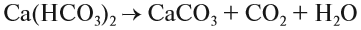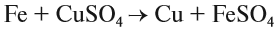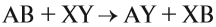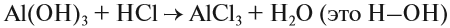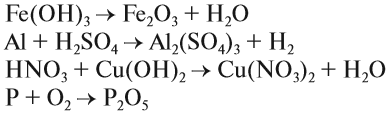Что называется предметом изучения химии
Предмет химии. Вещества.
Вещества и тела Окружающий нас мир состоит из множества разнообразных объектов, которые называют физическими телами. Всё то, из чего состоят физические тела, называют веществом. Что же такое вещество, и чем оно отличается от физического тела?
Из курса природоведения вам должны быть знакомы эти понятия и различия между ними. Рассмотрим процесс фотосинтеза, протекающий в растениях. Растение поглощает воду, минеральные удобрения, углекислый газ из воздуха. В результате фотосинтеза в атмосферу выделяется кислород, а в листьях растения накапливается глюкоза, которая является своего рода «пищей» для растения. И кислород, и глюкоза являются веществами! Немного поразмыслив можно прийти к выводу, что в нашем мире абсолютно все состоит из разнообразных веществ и их смесей. На сегодняшний день количество химических веществ, известных человеку, уже составляет более 100 000 000. И это число непрерывно растет!
Что же изучает химия, о чем эта наука?
Химия – наука о веществах, их свойствах и превращениях Вещество – совокупность атомов, молекул или других частиц, находящихся в определенном агрегатном состоянии.
Какой бывает химия?
Достоверно неизвестно откуда и когда появился термин «химия». По одной из версий термин «химия» произошел от египетского слова «хем» – арабского названия этой страны. Таким образом, дословно «химия» переводится как египетская наука. Это же слово означало «черный» – видимо, по цвету почвы в долине реки Нил, протекающей по территории Египта. «Кем», или «Хем» (Khemia – «Черная страна», «страна с черной землей») – так называли в древней Греции Египет. В таком варианте слово «химия» переводится как «черная наука» или «наука черной земли». Вторая версия выводит слово «химия» из греческого χυμος («хюмос»), которое можно перевести как «сок растения». Этот термин встречается в рукописях, содержащих сведения по медицине и фармакологии. Согласно же третьей версии, слово «химия» происходит от другого греческого слова – χυμα («хюма»), означающего «литье», «сплав».
В таком случае «химия» – это искусство литья выплавки металлов, то есть металлургии.
Термин «химия» впервые употребил греческий алхимик Зосима Панополитанский в V веке н. э. Он использовал этот термин в смысле «настаивание», «наливание». Современное слово для обозначения науки химии произошло от позднелатинского chimia и является интернациональным: например,
В русском языке этот термин появился в эпоху Петра I. Современная химическая наука развивается стремительно и активно. Постоянно открываются новые, ранее неизвестные вещества, с разнообразными интересными свойствами. В наши дни химию принято делить на отдельные химические области. Рассмотрим самые главные «ветви» химической науки:
Основные задачи химии
Какие же задачи сегодня стоят перед химической наукой и химиками? Наиболее важной задачей является получение новых веществ, с полезными для человечества свойствами. Например, сегодня не существует лекарств от многих болезней, и химики работают над созданием препаратов от таких болезней как сахарный диабет, грипп, онкологические заболевания. Человечество пока не может покорять другие планеты, но со временем, при изобретении более совершенных средств передвижения в пространстве, это станет возможным, здесь так же не обойдется без химии, ведь для создания космических кораблей необходимо множество химических веществ и материалов.
Десятилетиями человечество использовало ресурсы планеты не очень эффективно. Результатом этого стало существенное загрязнение окружающей среды. Кроме того, возникла проблема нехватки природных ресурсов. Сегодня химики пытаются решить эти проблемы: сделать промышленные производства безопасными для окружающей среды, и создать альтернативу невозобновляемым природным ресурсам.
Одним из решений данной проблемы является безотходное химическое производство. За относительно небольшой промежуток времени человечество изучило свойства множества веществ и создало на их основе множество материалов. Нельзя однозначно сказать, какие вещества полезны, а какие вредны. Важно лишь то, с какой целью и как эти вещества будут использоваться: для пользы, или во вред человечеству, природе и нашей планете.
Подведем итоги
Лекция “Предмет и задачи химии. Основные понятия химии”
“Предмет и задачи химии. Основные понятия химии”
1. Предмет изучения химии.
2. Задачи и значение химии.
3. Основные понятия химии.
1. Предмет изучения химии.
Химия – относится к естественным наукам и изучает состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
Химия изучает окружающий мир, т. е. материю, которая проявляется в двух формах: вещества и поля.
Вещество – форма материи состоящая из частиц, которые имеют массу покоя (собственную массу), занимающая часть пространства и существующая за счет сил притяжения и отталкивания. К веществам относятся макротела, микротела и элементарные частицы (ē,p, n). Число природных синтезированных веществ составляет более 10 млн.
Поле – это такая форма существования материи, которая прежде всего характеризуется энергией. Посредством поля осуществляется взаимодействие между частицами вещества. Пример: электромагнитные и гравитационные поля.
Неотъемлемым свойством материи является движение.
Движение материи – это любое изменение. Материя находится в непрерывном движении. Формы движения очень разнообразны – тепловая, химическая, механическая. Формы движения материи изучаются разными естественными науками: химией, физикой, биологией и др.
Предмет изучения химии: химия изучает химическую форму движения материи, под которой понимают качественное изменение веществ, т. е. разрушение одних химических связей и образование других. В результате химических процессов возникают новые вещества с новыми химическими и физическими свойствами.
Свойствами материи являются:
Объектом изучения в химии являются химические элементы и их соединения.
2. Задачи и значение химии.
1. Получение веществ с заранее заданными свойствами (для развития новой техники необходимы материалы с особыми свойствами, которых нет в природе: сверхчистые, сверхтвердые, жаростойкие, сверхпроводящие).
2. Повышение эффективности производства и качества продукции.
3. Создание безвредных, безотходных технологий.
4. Рациональное использование энергии химических превращений (в настоящее время электрическую и механическую энергию получают в основном преобразованием химической энергии природного топлива).
Значение химии для с/х:
2. Химические средства защиты растений.
3. Лекарственные препараты.
3. Основные понятия химии.
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый (1741 г.). Атомно-молекулярное учение позволяет объяснить основные понятия и законы химии.
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Частицы – молекулы и атомы – находятся в непрерывном движении.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ из различных атомов.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Элемент – вид атомов с одинаковым зарядом ядра. Каждый элемент имеет своё название и символ. В настоящее время известно 109 химических элементов периодической системы (ПС). Из них в природе существует 88 и более 20-ти получены искусственным путем в процессах ядерных превращений элементов.
Символы элементов состоят из одной или двух букв латинского названия элементов и являются интернациональными. Названия элементов в каждом языке различны.
Пример: элемент с русским названием водород имеет символ “Н” (аш), который является первой буквой латинского названия этого элемента”Hydrogenium”.
Все элементы делятся на металлы и неметаллы. Если провести диагональ от бора (В) к астату (At), то к металлам будут относиться все элементы слева от диагонали + элементы побочных подгрупп, справа неметаллы.
Молекула – наименьшая частица вещества, которая сохраняет его химические свойства.
Состав любой молекулы можно выразить молекулярной химической формулой – показывает качественный и количественный состав молекулы.
H2SO4 качественный состав: молекула состоит из атомов H, S, O
количественный: 2 атома Н, 1 атом S, 4 атома О.
— графическая формула – отображает структуру молекулы:
Н-О-Н графическая формула молекулы воды
черта – обозначает общую электронную пару, т. е. одну химическую связь, число связей определяется валентностью данного элемента.
Все вещества делятся на простые и сложные:
Простые вещества – это вещества, состоящие из атомов одного элемента.
Простые вещества делятся на два класса:
газообразные тв. в-ва свободные несвязанные атомы
двухатомные благородные газы
Число существующих простых веществ (≈ 400) больше числа химических элементов, что объясняется явлением аллотропии.
Аллотропия – это явление образования нескольких простых веществ одним элементом.
Простые вещества, образованные одним и тем же элементом, называются аллотропными модификациями. Они могут отличатся

или структурой: С графит
Сложные вещества – это вещества, состоящие из атомов разных элементов. Сложные неорганические вещества классифицируются на основные 4 класса:
— основания: NaOH, Cu(OH)2
Ионы – частицы имеющие заряд. Ионы делятся на простые и сложные.
Простые ионы – состоят из атомов одного элемента (Na+, Cl-).
Сложные ионы – состоят из атомов нескольких элементов (OH-, SO42-).
Положительно заряженные ионы называются катионами.
Отрицательно заряженные – анионами.
Заряд простого иона – равен степени окисления элемента в соединении.
Необходимо помнить, что постоянные степени окисления в сложных соединениях проявляют следующие элементы:
— кислород О-2 (исключения Н2О2-1, О+2F2)
— водород Н+1 (искл. гидриды NaH-1)
— щелочно-земельные Ме+2: Ca2+, Mg2+, Ba2+
— все металлы имеют только положительную степень окисления (max-е значение = № группы)
Переменные степени окисления: Fe2+, Fe3+, Cu+, Cu2+
Кислотный остаток – это все то, что остается от молекулы кислоты после отнятия катиона Н+.
Заряд кислотного остатка – всегда отрицательный (анион) и равен числу катионов водорода, которые необходимо отнять от молекулы кислоты, чтобы получить данный остаток:


H3PO4 


Название: гидро (Н), числительное ди – (Н2….)
Остаток от основания – все то, что остается от молекулы основания после отнятия гироксильной группы.
Заряд остатка от основания – всегда положительный (катион) и равен числу гидроксильных групп, которые необходимо отнять, чтобы получить данный остаток:
Al (OH)3 
Al (OH)3 
Al (OH)3 
Составление молекулярных формул веществ.
общ. зар. катиона: 3 (+2) = +6
Последовательность составления молекулярной формулы:
1. По названию определить класс соединения; записать ионы: на первом месте катион, затем анион.
2. Определить заряд катиона и заряд аниона.
3. Если заряды численно равны, то индексы =1, они не ставятся.
Если заряды не равны, то их уравнивают: находят общее кратное заряда катиона и аниона и делят его на заряд катиона (получают индекс для катиона) и на заряд аниона (получают индекс для аниона)
4. Осуществляется проверка: ∑ общ. зарядов катиона и аниона = 0
ПРИМЕР: Привести молекулярную формулу оксида фосфора (V)
1) оксид => PO; (V) => С. О. = +5
4) 10:5 = 2 индекс для (Р)

Предмет, объект и методы химии.
Лекция 7. Система современного химического знания.
1. Предмет, объект и методы химии. Эволюция химических знаний и современная химическая картина мира.
2. Химические вещества.
4.Химические процессы.
5.Химия экстремальных состояний.
Предмет, объект и методы химии.
Химия – это наука о строении, структуре и свойствах веществ, а также реакциях, в которых одни вещества превращаются в другие.
Объектом химии выступает материя, предметом – элементы ее строения и процессы, возникающие между ними.
В химии первичным понятием считается “чистое вещество”, а вторичными – смеси и растворы. Смеси можно разделить на чистые вещества физическими методами. Часть вещества, однородная во всем своем объеме, называется гомогенной. Гомогенные смеси называются растворами (смесь поваренной соли и воды). Неоднородные смеси называются гетерогенными (смесь воды и глины).
Вещества разделяют на простые и сложные (соединения). Вещество, которое нельзя разложить, называют либо элементарным, либо просто химическим элементом. Элементыклассифицируются на металлы (золото, платина, серебро, железо, медь, алюминий, кальций, ртуть и т. д.) и неметаллы (сера, фосфор, углерод, азот, хлор, кислород и т.д.).
Вещество, которое можно разложить на два или более веществ, является химическим соединением (вода, кислоты, соли и т.д.). Качества различных веществ характеризуются их физическими и химическими свойствами. Физические – это свойства, которые можно наблюдать и изучать, не превращая данное вещество в другое. Химические свойства определяют способность данного вещества участвовать в каких-либо химических реакциях, в связи с чем часто используется понятие “реакционная способность” вещества.
Под химическим процессом понимаются превращения одного или нескольких исходных веществ в отличающиеся от них по химическому составу или строению вещества. Химические процессы подчиняются всеобщим законам природы – закону сохранения массы вещества, закону постоянства состава и закону сохранения энергии.
Закон сохранения массы в химических процессах можно сформулировать так: сумма масс исходных веществ (соединений) равна сумме масс продуктов химической реакции. Например, при разложении воды масса воды будет равна сумме массы водорода и массы кислорода. Из закона сохранения вещества вытекает, что вещество нельзя ни создать из ничего, ни уничтожить совсем. Количественным выражением закона сохранения массы веществ применительно к производственному химическому процессу является материальный баланс, в котором подтверждается, что масса веществ, поступивших на технологическую операцию (приход), равна массе полученных веществ (расход). Рассматриваемый закон был открыт М.В. Ломоносовым (1748 г.) и А. Лавуазье (1789 г.) практически независимо друг от друга.
Закон постоянства состава. Впервые сформулирован Ж. Прустом (1808 г.): любое индивидуальное химическое соединение обладает строго определенным неизменным составом, прочным притяжением составных частей (атомов) и тем отличается от смесей. Теоретически закон постоянства состава обосновал Д. Дальтон (1803 г.). На основе идеи об атомистическом строении вещества он утверждал, что соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом (закон кратных отношений). В смесях отсутствуют тесные взаимодействия между атомами, которые характерны для соединений. Другими словами, постоянство состава химических соединений обусловлено физической природой химических связей, объединяющих атомы в одну квантомеханическую систему – молекулу.
Закон сохранения энергии действует во всех случаях и повсюду, где одна форма энергии переходит в другую, например, при переходе энергии пара в турбине в энергию вращательного движения, т.е. механическую энергию, при переходе электрической энергии в электрической лампочке в световую и т.д. Так же как нельзя ни уничтожить, ни создать вещество, нельзя ни создать, ни уничтожить энергию.
Специфическим видом энергии является химическая энергия, которая освобождается или расходуется при каждой химической реакции. Химическую энергию, как и любой вид энергии, можно превратить в механическую (использование взрывчатых веществ), тепловую (сжигание топлива), электрическую (гальванические элементы) и т.п. Измерить химическую энергию непосредственно нельзя. Ее величина определяется как величина тепловой энергии в килоджоулях (кДж).
Основными методами химии выступают метод химического синтеза иметод химического анализа.
Под методом химического синтеза понимают производство сложных соединений из исходных элементов (например, производство искусственного каучука, камфоры и т.п.). Материалы, полученные в результате синтеза, называют синтетическими. Химическое разложение, в результате которого получаются простейшие вещества, называется химическим анализом. Все известные на сегодня элементы в систематизированном виде в соответствии с периодическим законом, открытым Д.И. Менделеевым, расположены в периодической системе химических элементов.
Химический анализ включает в себя:
• спектральный анализ – совокупность методов определения состава объекта на основании изучения спектров взаимодействия материи с излучением, включая спектры электромагнитного излучения, радиации, акустических волн, распределения по массам и энергиям элементарных частиц и т.д. Традиционно различают атомный и молекулярный спектральный анализ, “эмиссионный” по спектрам испускания и “абсорбционный” по спектрам поглощения, а также “масс-спектрометрический” по спектрам масс атомарных и молекулярных ионов. Спектральный анализ по оптическим спектрам атомов был предложен в 1859 г. Г. Кирхгофом и Р. Бунзеном. С его помощью гелий был открыт на Солнце раньше, чем на Земле;
• хроматографию – метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами – неподвижной и подвижной (элюентом). Название метода связано с первыми эеспериментами по хроматографии, в ходе которых в 1900 г. русский разработчик метода М. Цвет разделял ярко окрашенные растительные пигменты. Традиционно хроматография делится на два вида – газовую (газожидкостная и газотвердофазная) и жидкостную (жидкостно-жидкостная, жидкостно-твердофазная, жидкостно-гелевая);
полярографию – один из важнейших электрохимических методов анализа и исследования. Предложен Я. Гейровским в 1922 г. Измеряют предельный ток, величина которого пропорциональна концентрации определяемого вещества. Величину предельного тока находят по кривой зависимости силы тока от приложенного напряжения (такая кривая называется полярограммой). Для получения полярограммы нужно, чтобы поверхность катода была значительно меньше поверхности анода. Полярография применяется для количественного определения ряда ионов (кадмий, цинк, свинец и т.д.), некоторых органических веществ;
масс-спектрометрию – это метод исследования вещества путем определения отношения массы к заряду (качества) и количества заряженных частиц, образующихся при том или ином процессе воздействия на вещество. История масс-спектрометрии ведется с основополагающих пионерских опытов Дж. Томсона а начале ХХ в. Вторую часть “-метрия” термин получил после повсеместного перехода от детектирования заряженных частиц при помощи фотопластинок к электрическим измерениям ионных токов.
Существенное отличие масс-спектрометрии от других аналитических физико-химических методов состоит в том, что оптические, рентгеновские и некоторые другие методы детектируют излучение или поглощение энергии молекулами или атомами, а масс-спектрометрия непосредственно детектирует сами частицы вещества.
Методология судебно-химического анализа. Основной задачей судебно-химической экспертизы является выбор оптимального метода изолирования веществ. Для обнаружения и идентификации химических и лекарственных веществ используются как предварительные методы (цветные реакции, тонкослойная хроматография, иммунноферментные методы), так и подтверждающие-нструментальные (спектрофотометрия в видимой, УФ- и ИК-областях, атомно-абсорбционная спектрофотометрия, газожидкостная хроматография, высокоэффективная жидкостная хроматография, хроматомасс-спектрометрия).
Судебно-химическое исследование может быть проведено на определенное соединение, группу веществ или на неизвестное вещество по схеме общего судебно-химического исследования в зависимости от вопросов, поставленных в сопроводительном документе. Если в ходе исследования возникает необходимость в проведении анализа на другие вещества, то эксперт обязан расширить исследование.
Химические методы занимают важное место в судебно-почвоведческой экспертизе, которая включает в себя экспертизу почвенных наслоений на объект-носителе, землеустроительную экспертизу, эколого-почвоведческую экспертизу, минералогическую экспертизу.
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
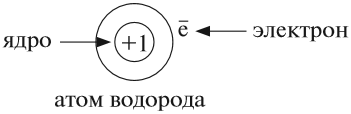
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
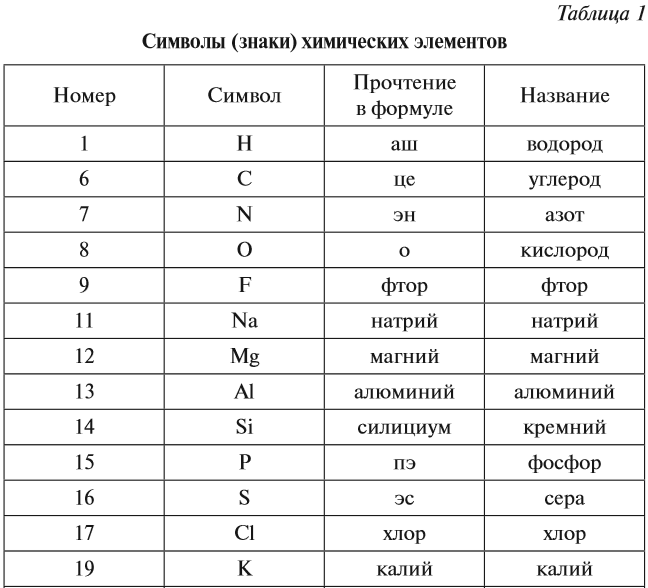
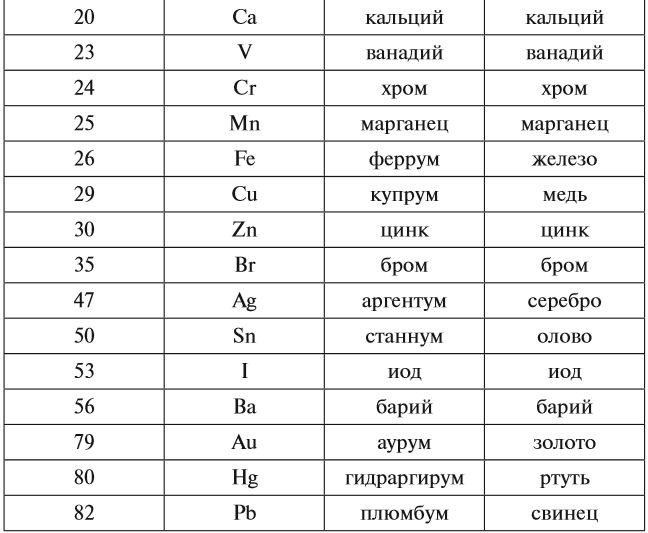
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
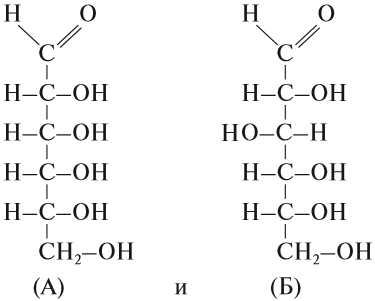
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
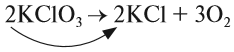
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
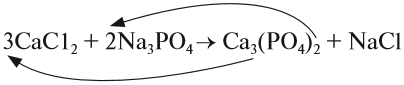
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.