Что называется порядком реакции
Порядок реакции
Смотреть что такое «Порядок реакции» в других словарях:
ПОРЯДОК РЕАКЦИИ — по данному веществу показатель степени при концентрации этого вещества в кинетическом уравнении химической реакции. Суммарный порядок реакции слагается из порядков реакции по всем веществам, концентрации которых входят в кинетическое уравнение … Большой Энциклопедический словарь
порядок реакции — [reaction order] понятие химической кинетики. Порядок реакции определяется как сумма показателей степеней n1 и n2 в уравнении: r = k[A1]n1r • [A2]n2 выражающем зависимость скорости реакции r от концентраций [А1] и [A2 … Энциклопедический словарь по металлургии
порядок реакции — по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении химической реакции. Суммарный порядок реакции слагается из порядков реакции по всем веществам, концентрации которых входят в кинетическое уравнение.… … Энциклопедический словарь
порядок реакции — reakcijos laipsnis statusas T sritis Standartizacija ir metrologija apibrėžtis Reaguojančiųjų medžiagų koncentracijų laipsnių rodiklių kinetinėje lygtyje suma. atitikmenys: angl. reaction order vok. Reaktionsordnung, f rus. порядок реакции, m… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
порядок реакции — reakcijos laipsnis statusas T sritis chemija apibrėžtis Reaguojančiųjų medžiagų koncentracijų laipsnių rodiklių kinetinėje lygtyje suma. atitikmenys: angl. reaction order rus. порядок реакции … Chemijos terminų aiškinamasis žodynas
порядок реакции — reakcijos laipsnis statusas T sritis fizika atitikmenys: angl. reaction order vok. Reaktionsordnung, f rus. порядок реакции, m pranc. ordre de la réaction, m … Fizikos terminų žodynas
ПОРЯДОК РЕАКЦИИ — по данному веществу, показатель степени при концентрации этого в ва в кинетич. ур нии хим. реакции. Суммарный П. р. слагается из П. р. по всем в вам, концентрации к рых входят в кинетич. ур ние … Естествознание. Энциклопедический словарь
ПОРЯДОК РЕАКЦИИ — по данному в ву, показатель степени при концентрации этого в ва в кинетич.. ур нии р ции. Согласно действующих масс закону, скорость у простой (одностадийной) р ции между в вами А и В типа n А А + nBB : продукты равна: где u А скорость… … Химическая энциклопедия
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
Физическая химия
Химическая кинетика
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Что называется порядком реакции
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.1 Кинетическое уравнение химической реакции. Порядок реакции.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики :
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
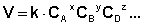
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
2.1.2 Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
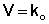
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
2.1.3 Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
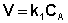
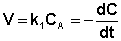
После интегрирования выражения (II.7) получаем:
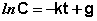
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
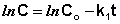
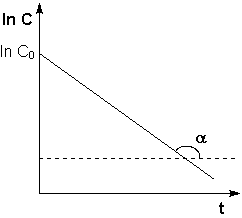
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций
первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
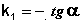
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
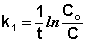
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
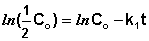
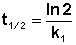
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
2.1.4 Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
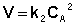
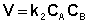
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
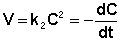
После разделения переменных и интегрирования получаем:
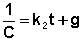
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
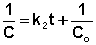
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
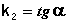
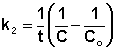
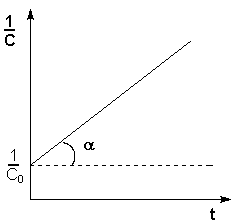
Рис. 2.4 Зависимость обратной концентрации от времени для реакций
второго порядка
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
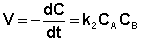
В этом случае для константы скорости получаем выражение
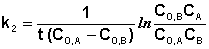
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
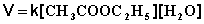
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
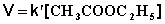
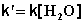
2) Избыток этилацетата:
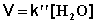
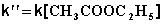
Порядок реакции
Резюме
Общие и определение
Рассмотрим реакцию, уравнение баланса которой записано: a A + b B → c C
Скорость реакции в закрытом реакторе объемом V определяется:
Эта скорость зависит от концентраций реагентов. Экспериментальное изучение реакции позволяет установить форму закона скорости.
В некоторых случаях закон скорости можно представить в виде монома реагентов: тогда мы говорим, что реакция допускает порядок, и называем порядок реакции суммой показателей: Ω = α + β. Показатель степени α представляет собой частичный порядок реакции по отношению к компонентам A, β представляет собой частичный порядок реакции по отношению к компонентам B. v знак равно k ⋅ [ В ] α ⋅ [ B ] β <\ Displaystyle v = к \ cdot [<\ rm >] ^ <\ alpha>\ cdot [<\ rm >] ^ <\ beta>>
Обратите внимание, что α и β не обязательно целые или положительные (обычно 0,5 Определение заказа
Дифференциальный метод
Порядок реакции по отношению к реагенту A можно оценить по начальным скоростям (v i ), полученным для значений, отличных от начальной концентрации ([A] 0 ) реагента A, при сохранении концентраций всех других реагентов. постоянный, так что
Наклон из графика как функция соответствует тогда порядка х по отношению к реагенту А. пер v я <\ displaystyle \ ln v_ > 
Однако этот метод не всегда надежен, учитывая, что:
Интегральный метод
Предварительное уравнение скорости, определенное методом начальной скорости, может быть подтверждено путем сравнения концентраций, измеренных в более длительном интервале (несколько периодов полураспада), с интегрированной формой уравнения скорости.
Например, интегрированный закон скорости реакции первого порядка имеет вид
Этот метод применим только в том случае, если закон скорости достаточно прост, чтобы его можно было интегрировать.
Метод изоляции (или перерождение порядка)
Частичный порядок относительно реагента можно оценить методом выделения (или вырождения порядка) Оствальда :
пусть реакция a · A + b · B → c · C, допускающая порядок с: v знак равно k ⋅ [ В ] α ⋅ [ B ] β <\ Displaystyle v = к \ cdot [<\ rm >] ^ <\ alpha>\ cdot [<\ rm >] ^ <\ beta>>
Чтобы определить частичный порядок α, мы начнем с большого избытка реагента B. Поэтому его концентрацию можно считать постоянной во времени. В этом случае : [ B ] <\ displaystyle [<\ rm >]>
v знак равно k ′ ⋅ [ В ] α <\ Displaystyle v = к '\ cdot [<\ rm >] ^ <\ alpha>>
с участием k ′ знак равно k ⋅ [ B ] β <\ Displaystyle к '= к \ cdot [<\ rm >] ^ <\ beta>>
Затем мы можем сопоставить α с глобальным порядком и вычислить его как таковое с помощью интегрального метода или метода начальной скорости.
Первый заказ
Другой класс реакций первого порядка включает процессы радиоактивного распада, которые все относятся к первому порядку. Однако это скорее ядерные реакции, чем химические реакции.
Закон скорости можно проинтегрировать, чтобы получить приведенную выше линейную форму:
Второго порядка
Второй тип включает в себя реакцию S N 2 (бимолекулярное нуклеофильное замещение), такие как гидролиз Basic из этилацетата
Частичный порядок этой реакции равен 1 по отношению к каждому реагенту, а общий порядок равен 2.
Частичные порядки равны 1 по отношению к реагенту (этилацетату), а также по отношению к имидазолу, который является катализатором и не фигурирует в уравнении баланса реакции.
Псевдо-первый порядок
Нулевой порядок
В реакциях нулевого порядка скорость реакции не зависит от концентрации реагента, поэтому изменения его концентрации не влияют на скорость. Это может произойти, когда существует узкое место, которое ограничивает количество молекул, которые могут реагировать одновременно, например, если их реакция требует контакта с ферментом или каталитической поверхностью.
Многие реакции, катализируемые ферментами, относятся к нулевому порядку, при условии, что концентрация реагента намного выше, чем концентрация фермента, которая определяет скорость насыщения фермента. Например, биологическое окисление этанола до ацетальдегида ферментом алкогольдегидрогеназы печени имеет нулевой порядок по сравнению с этанолом. Реакция никогда не бывает нулевой от начала до конца. Однако на протяжении всей его карьеры это может быть так. Например, в случае ферментативного окисления этанола, как только весь фермент E фиксирует этанол S, комплекс ES трансформируется со скоростью, пропорциональной концентрации ES, которая является постоянной. По этой причине скорость постоянна, что объясняет порядок 0. В самом конце реакции, когда этанола больше не хватает для насыщения фермента, концентрация ES ниже и скорость больше не постоянна. Тогда порядок больше не равен 0.
Точно так же гетерогенно катализируемая реакция может иметь нулевой порядок, если каталитическая поверхность насыщена. Например, разложение фосфина (PH 3 ) на горячей поверхности вольфрама при высоком давлении происходит нулевым порядком до фосфина, который затем разлагается с постоянной скоростью.
Дробный порядок
Разложение фосгена (COCl 2 ) на монооксид углерода и хлор имеет первый порядок по фосгену и порядка 0,5 по сравнению с хлором.
Смешанный заказ
Этот закон имеет нулевой порядок по отношению к гексацианоферрату (III) в начале реакции, когда его концентрация высока и рутениевый катализатор быстро регенерируется. Она изменяется в первом порядке по мере уменьшения концентрации, и регенерация катализатора становится определяющей скоростью.
Найдены законы скорости смешанного порядка с двумя членами в знаменателе для двух важных классов механизмов ː
Отрицательный заказ
Частичный порядок по данному веществу может быть отрицательным. Например, превращение озона (O 3 ) в кислород происходит по закону скорости в избытке кислорода. Это соответствует второму порядку по озону и (-1) порядку по дикислоду. v знак равно k [ О 3 ] 2 [ О 2 ] <\ Displaystyle v = к <\ гидроразрыва <[O_ <3>] ^ <2>> <[O_ <2>]>> \,>
Когда частичный порядок отрицательный, общий порядок обычно считается неопределенным. В предыдущем примере реакция не считается реакцией первого порядка, даже если сумма частичных порядков равна 2 + (-1) = 1, потому что уравнение скорости более сложное, чем уравнение простой реакции первого порядка.
Химическая кинетика
Описание
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Оглавление
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.1. Кинетическое уравнение химической реакции. Порядок реакции
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
1.2. Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
1.3. Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А → В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
После интегрирования выражения (II.7) получаем:
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
Рис. 2.3 Зависимость логарифма концентрации от времени для реакций первого порядка.
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
1.4. Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
После разделения переменных и интегрирования получаем:
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
Таким образом, для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка.
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
В этом случае для константы скорости получаем выражение
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
2) Избыток этилацетата:
В этих случаях мы имеем дело с так назывемой реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
1.5. Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
Зависимость концентрации от времени
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
Выражение для константы скорости
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.