Что называется полиморфизмом металлов
Механизм полиморфных превращений в металлах
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
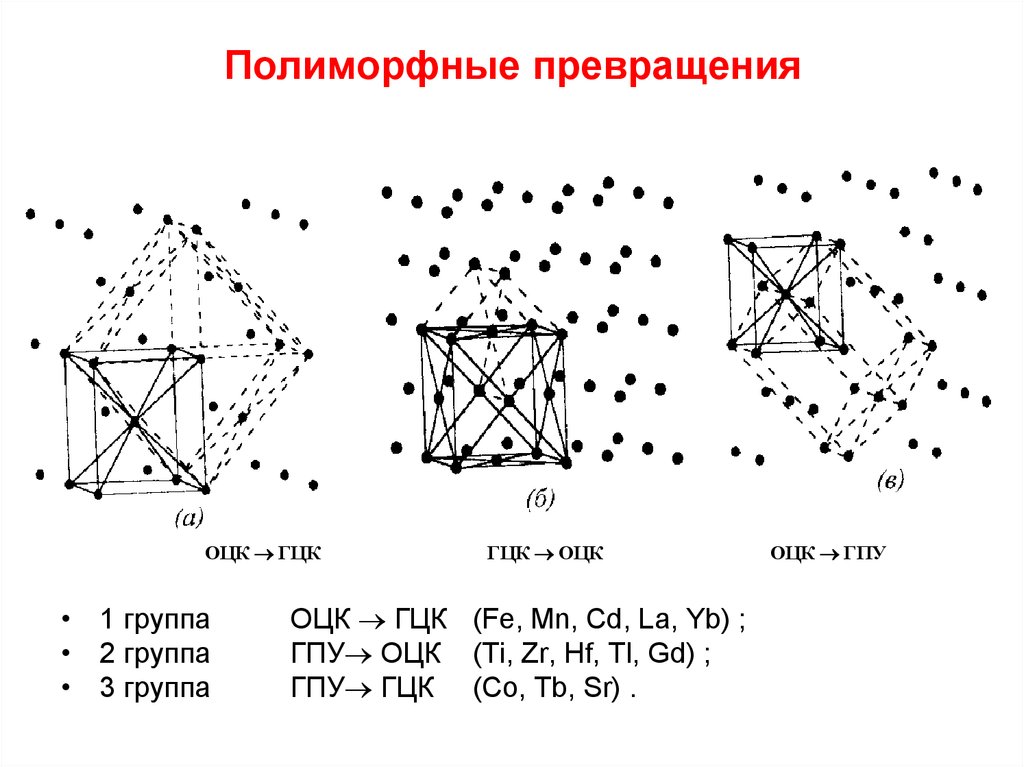
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.
Полиморфизм металлов



Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения.
Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д.
Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен.
Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру.
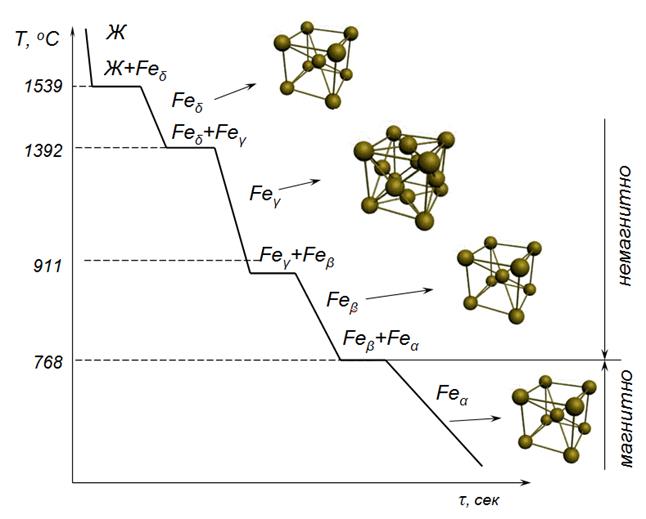
Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
 |  |
 |  |
ОЦК ГЦК ОЦК жидкость
768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа.
При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом.
В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца.
В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe.
При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав.
Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой.
3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ
И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Презентация по материаловедению на тему «Полиморфизм металлов»
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Описание презентации по отдельным слайдам:
Полиморфизм металлов Основы теории сплавов
Сущность полиморфизма Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать α, при более высокой – β, затем γ и т.д.
При полиморфном превращении кристаллы (зерна) новой полиморфной формы растут в результате неупорядоченных, взаимно связанных переходов атомов через границу фаз. Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и в результате этого граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу. Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов. Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации.
Полиморфизм железа Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки. Особенностью железа является тот факт, что при разных температурах оно имеет различную форму кристаллической решетки (полиморфизм). При температуре ниже 911 °С атомы располагаются в форме объемоцентрированной кубической решетки (ОЦК).
При нагревании выше 911 °С становится энергетически выгодной другая конфигурация кристаллической решетки — гранецентрированная кубическая (ГЦК). Благодаря этому в ГЦК-форме железо обретает способность к повышенному растворению в себе других элементов, в том числе углерода, атом которого относительно невелик.
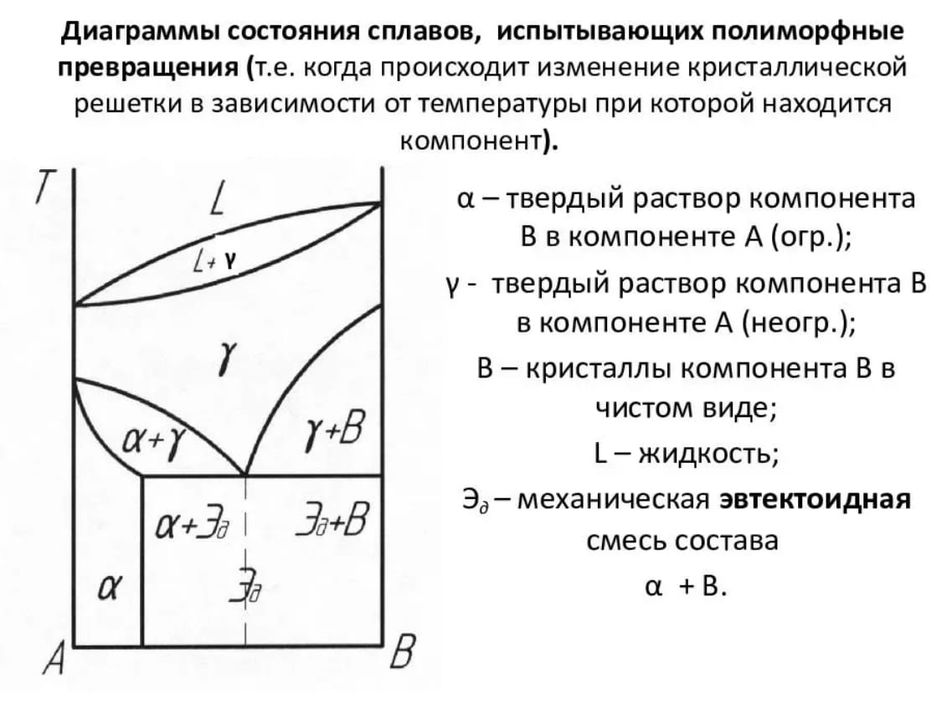
Виды сплавов Общие физические свойства По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов. Порошковые — прессованием смеси порошков с последующим спеканием при высокой температуре. Компонентами порошкового сплава могут быть не только порошки простых веществ, но и порошки химических соединений. Например, основными компонентами твёрдых сплавов являются карбиды вольфрама или титана. По способу получения заготовки (изделия) различают литейные (например, чугуны, силумины), деформируемые (например, стали) и порошковые сплавы.
— В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным). Твёрдый раствор является основой сплава. Фазовый состав гетерогенного сплава зависит от его химического состава. В сплаве могут присутствовать: твердые растворы внедрения, твердые растворы замещения, химических соединений и кристаллиты простых веществ. Основные классификационные сведения. Стали. Все соединения железа, содержащие до 2% углерода, называются сталями. Если в составе имеется хром, ванадий или молибден, то их называют легированными. Чугун. Если в сплаве железа содержится более 3-4% углерода, то он называется чугуном. Кроме того, его важным элементом является кремний.
Правило фаз Гиббса Фаза — это однородная часть системы или совокупность частей, имеющих одинаковый состав, строение и физико-химические свойства. Разные фазы всегда отделены друг от друга поверхностями раздела (межфазными поверхностями). Химический состав каждой фазы в сплаве можно выразить через концентрации компонентов. Состояние системы определяется температурой, давлением, концентрацией компонентов в разных фазах. При изменении этих факторов система переходит из одного состояния в другое, при этом совершаются фазовые превращения, при которых появляются новые фазы или исчезают старые. Возможность изменения равновесного состояния системы определяется вариантностью.
Курс повышения квалификации
Охрана труда
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
Курс профессиональной переподготовки
Охрана труда
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-555036
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В Оренбурге школьников переведут на дистанционное обучение с 9 декабря
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Более 50 российских школ перешли на дистанционку из-за коронавируса
Время чтения: 1 минута
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
До конца 2024 года в РФ построят около 1 300 школ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Полиморфизм (материаловедение)
СОДЕРЖАНИЕ
Примеры [ править ]
Многие соединения проявляют полиморфизм. Было заявлено, что «каждое соединение имеет разные полиморфные формы, и что, как правило, количество известных форм для данного соединения пропорционально времени и деньгам, затраченным на исследования этого соединения». [3] [4] [5]
Органические соединения [ править ]
Другие органические соединения
Неорганические соединения [ править ]
Факторы, влияющие на полиморфизм [ править ]
Полиморфы обладают разной стабильностью. Некоторые быстро преобразуются при комнатной (или любой) температуре. Большинство полиморфов органических молекул различаются по энергии решетки всего на несколько кДж / моль. Примерно 50% известных пар полиморфов различаются менее чем на 2 кДж / моль, а различия в стабильности более чем на 10 кДж / моль встречаются редко. [14]
Метастабильные полиморфы не всегда воспроизводимы, что приводит к случаям «исчезновения полиморфов». [3] [15] [16]
В фармацевтике [ править ]
Тематические исследования [ править ]
Противовирусный препарат ритонавир существует в виде двух полиморфов, которые сильно различаются по эффективности. Эти проблемы были решены путем изменения состава лекарства в гелевые капсулы и таблетки, а не в оригинальные капсулы. [19]
Порошок парацетамола имеет плохие компрессионные свойства, что затрудняет изготовление таблеток. Был обнаружен второй полиморф с более подходящими характеристиками сжатия. [ необходима цитата ]
Ацетат кортизона существует по крайней мере в пяти различных полиморфных модификациях, четыре из которых нестабильны в воде и переходят в стабильную форму.
Политипизм [ править ]
Таблица 1 : Некоторые политипы SiC. [24]
| Фаза | Структура | Обозначение Рамсделла | Последовательность укладки | Комментарий |
|---|---|---|---|---|
| α-SiC | шестиугольный | 2H | AB | Форма вюрцита |
| α-SiC | шестиугольный | 4H | ABCB | |
| α-SiC | шестиугольный | 6H | ABCACB | Самая устойчивая и распространенная форма |
| α-SiC | ромбоэдрический | 15R | ABCACBCABACABCB | |
| β-SiC | гранецентрированная кубическая | 3C | ABC | Форма сфалерита или цинковой обманки |
ZnS и CdI 2 также политипичны. [27] Было высказано предположение, что этот тип полиморфизма обусловлен кинетикой, при которой винтовые дислокации быстро воспроизводят частично неупорядоченные последовательности периодическим образом.
Теория [ править ]
Полиморфизм металлов



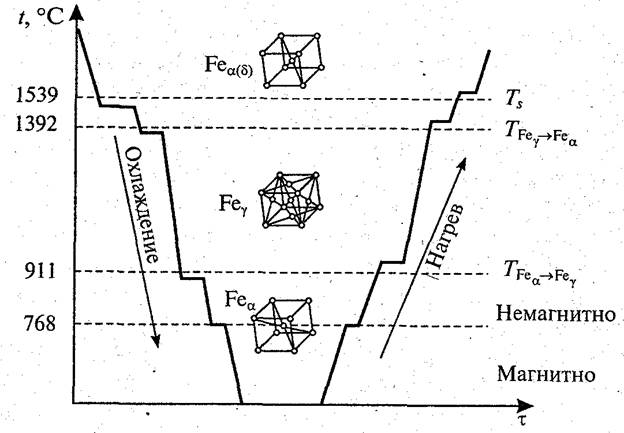
Процесс перехода из одной формы в другую определяется термодинамическим состоянием системы и объясняется тем, что, начиная с определенной температуры (температуры перекристаллизации), новая модификация обладает меньшим запасом энергии, чем предыдущая, и является энергетически более устойчивой. Температура, при которой осуществляется переход из одной модификации в другую, называется температурой полиморфного превращения. Новые полиморфные формы образуются в результате зарождения центров и роста кристаллов аналогично кристаллизации из жидкого состояния.
На рис. 1.6 приведены кривые охлаждения и нагрева железа, характеризующие его полиморфные превращения. При температурах ниже 911 °С и выше 1392 °С железо имеет объемно-центрированную кубическую решетку и обозначается Feα. При температурах 911. 1392 °С оно имеет гранецентрированную кубическую решетку и обозначается Feγ. Высокотемпературную модификацию Feα иногда обозначают Feβ.
Рис. 1.6. Кривые охлаждения и нагрева железа