Что называется пептидной связью
Пептидная связь
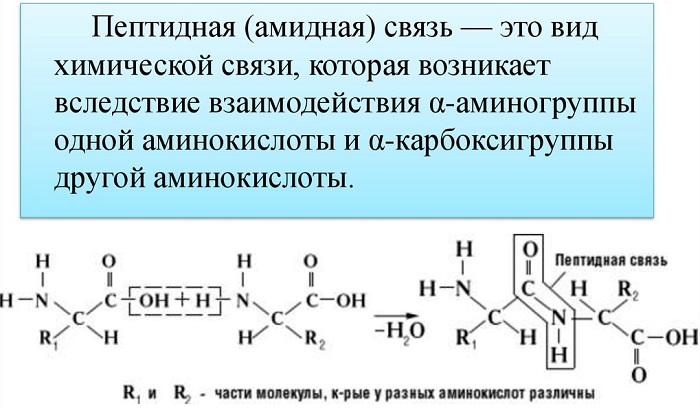
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
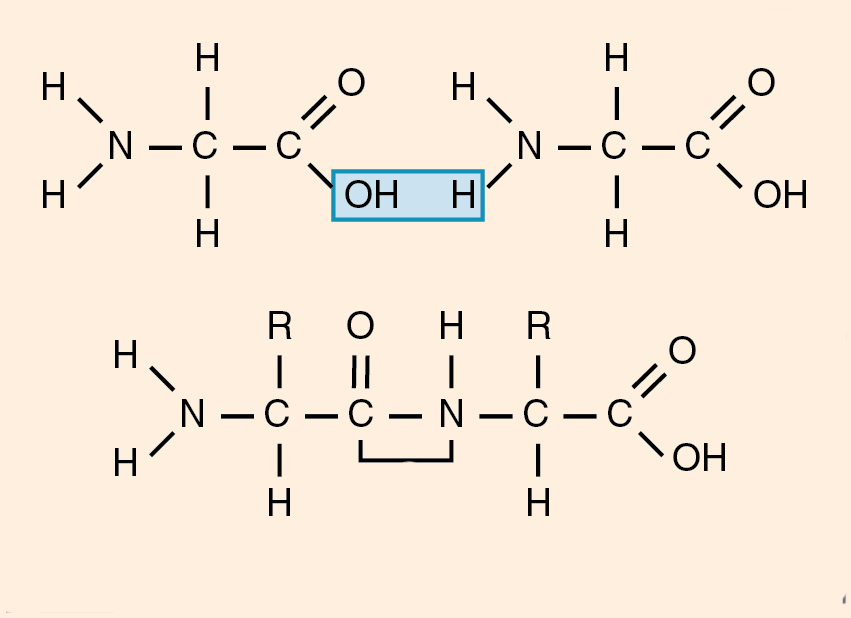
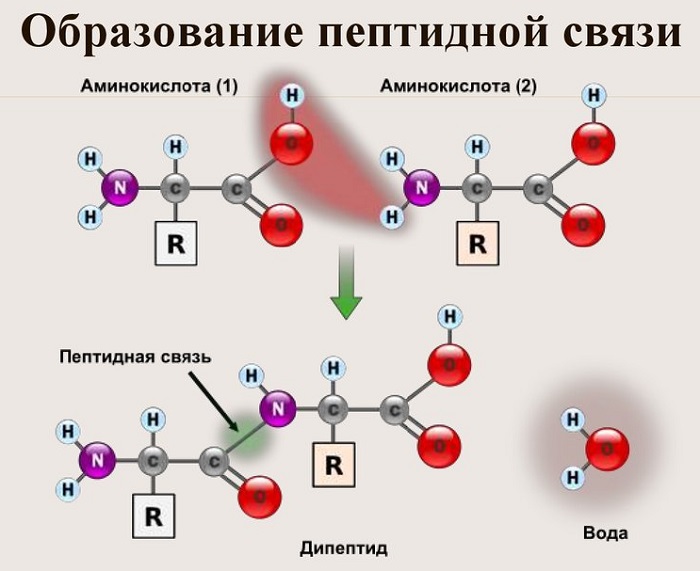
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
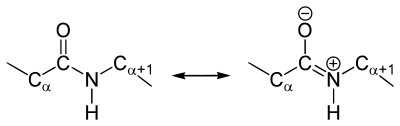
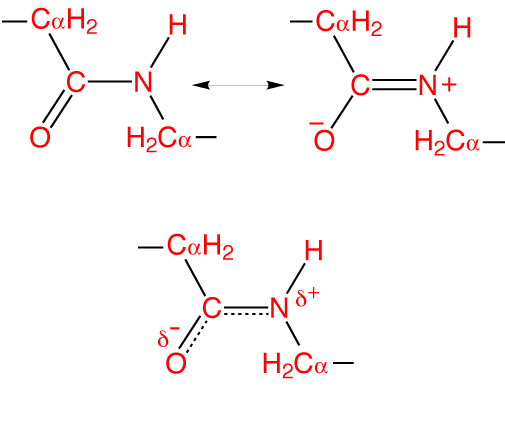
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
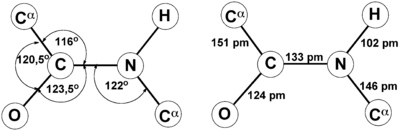
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Ссылки
Полезное
Смотреть что такое «Пептидная связь» в других словарях:
ПЕПТИДНАЯ СВЯЗЬ — ( CO NH ) химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков … Большой Энциклопедический словарь
пептидная связь — – амидная связь (NH CO ), образующаяся между амино и карбоксильной группами аминокислот в результате реакции дегидратации … Краткий словарь биохимических терминов
пептидная связь — Ковалентная связь между альфа аминогруппой одной аминокислоты и альфа карбоксильной группой другой аминокислоты [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN peptide bond … Справочник технического переводчика
Пептидная связь — * пептыдная сувязь * peptide bond ковалентная связь между двумя аминокислотами, возникающая в результате соединения α аминогруппы одной молекулы с α карбоксильной группой др. молекулы, с одновременным удалением воды … Генетика. Энциклопедический словарь
пептидная связь — ( СО NH ), химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков. * * * ПЕПТИДНАЯ СВЯЗЬ ПЕПТИДНАЯ СВЯЗЬ ( CO NH ), химическая связь, соединяющая аминогруппу одной аминокислоты… … Энциклопедический словарь
пептидная связь — peptide bond пептидная связь. Pазновидность амидной связи, образуется между α карбоксильной и α аминогруппой двух аминокислот. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО,… … Молекулярная биология и генетика. Толковый словарь.
пептидная связь — peptidinis ryšys statusas T sritis chemija apibrėžtis Amidinis ryšys, jungiantis elementariąsias grandis baltymo ar peptido molekulėje. atitikmenys: angl. peptide bond rus. пептидная связь … Chemijos terminų aiškinamasis žodynas
ПЕПТИДНАЯ СВЯЗЬ — Связь между аминной группой одной аминокислоты и карбоксильной группой другой … Толковый словарь по психологии
Пептидная связь — это основа первичной структуры белка. Характеристика и образование пептидной связи
Пептидная связь — это прочное соединение между фрагментами двух аминокислот, которое лежит в основе образования линейных структур белков и пептидов. В таких молекулах каждая аминокислота (за исключением концевых) соединяется с предыдущей и последующей.
В зависимости от количества звеньев пептидные связи могут создавать дипептиды (состоят из двух аминокислот), трипептиды (из трех), тетрапептиды, пентапептиды и т. д. Короткие цепочки (от 10 до 50 мономеров) называют олигопептидами, а длинные — полипептидами и белками (мол. масса более 10 тыс. Да).
Характеристика пептидной связи
Пептидная связь — это ковалентное химическое соединение между первым атомом углерода одной аминокислоты и атомом азота другой, возникающее в результате взаимодействия альфа-карбоксильной группы (COOH) с альфа-аминогруппой (NH2). При этом происходит нуклеофильное замещение OH-гидроксила на аминогруппу, от которой отделяется водород. В итоге образуется одинарная C-N связь и молекула воды.
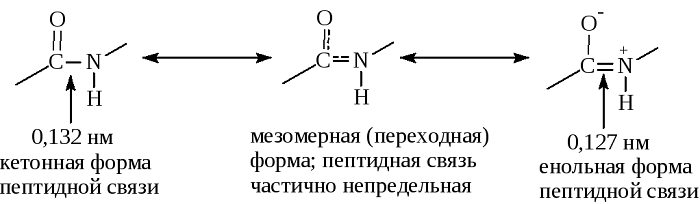
Так как во время реакции происходит потеря некоторых компонентов (ОН-группы и атома водорода), звенья пептида называют уже не аминокислотами, а аминокислотными остатками. Из-за того, что последние содержат по 2 атома углерода, в пептидной цепи происходит чередование С-С и C-N-связей, которые формируют пептидный остов. По бокам от него располагаются аминокислотные радикалы. Расстояние между атомами углерода и азота варьирует от 0,132 до 0,127 нм, что свидетельствует о неопределенной связи.
Пептидная связь — это очень прочный вид химического взаимодействия. При стандартных биохимических условиях, соответствующих клеточной среде, она не подвергается самостоятельному разрушению.
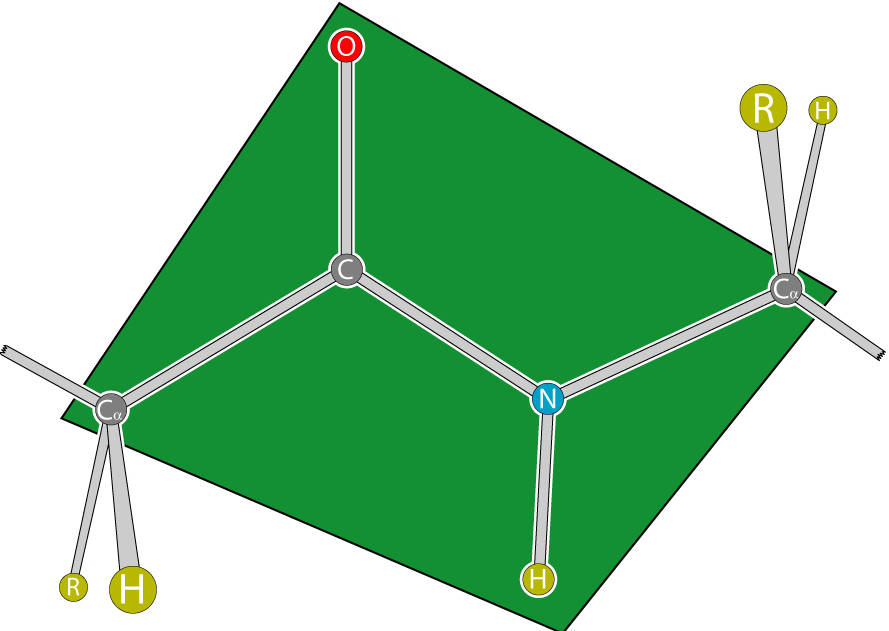
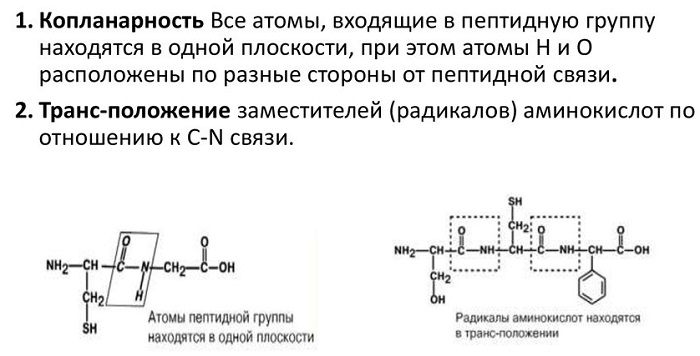
Для пептидной связи белков и пептидов характерно свойство копланарности, поскольку все атомы, участвующие в ее образовании (C, N, O и H), располагаются в одной плоскости. Это явление объясняется жесткостью (т. е. невозможностью вращения элементов вокруг связи), возникающей в результате резонансной стабилизации. В пределах аминокислотной цепи между плоскостями пептидных групп находятся α-углеродные атомы, связанные с радикалами.
Типы конфигурации
В зависимости от положения альфа-углеродных атомов относительно пептидной связи последняя может иметь 2 конфигурации:
Транс-форма характеризуется большей устойчивостью. Иногда конфигурации характеризуют по расположению радикалов, что не меняет сути, поскольку они связаны с альфа-углеродными атомами.
Явление резонанса
Особенность пептидной связи заключается в том, что она на 40% двойная и может находится в трех формах:
Формирование пептидной связи
Формирование пептидной связи — это типичная реакция поликонденсации, которая термодинамически невыгодна. В естественных условиях равновесие смещается в сторону свободных аминокислот, поэтому для осуществления синтеза требуется катализатор, активирующий или модифицирующий карбоксильную группу для более легкого ухода гидроксильной.
В живой клетке образование пептидной связи происходит в белоксинтезирующем центре, где в роли катализатора выступают специфические ферменты, работающие с затратой энергии макроэргических связей.
Пептидная связь — характеристика, свойства и строение
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами — строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
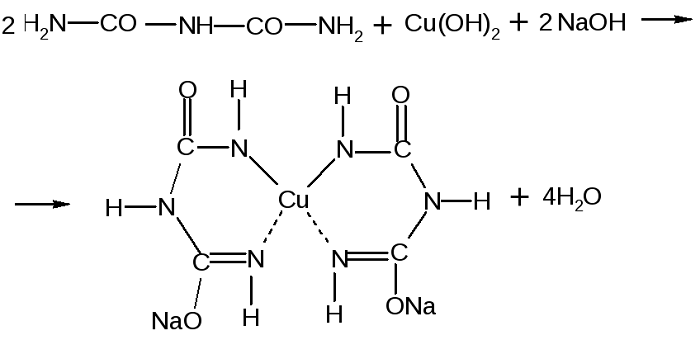
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.
В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Пептидный связь
Пептидные связи чаще всего встречаются в природе в составе пептидов и белков, они соединяют между собой остатки аминокислот. Пепдидни связи также является основой пептидной нуклеиновой кислоты (ПНА). Полиамиды, такие как нейлон и арамид, — синтетические молекулы (полимеры), которые также содержат пептидные связи.
Образование пептидной связи
Пептидный связь образуется в результате реакции конденсации между карбоксильной и аминогруппой. При этом аминогруппа играет роль нуклеофила, замещая гидроксил карбоксильной группы:
Реакция конденсации, в результате которой происходит формирование пептидной связи, требует вклада свободной энергии. Как в химическом синтезе, так и в биосинтезе белков, это обеспечивается активацией карбоксильных групп, в результате чего отхождения гироксильнои группы облегчается.
Резонансные формы пептидной группы
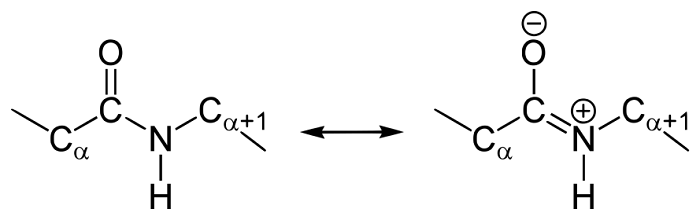
В 1930-1940-х годах Лайнус Полинг и Роберт Кори проводили рентгеноструктурный анализ нескольких аминокислот и дипептидов. Им удалось установить, что пептидная группа жесткую планарную структуру, шесть атомов лежат в одной плоскости: α-атом углерода и C = O группа первой аминокислоты и N-H группа и α-атом углерода второй аминокислоты. Полинг объяснил это существованием двух резонансных форм пептидной группы, на что указывала меньше длина C-N связи в пептидной группе (133 пм), чем того же связи в простых аминов (149 пм). Итак вследствие частичного разделения электронной пары между карбонильным кислорода и амидной азотом, пептидный связь на 40% имеет свойства двойного:
В пептидных группе вращения вокруг C-N связи не происходит вследствие его частичной двойственности. Вращение разрешено только вокруг связей С-С α и N-С α. В результате остов пептида может быть представлен как серия полей, разделенных совместными точками вращения (С α атомы). Такая структура ограничивает количество возможных конформаций пептидных цепей.
Кроме того, эффект резонанса стабилизирует группу добавляя энергию примерно 84 ккал / моль, что делает ее менее химически активным, чем много подобных групп (например эфиров). Эта группа незаряженная за физиологических значений pH, но вследствие существования двух резонансных форм карбонильный кислород несет частичный отрицательный заряд, а амидный азот — частичный положительный. Таким образом возникает диполь с дипольным моментом, около 3,5 Дебай (0,7 электрон-ангстрем). Эти дипольные моменты могут ориентироваться параллельно в определенных типах вторичной структуры (например α-спирали).
Стереоизомерия
Возможные конфигурации
Возможны конформации
Конформация пептида определяется тремя торсионными углами, отражающие вращения вокруг трех последовательных связей в пептидной остове: ψ (пси) — вокруг C α1-С, ω (омега) — вокруг С-N, и φ (фи) — вокруг N- С α2.
Поскольку связи N-С α2 и C α1-С по обе стороны от пептидной являются обычными одинарными связями, вращения вокруг них неограничен, в результате чего пептидные цепи могут принимать различные пространственные конформации. Однако возможны не все комбинации торсионных углов, при некоторых из них происходит пространственное столкновения атомов. Допустимые значения визуализируют на двухмерном графике, называется диаграммой Рамахандрана.
Методы определения
Пептидная группа имеет характерную полосу поглощения в диапазоне 190-230 нм.
Качественной реакцией на пептидный связь является биуретовая реакция с концентрированным раствором меди (II) сульфата (CuSO 4) в щелочной среде. Продуктом является комплекс сине-фиолетовой окраски между атомом меди и амтомамы азота.
Биуретовая реакция может быть использована для колориметрического измерения концентрации белков и пептидов, однако из-за низкой чувствительности этого метода значительно чаще используют его модификации. Одной из таких модификаций является метод Лоури, в котором биуретовая реакция сочетается с окислением остатков ароматических аминокислот.