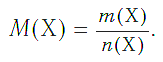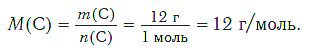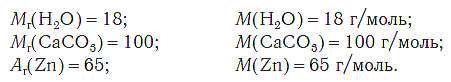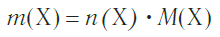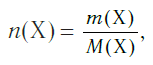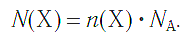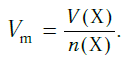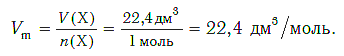Что называется молярным объемом
Молярный объём
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×10 23 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т. д.
Значения молярного объёма химических элементов
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A |
| Период | ||||||||||||||||||
| 1 | H 14,1 | He 31,8 | ||||||||||||||||
| 2 | Li 13,1 | Be 5 | B 4,6 | C 5,3 | N 17,3 | O 14 | F 17,1 | Ne 16,8 | ||||||||||
| 3 | Na 23,7 | Mg 14 | Al 10 | Si 12,1 | P 17 | S 15,5 | Cl 18,7 | Ar 24,2 | ||||||||||
| 4 | K 45,3 | Ca 29,9 | Sc 15 | Ti 10,6 | V 8,35 | Cr 7,23 | Mn 7,39 | Fe 7,1 | Co 6,7 | Ni 6,6 | Cu 7,1 | Zn 9,2 | Ga 11,8 | Ge 13,6 | As 13,1 | Se 16,5 | Br 23,5 | Kr 32,2 |
| 5 | Rb 55,9 | Sr 33,7 | Y 19,8 | Zr 14,1 | Nb 10,8 | Mo 9,4 | Tc 8,5 | Ru 8,3 | Rh 8,3 | Pd 8,9 | Ag 10,3 | Cd 13,1 | In 15,7 | Sn 16,3 | Sb 18,4 | Te 20,5 | I 25,7 | Xe 42,9 |
| 6 | Cs 70 | Ba 39 | * | Hf 13,6 | Ta 10,9 | W 9,53 | Re 8,85 | Os 8,43 | Ir 8,54 | Pt 9,1 | Au 10,2 | Hg 14,8 | Tl 17,2 | Pb 18,3 | Bi 21,3 | Po 22,7 | At н/д | Rn н/д |
| 7 | Fr н/д | Ra 45 | ** | Rf н/д | Db н/д | Sg н/д | Bh н/д | Hs н/д | Mt н/д | Ds н/д | Rg н/д | Cn н/д | Uut н/д | Fl н/д | Uup н/д | Lv н/д | Uus н/д | Uuo н/д |
| Лантаноиды | * | La 22,5 | Ce 21 | Pr 20,8 | Nd 20,6 | Pm 19,96 | Sm 19,9 | Eu 28,9 | Gd 19,9 | Tb 19,2 | Dy 19 | Ho 18,7 | Er 18,4 | Tm 18,1 | Yb 24,8 | Lu 17,8 | ||
| Актиноиды | ** | Ac 22,54 | Th 19,8 | Pa 15 | U 12,5 | Np 21,1 | Pu 12,12 | Am 20,8 | Cm 18,28 | Bk н/д | Cf н/д | Es н/д | Fm н/д | Md н/д | No н/д | Lr н/д |
См. также
Примечания
Полезное
Смотреть что такое «Молярный объём» в других словарях:
молярный объём — molio tūris statusas T sritis fizika atitikmenys: angl. gram molecular volume; molal volume; molar volume vok. Molvolumen, n rus. мольный объём, m; молярный объём, m pranc. volume molaire, m … Fizikos terminų žodynas
молярный объём газа — dujų molio tūris statusas T sritis fizika atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объём газа, m; молярный объём газа, m pranc. volume molaire de gaz, m … Fizikos terminų žodynas
Объём — У этого термина существуют и другие значения, см. Объём (значения). Объём Размерность L3 Единицы измерения СИ … Википедия
Молярный объем — Молярный объём объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул. Согласно закону Авогадро, для любого газа при нормальных условиях эта величина имеет универсальное … Википедия
мольный объём — molio tūris statusas T sritis fizika atitikmenys: angl. gram molecular volume; molal volume; molar volume vok. Molvolumen, n rus. мольный объём, m; молярный объём, m pranc. volume molaire, m … Fizikos terminų žodynas
мольный объём газа — dujų molio tūris statusas T sritis fizika atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объём газа, m; молярный объём газа, m pranc. volume molaire de gaz, m … Fizikos terminų žodynas
Число Авогадро — Число Авогадро, константа Авогадро физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 … Википедия
Уравнение Ван-дер-Ваальса — Уравнение состояния Стат … Википедия
Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
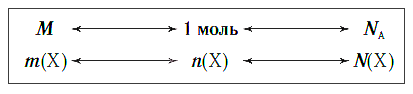
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Определение молярного объема при химических реакциях
Молярный объем — что это такое в химии
Молярный объем V m — является отношением объема вещества к его количеству, численно равен объему одного моля вещества.
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
Молярный объем вычисляют по формуле:
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
Молярный объем какого-либо газа при нормальных условиях:
Молярный объем смеси
Молярный объем смеси:
Молярный объем газов
Закон Авогадро: одинаковые количества газов при одинаковых условиях занимают одинаковый объем.
Молярный объем идеального газа вычисляют с помощью формулы, которая является выводом из уравнения состояния идеального газа.
Молярный объем идеального газа:
где T — является термодинамической температурой;
R — универсальная газовая постоянная.
Молярный объем кристаллов
Объем V я элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Значения молярного объема химических элементов
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V :
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
Определение объема веществ при химических реакциях
Перед тем, как приступить к расчетам объема веществ, следует ввести понятие плотности. Данный показатель определяется отношением массы вещества к его объему. Плотность измеряют в к г / м 3 (или г/л, г/мл). В случае газообразных веществ плотность принимает очень маленькие значения. Упростить расчеты химических реакций можно, если рассматривать отношение плотностей газов.
Относительной плотностью газа В по газу А называют величину, равную отношению плотностей рассматриваемых веществ или отношению молярных масс этих газов.
Данный параметр обозначают D A ( B ) и определяют по формуле:
В связи с тем, что в расчете относительной плотности используют величины одинаковой размерности, данный параметр является безразмерной величиной. Определить относительную плотность газообразных веществ по некому газу можно с помощью отношения молярных масс этих газов. Например, относительная плотность кислорода по водороду составляет:
Согласно закону Авогадро, в равных объемах различных газов, которые существуют при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Данная гипотеза была представлена в 1811 году в Турине профессором физики Амедео Авогадро.
Подтверждение теория нашла во множестве экспериментальных опытах. Закон получил название закона Авогадро и стал в дальнейшем количественной основой современной химии. Закон Авогадро в точности реализуем в случае идеального газа. С увеличением разреженности газообразного вещества повышается точность расчетов по этому закону применительно к данному реальному газу.
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых условиях занимает одинаковый объем.
Исходя из закона Авогадро, одинаковое число молекул какого-либо газа занимает при одинаковых условиях один и тот же объем. Наряду с тем, 1 моль какого-то вещества включает в себя (согласно определению) одинаковое количество частиц (к примеру, молекул). Таким образом, при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Если условия соответствуют нормальным, то есть температура равна 0 °C (273,15 К), и давление составляет 101,325 кПа, объем 1 моль газа соответствует 22,413 962(13) л. Данная физическая константа является молярным объемом идеального газа и обозначается Vm.
Вычислить молярный объем при температуре и давлении, отличных от нормальных условий, можно с помощью уравнения Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
Закон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
Математическое выражение закона Гей-Люссака:
В том случае, когда известно состояние газа при постоянном давлении и двух разных температурах, закон допустимо записывать таким образом:
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
2 H 2 + O 2 = 2 H 2 O
V ( Н 2 ) : V ( N 2 ) : V ( N H 3 ) = 3 : 2 : 1
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
n — количество газа.
Выразить молярный объем газов можно в л/моль:
В данной таблице использованы следующие обозначения:
Урок №40. Закон Авогадро. Молярный объем газов
итальянский учёный-химик, первооткрыватель фундаментального физико-химического закона, названного его именем.
Закон Авогадро : в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро :
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 10 23 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается V m
Молярный объём V m – это постоянная величина для веществ – газов при нормальных условиях (н.у.) V m = 22,4 л/моль
Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
ν = V/V m = N/N a = m/M
M = ρ‧V m
Молярный объем
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Согласно закону Авогадро, для любого газа при нормальных условиях эта величина имеет универсальное значение 22,413 996(39) л/моль [1]. Поэтому вся справочная информация о молярном объёме химических элементов относится к их твёрдой фазе, если не оговорено противное.
Смотреть что такое «Молярный объем» в других словарях:
МОЛЯРНЫЙ ОБЪЕМ — (мольный объем), объем, занимаемый одним МОЛЕМ вещества. Он примерно одинаков для всех газов и при СТАНДАРТНЫХ ДАВЛЕНИИ и ТЕМПЕРАТУРЕ составляет 22,414 литра … Научно-технический энциклопедический словарь
молярный объем — molio tūris statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. molar volume vok. molares Volumen, n; Molvolumen, n rus. молярный объем, m pranc. volume molaire, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярный объем — molinis tūris statusas T sritis chemija apibrėžtis Medžiagos 1 molio užimamas tūris. atitikmenys: angl. molar volume rus. молярный объем … Chemijos terminų aiškinamasis žodynas
молярный объем газа — dujų molio tūris statusas T sritis chemija apibrėžtis Dujų molio užimamas tūris 273,15 K temperatūroje ir 101,325 kPa slėgyje (молярный объем газа 22,4 l). atitikmenys: angl. gas molar volume rus. мольный объем газа; молярный объем газа … Chemijos terminų aiškinamasis žodynas
молярный объем газа — dujų molio tūris statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų molio užimamas tūris 273,15 K temperatūroje ir 101,325 kPa slėgyje (apie 22,4 l). atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объем… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
мольный объем газа — dujų molio tūris statusas T sritis chemija apibrėžtis Dujų molio užimamas tūris 273,15 K temperatūroje ir 101,325 kPa slėgyje (мольный объем газа 22,4 l). atitikmenys: angl. gas molar volume rus. мольный объем газа; молярный объем газа … Chemijos terminų aiškinamasis žodynas
ГРАММ-МОЛЕКУЛЯРНЫЙ ОБЪЕМ — ГРАММ МОЛЕКУЛЯРНЫЙ ОБЪЕМ, см. МОЛЯРНЫЙ ОБЪЕМ … Научно-технический энциклопедический словарь
мольный объем газа — dujų molio tūris statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų molio užimamas tūris 273,15 K temperatūroje ir 101,325 kPa slėgyje (apie 22,4 l). atitikmenys: angl. gas molar volume vok. molares Gasvolumen, n rus. мольный объем… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Едини́цы физи́ческих величи́н — конкретные физические величины, условно принятые за единицы физических величин. Под физической величиной понимают характеристику физического объекта, общую для множества объектов в качественном отношении (например, длина, масса, мощность) и… … Медицинская энциклопедия
ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ВЕЛИЧИНЫ, — термодинамич. величины, к рые используют для описания концентрац. зависимостей св в р ров. Пусть М нек рая экстенсивная ф ция состояния системы из hкомпонентов, т. е. св во, зависящее от массы системы (объем, внутр. энергия, энтальпия, энтропия,… … Химическая энциклопедия