Что называется массовым числом атома
Массовое число: что это такое и как получить (с примерами)
Содержание:
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 12 6С или углерод-12. А кроме углерода-14 есть 13 6C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
— Пример 1
В чем разница между 13 7 N и 14 7 N?
Ответить
— Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 201 80 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
Почему некоторые люди не могут извиниться
8 типов насилия при свидании и их характеристики
Разница между массовым числом и атомной массой
И массовое число, и атомная масса очень тесно связаны друг с другом и указывают на вес элементов. Они отличаются тем, как они определены. главное отличие между массовым числом и атомной массой являет
Содержание:
И массовое число, и атомная масса очень тесно связаны друг с другом и указывают на вес элементов. Они отличаются тем, как они определены. главное отличие между массовым числом и атомной массой является то, чтомассовое число касается отдельных атомов, учитываемых отдельнов то время как атомная масса имеет дело со средневзвешенным элементом, включая его изотопы.
Что такое массовое число
Как упомянуто выше, массовое число связано с весом одного рассматриваемого атома. Атом состоит из ядра и орбиталей вокруг него. Эти орбитали существуют в свободном пространстве и вмещают электроны. Однако вес электронов ничтожно мал по сравнению с ядерным ядром. Следовательно, вес электронов не влияет на вес атома / элемента. Ядро состоит из протонов и нейтронов. И нейтроны, и протоны имеют практически одинаковую массу, но изменяются очень незначительно. Протоны заряжены положительно, а нейтроны заряжены нейтрально. Следовательно, ядро остается положительно заряженным. Однако атом в целом считается нейтральным, так как положительный заряд протонов нейтрализуется отрицательным зарядом электронов. Количество электронов в атоме равно числу протонов.
Элементы в периодической таблице расположены в соответствии с возрастающим массовым числом. Массовое число символически представлено в верхнем левом углу, когда элемент помечен. Массовое число отличается от атомного номера, поскольку оно представляет только количество протонов или электронов в элементе. А атомный номер обычно пишется в нижнем левом углу элемента.
Что такое атомная масса
Этот термин очень тесно связан с массовым числом. На самом деле это буквально означает то же самое, однако в этом случае также учитываются изотопные формы каждого элемента. Элементы могут существовать в различных формах в природе. Эти различные формы обычно известны как изотопы, и они имеют ту же идентичность, что и наиболее распространенная / стабильная форма элемента. Следовательно, изотопы имеют одинаковый атомный номер, но имеют разные массовые числа. Можно сделать вывод, что изотопы несут одинаковое количество протонов и электронов; это только количество нейтронов, которые отличаются. Следовательно, между ними есть вес.
Принимая во внимание каждую изотопную форму, масса элементарной формы может быть выражена в виде среднего значения, где отдельные массы каждой изотопной формы усредняются. Это называется «атомная масса» элемента. Поэтому атомная масса имеет почти такое же числовое значение, что и массовое число, только с изменением нескольких десятичных значений. Каждый номер используется для удобства в зависимости от контекста использования.
Разница между массовым числом и атомной массой
Определение
Массовое число это вес ядра атома.
Атомная масса средний вес элемента формы.
Условное обозначение
Массовое число написано в верхнем левом углу элементарного выражения.
Атомная масса не обозначено как таковое.
Рассмотрение изотопов
Массовое число не учитывает существование изотопов, так как это связано с весом каждого атома в отдельности.
Атомная масса относится к средней массе элементарной формы и, следовательно, учитывает наличие изотопов и их содержание.
Численная величина
Массовое число это упрощенное число, обычно без десятичных разрядов.
Атомная масса имеет дело с несколькими десятичными значениями, поскольку это средневзвешенное значение.
Простота использования
Массовое число легче использовать для общих целей.
Атомная масса полезно при выполнении конкретных расчетов.
Разница между атомным номером и массовым числом
Атомы состоят из электронов, протонов и нейтронов. Протоны и нейтроны вместе составляют ядро атома. Измеряя массу атома, мы фактически измеряем массу ядра. Это потому, что масса электрона ничтожна
Содержание:
Атомы состоят из электронов, протонов и нейтронов. Протоны и нейтроны вместе составляют ядро атома. Измеряя массу атома, мы фактически измеряем массу ядра. Это потому, что масса электрона ничтожна по сравнению с протоном или нейтроном. Атомный номер и массовое число атома являются двумя важными терминами, потому что эти термины предоставляют нам подробную информацию о количестве протонов и количестве нейтронов, присутствующих в атоме. главное отличие между атомным номером и массовым числом является то, что атомный номер указывает число протонов, присутствующих в атоме, тогда как массовое число указывает сумму количества протонов и числа нейтронов, присутствующих в атоме.
Ключевые области покрыты
1. Что такое атомный номер
— Определение, объяснение с примерами
2. Что такое массовое число
— Определение, объяснение с примерами
3. В чем разница между атомным номером и массовым числом
— Сравнение основных различий
Ключевые слова: атом, атомный номер, электрон, изотоп, массовое число, нейтрон, ядро, протон
Что такое атомный номер
Рисунок 1: Атомный номер указан перед химическим символом в нижнем регистре.
Протоны являются положительно заряженными субатомными частицами. Следовательно, атомный номер указывает на общий положительный заряд ядра. В нейтральном атоме число протонов равно числу электронов, потому что для того, чтобы быть нейтральным, все положительные заряды должны быть нейтрализованы от отрицательных зарядов электронов. Следовательно, атомный номер равен числу электронов, присутствующих в нейтральном атоме.
Атомный номер элемента может быть изменен, если этот элемент радиоактивен. Это потому, что, когда некоторые элементы подвергаются радиоактивности, протоны превращаются в разные субатомные частицы, или нейтроны могут превращаться в протоны. В любом случае, это меняет количество протонов, присутствующих в атоме. Это превращается в другой элемент (изменение атомного номера меняет элемент).
Что такое массовое число
Поскольку число протонов и число нейтронов в стабильных атомах равны, массовое число атомов примерно равно удвоенному атомному номеру. Однако в изотопах массовое число может или не может быть равно удвоенному атомному номеру. Это потому, что изотопы имеют одинаковое количество протонов, но разное количество нейтронов. Поэтому у них массовое число отличается от ожидаемого значения.
Рисунок 2: Основные изотопы водорода и их массовые числа.
Кроме того, есть некоторые вещества, называемые изобарами. Это атомы разных элементов, которые имеют одинаковое массовое число, но у них разные атомные номера. Например, хлор-37 и аргон-37 имеют одинаковое массовое число. Следовательно, они изобары.
Поскольку атомы часто подвергаются альфа-распаду, который удаляет два протона и два нейтрона из радиоактивного ядра, массовое число элементов может соответственно измениться. Затем массовое число меняется на 4 единицы.
Разница между атомным номером и массовым числом
Определение
Массовое число: Массовое число является суммой количества протонов и нейтронов атома.
Количество нейтронов
Атомный номер: Количество нейтронов не влияет на атомный номер атома.
Массовое число: Количество нейтронов не влияет на массовое число атома.
Изотопы
Атомный номер: Изотопы имеют одинаковый атомный номер.
Массовое число: Изотопы имеют разные массовые числа.
Изобары
Атомный номер: Изобары не могут иметь одинаковый атомный номер.
Массовое число: Изобары имеют одинаковое массовое число.
Значение
Атомный номер: Атомный номер всегда меньше, чем массовое число.
Массовое число: Массовое число всегда больше значения, чем атомный номер.
Заключение
Атомный номер и массовое число являются фундаментальными деталями об атоме. Атомный номер является уникальным значением для определенного химического элемента. Но могут быть элементы, имеющие одинаковое массовое число. Они называются изобарами. А также могут быть атомы, имеющие один и тот же атомный номер с разными массовыми числами, но принадлежащие к одному и тому же элементу. Они называются изотопами. Основное различие между атомным номером и массовым числом состоит в том, что атомный номер указывает число протонов, присутствующих в атоме, тогда как массовое число указывает сумму количества протонов и числа нейтронов, присутствующих в атоме.
Рекомендации:
1. «АТОМНЫЕ НОМЕРА И МАССОВЫЕ НОМЕРА». Ресурсный центр NDT,
Что называется массовым числом атома
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
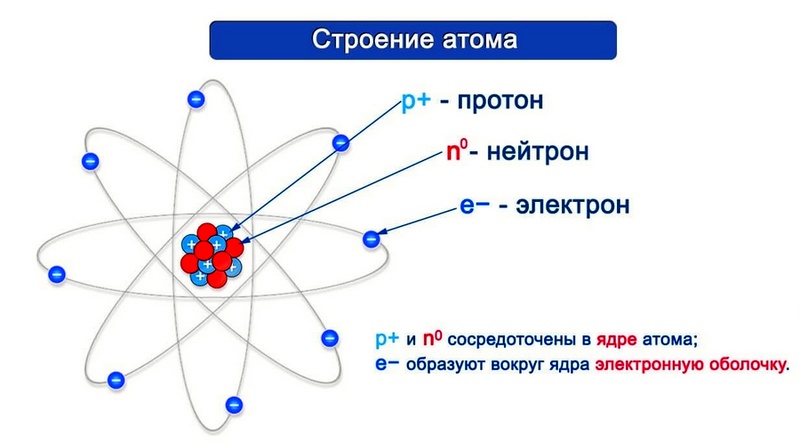
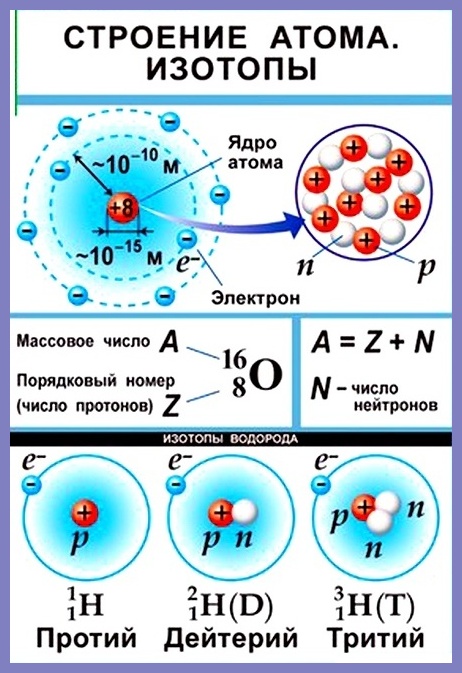
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
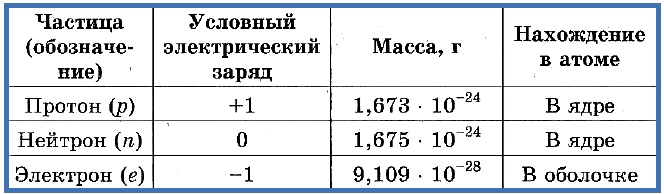
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
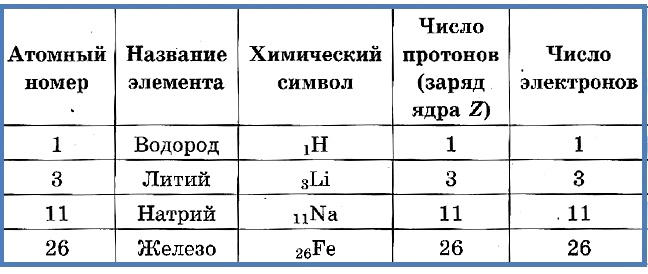
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
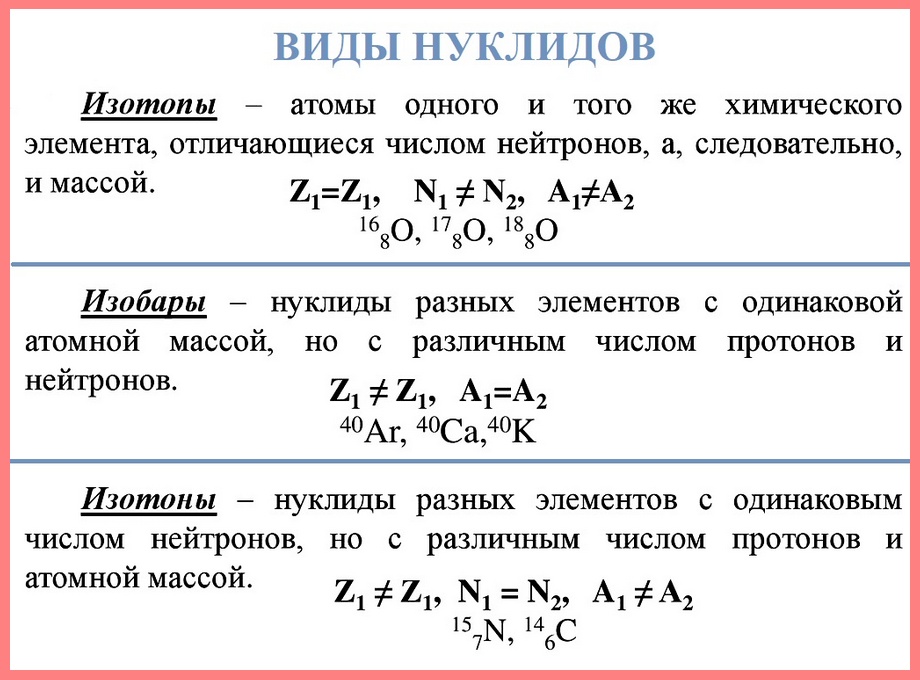
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Таблица 3. «Обозначение и название ионов»
Конспект урока по химии «Строение атома».
Что называется массовым числом атома
1. Как называются протоны и нейтроны вместе?
Протоны и нейтроны называются нуклонами.
То есть атомные ядра состоят из нуклонов.
В 1932 году Д.Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную модель строения ядер.
2. Что называется массовым числом и какой буквой оно обозначается?
Массовым числом называется общее число нуклонов в ядре атома.
Массовое число численно равно массе ядра, выраженной в атомных единицах массы и округлённой до целых чисел.
Массовое число обозначается буквой А.
3. Что можно сказать о числовом значении массы атома (в а.е.м.) и его массовом числе?
Массовое число равно с точностью до целых (поскольку масса каждого нуклона примерно равна 1 а.е.м.) числу атомных единиц массы, содержащихся в массе атома.
2. Что называется зарядовым числом и какой буквой оно обозначается?
Зарядовым числом называется число протонов в ядре.
Зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах.
(Заряд каждого протона равен элементарному электрическому заряду. )
Зарядовое число обозначается буквой Z.
Для каждого химического элемента зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделеева.
4. Как называется и какой буквой обозначается число протонов в ядре?
Число протонов в атоме обозначается буквой Z и называется зарядовым числом.
5. Что можно сказать о зарядовом числе, заряде ядра (выраженном в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента?
Зарядовое число равно заряду ядра, выраженному в элементарных электрических зарядах.
Зарядовое число атома равно его порядковому номеру в таблице Менделеева.
6. Как в общем виде принято обозначать ядро любого химического элемента?
Ядро любого химического элемента в общем виде обозначается 
7. Какой буквой обозначают число нейтронов в ядре?
Число нейтронов в ядре обозначают буквой N.
8. Какой формулой связаны между собой массовое число, зарядовое число и число нейтронов в ядре?
A = Z + N
9. Как с точки зрения протонно нейтронной модели ядра объясняется существование ядер с одинаковыми зарядами и различными массами?
У одного и того же химического элемента встречаются атомы с различными по массе ядрами.
Такие атомы называются изотопами.
Атомы изотопов имеют одинаковый заряд и поэтому один и тот же порядковый номер в таблице Д. И. Менделеева.
Изотопы — это разновидности одного химического элемента, различающиеся по массе атомных ядер
Ядра изотопов содержат одинаковое число протонов, но различное число нейтронов.