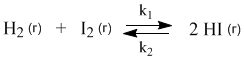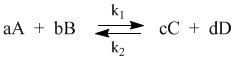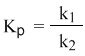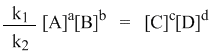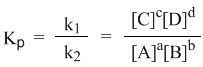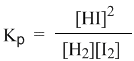Что называется химическим равновесием почему химическое равновесие называют динамическим
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
Что называется химическим равновесием почему химическое равновесие называют динамическим
§9.7 Химическое равновесие. Принцип Ле Шателье.
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:
У этой равновесной системы есть замечательное свойство: ее состав не зависит от способа получения. Можно нагревать смесь газообразных водорода и йода, а можно взять для опыта чистый HI – результат будет одним и тем же: образуется равновесная смесь трех веществ (H2, I2, HI) одного и того же состава. Для внешнего наблюдателя в такой системе химические превращения не происходят, но на самом деле здесь постоянно идут прямая и обратная реакции. Рассмотрим эту систему с точки зрения химической кинетики.
Допустим, для опыта взяли газообразные водород и йод. В первый момент времени еще нет HI, поэтому идет только прямая реакция, скорость которой (vпр) выражается кинетическим уравнением:
Здесь k1 – константа скорости прямой реакции. Постепенно в смеси накапливается продукт реакции HI. Но в этих же условиях йодистый водород с заметной скоростью разлагается на исходные вещества: H2 и I2. В данном конкретном случае кинетические уравнения соответствуют химическим уравнениям прямого и обратного процессов. Скорость обратной реакции (vобр) выражается кинетическим уравнением с константой скорости k2:
Когда йодистого водорода образуется уже достаточно много (т.е. когда его концентрация достигнет определенной величины), скорости прямой и обратной реакции выравниваются:
В этом случае говорят, что наступило химическое равновесие. Количество содержащихся в равновесной системе веществ H2, I2 и HI теперь не меняется со временем, если нет внешних воздействий на систему.
Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Химическое равновесие носит динамический характер. Например, в приведенной реакции HI постоянно образуется и расходуется. Если добавить в такую равновесную смесь радиоактивный йод-131, то он быстро распределяется между молекулами I2 и HI. Это говорит о постоянном переходе атомов йода из исходного вещества в продукт реакции и обратно.
Можно ли изменить состояние химического равновесия? Иными словами – можно ли сдвинуть равновесие в сторону образования продуктов или в сторону образования исходных веществ?
Ответ на этот вопрос подсказывают кинетические уравнения прямой и обратной реакций. Если добавлять в равновесную систему извне «лишний» водород, то возрастет величина молярной концентрации [H2] в кинетическом уравнении прямой реакции. Следовательно, увеличится скорость прямой реакции vпр, а скорость обратной реакции vобр останется неизменной. В итоге израсходуется какая-то часть добавленного водорода, а равновесие сместится вправо, т.е. в сторону образования продукта реакции. Такой же эффект даст и введение в систему дополнительных порций I2.
Мы можем заметить важную закономерность: при попытке воздействовать на равновесную систему она «сопротивляется» такому воздействию. Действительно, добавление в равновесную систему H2 или I2 приводит к увеличению их расходования в прямой реакции. В итоге H2 или I2 в системе окажется меньше, чем было добавлено, зато возрастет количество HI. Наоборот, добавление HI приводит к более быстрому его расходованию в обратной реакции. Такая способность равновесных систем «сопротивляться» внешним воздействиям носит общий характер и известна под названием принципа Ле Шателье:
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
** Анри Луи Ле Шателье (1850-1936) – французский физикохимик, Президент Французского химического общества, член многих академий, в том числе Петербургской АН. Был почетным членом и АН СССР. Независимо от немецкого химика Ф. Габера в 1901 г. нашел условия синтеза аммиака (см. ниже).
Приведем пример реакции, в которой важным для положения равновесия фактором является давление. Она тоже происходит в газовой фазе:
2 NO2 (г) 
При комнатной температуре NO2 – темно-коричневый газ (часто его называют «бурым» газом). Продукт его димеризации N2O4 бесцветен. Оба газа при обычных условиях присутствуют в смеси, т.е. находятся в химическом равновесии. Если увеличивать в такой равновесной химической системе давление, то равновесие сдвигается вправо – в сторону образования N2O4. Дело в том, что при одновременном увеличении концентрации [NO2] и [N2O4] преимущество получает прямая реакция. В ее кинетическое уравнение концентрация [NO2] входит в квадрате:
Происходящий при этом сдвиг равновесия вправо можно наблюдать экспериментально: при сжатии смеси газов она светлеет, поскольку уменьшается концентрация окрашенного NO2 и возрастает концентрация бесцветного N2O4 (рис. 9-13).
Рис. 9-13. При увеличении давления (Р2 > Р1) общее количество молекул в равновесной смеси уменьшается – система «сопротивляется» повышению давления: а) в системе больше молекул NO2 (смесь интенсивно окрашена); б) после увеличения давления молекул NO2 становится меньше (окраска ослабевает).
Но на равновесные реакции в растворах изменение давления не оказывает заметного влияния, если только в реакции не выделяется какой-нибудь газ. Дело в том, что жидкости почти не сжимаются под давлением, и концентрации растворенных в них реагирующих веществ практически не изменяются (если это не газообразные реагирующие вещества).
С помощью кинетических уравнений прямой и обратной реакций можно вывести закон действующих масс для химического равновесия. Пусть происходит обратимая реакция:
Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:
В предыдущем уравнении достаточно перенести в левую часть k2
а из полученного уравнения уже легко получается выражение для константы равновесия Кр:
Это не что иное, как математическая запись закона действующих масс для химического равновесия. Например, для рассмотренной выше реакции
Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ.
** Интересно, что в отличие от закона действующих масс для скорости реакции, в математическом выражении для константы равновесия показатели степени a, b, c, d всегда равны стехиометрическим коэффициентам в равновесной реакции. Это связано с тем, что как бы не были сложны механизмы прямой и обратной реакций, в состоянии равновесия они должны обеспечить перенос исходных веществ в продукты реакции и обратно в точном соответствии с коэффициентами перед этими веществами в суммарном уравнении.
Можно качественно предсказывать направление смещения равновесия по кинетическим уравнениям. Например, для сложной гетерогенной химической реакции
Fe3O4 (тв) + СО (г) 
можно предсказать, что изменение давления не приведет к смещению равновесия. Здесь скорости прямой и обратной реакции зависят в основном от концентраций газов (которые при изменении давления меняются одинаково), а твердые вещества не входят в кинетические уравнения.
Теплоту тоже можно рассматривать как «продукт» реакции. Следовательно, нагревание такой равновесной смеси должно приводить к активизации обратной реакции и смещению равновесия влево – в сторону образования исходных Fe3O4 и CO.
Наоборот, отведение образующегося тепла (понижение температуры) будет уменьшать скорость обратной реакции и равновесие сдвинется вправо – в сторону продуктов FeO и CO2.
Можно не пользоваться для решения таких вопросов кинетическими уравнениями, а прямо применить принцип Ле Шателье. Действительно, при нагревании равновесной системы с оксидами железа она должна сопротивляться этому воздействию – то есть замедлять прямую реакцию, идущую с выделением тепла. Точно так же (без кинетических уравнений) можно решать вопрос о смещении равновесия при увеличении давления в системе
2 NO2 (г) 
Для того, чтобы «сопротивляться» увеличению давления, эта система должна активизировать реакцию, приводящую к уменьшению общего числа молекул в смеси. Такой реакцией является прямая реакция, в которой из двух молекул газа получается одна. Следовательно, преимущество получит прямая реакция и равновесие сдвинется вправо.
Способы смещения химического равновесия играют большую роль в химической промышленности. Например, синтез аммиака является обратимой, экзотермической, каталитической реакцией:
Принцип Ле Шателье позволяет качественно подобрать условия, наиболее подходящие для сдвига равновесия вправо, т.е. в сторону максимально возможного содержания аммиака в равновесной смеси. Это имеет большое практическое значение – ведь чем больше равновесие сдвинуто вправо, тем больше аммиака можно получать в промышленной установке.
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию концентрации газов – для этого активизируется прямая реакция превращения четырех молекул газа (одной молекулы азота и трех водорода) в две молекулы газообразного аммиака. Во-вторых, необходимо отводить образующееся в реакции теплоту, т.е. понижать температуру. Если температуру повышать, то обратная реакция ускорится в большей степени, поскольку она идет с поглощением теплоты. Однако если охлаждать реактор слишком сильно, то обе реакции замедляются и равновесие устанавливается слишком медленно.
В промышленности находят компромисс – давление в аппаратах синтеза аммиака держат настолько высоким, насколько может выдержать их конструкция, а температуру выбирают средней, при которой равновесие в системе наступает достаточно быстро и в то же время не слишком сильно смещено в сторону исходных веществ – азота и водорода. Этой же цели служит и железный катализатор – он ускоряет наступление химического равновесия. Как вы уже знаете, катализаторы одинаково хорошо ускоряют как прямую, так и обратную реакции, поэтому добавление катализатора не может изменить положение равновесия, но способствует более быстрому его достижению.
Промышленное получение аммиака из атмосферного азота имеет огромное значение для современной цивилизации. Азот – весьма инертное вещество и его соединения в виде полезных ископаемых (селитр) встречаются очень редко. В то же время растения нуждаются в азоте, поэтому современное сельское хозяйство требует интенсивного применения все большего количества азотных удобрений, которые делают на основе аммиака. Также аммиак служит сырьем для производства азотной кислоты, а уже с участием HNO3 осуществляются многие другие важнейшие промышленные процессы – от получения лекарств и взрывчатых веществ до переработки ядерного топлива.
9.22. В каких реакциях изменение давления окажет влияние на смещение равновесия?
9.23. В какой из реакций предыдущей задачи повышение давления приводит к сдвигу равновесия влево?
9.24. ** (ФМШ) Реакция протекает по уравнению: 2 А 
9.25. Рассчитайте, во сколько раз изменятся скорости прямой и обратной реакции в равновесной системе
2 NO (г) + О2 (г) 
9.26. Примените принцип Ле Шателье к условиям и вопросу задачи 9.24. Убедитесь в том, что вывод о направлении смещения равновесия качественно совпадает с результатом количественного расчета.
9.27. В какой из четырех реакций равновесие больше всего сместится вправо при одновременном повышении температуры и понижении давления?
** Подсказка к задаче 9.24. Необходимо найти равновесные концентрации [А]р и [В]р. Пусть [В]р = x моль/л. Подумайте, чему в таком случае будет равна [А]р? Учтите, что на образование одной молекулы В надо «потратить» две молекулы А. Когда [А]р и [В]р будут выражены через «х», подставьте их в выражение для константы равновесия. Получится квадратное уравнение, решением которого будут два корня. Один из них имет неправдоподобное значение и может считаться ложным. Зато другой корень позволяет получить решение задачи. Сделайте проверку: подставьте полученные значения [А]р и [В]р в константу равновесия и убедитесь, что получается именно 0,25.