Что называется горением экзотермическая реакция
Экзотермические и эндотермические реакции.
Химическая реакция заключается в разрыве одних и образовании других связей,поэтому она сопровождается выделением или поглощением энергии в виде теплоты,света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
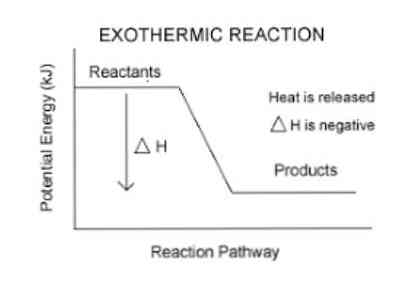
— химическая реакция, при которой происходит выделение теплоты.
Например, в реакции горения метана
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравненииреакции:
Это так называемое
Здесь символ «+Q» означает,что при сжигании метана выделяется теплота. Эта теплота называется
Термохимическое уравнение реакции
— уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения.
Тепловой эффект таких реакций отрицательный.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий ∆H продуктов реакции и исходных веществ.
— это определенное свойство вещества, оно является мерой энергии, накапливаемойвеществом при его образовании.
Процессы, протекающие при постоянном давлении,встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции ∆ H.
Термохимические уравнения.
На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением,например:
В справочных таблицах обычно приводят не значениявеличины Q, а значения величины ∆H, измеренные приопределенных условиях (чаще всего при 298 К); их обозначают ∆H0.
Теплота образования химических соединений.
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощаетсяпри образовании одного моля химического соединения из простых веществ пристандартных условиях (р = 10 5 Па, T = 298 К).
Тепловые эффекты химической реакции. Основные законы термохимии.
Количество теплоты, которое выделяется или поглощается врезультате реакций между определенными количествами реагентов, называют тепловым эффектом химическойреакции и обычно обозначают символом Q.
вещества называется тепловой эффект сгорания 1 моля этого вещества
Изменение энтальпии ∆Н зависит отдавления и температуры. Поэтому для того, чтобы облегчить сравнениетермохимических данных для различных реакций, были приняты определенныестандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газобязательно обозначаются символами (тв), (ж) и (г) соответственно, посколькуизменение энтальпии зависит от агрегатного состояния реагирующих веществ ипродуктов реакции.
Стандартное состояние всегда относится к 298 К.
Так, например,термохимическое уравнение образования воды из водорода и кислорода записываетсяследующим образом:
Значение 286 кДж является теплотой образования воды встандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты: Отметим, что значение теплоты образования газообразнойводы уже будет иным.
Закон Гесса и его следствия.
Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Процесс экзотермической реакции, типы и примеры
экзотермическая реакция это тип химической реакции, при которой происходит передача энергии, главным образом в форме выделения тепла или света. Название происходит от греческого префикса экзо, что означает «за границей»; и термин «термический», который относится к теплу или температуре.
В этом смысле экзотермические реакции могут передавать другие виды энергии в окружающую среду, где они генерируются, например, при взрывах и способе передачи кинетической и звуковой энергии, когда вещества, находящиеся в газовой фазе при высоких температурах, расширяются. насильственный путь.
Таким же образом, в случае использования батарей, также проводится экзотермическая реакция, только в этом случае транспортируется электрическая энергия..
процесс
Ранее было упомянуто, что когда происходит экзотермическая реакция, происходит выделение энергии, которое можно легче визуализировать в следующем уравнении:
Реагенты (ы) → Продукт (ы) + Энергия
Таким образом, для количественного определения энергии, поглощаемой или выделяемой системой, используется термодинамический параметр, называемый энтальпией (обозначается буквой «H»). Если в системе (в данном случае, химической реакции) происходит выделение энергии в окружающую среду, то изменение энтальпии (выраженное как ΔH) будет иметь отрицательное значение.
В противном случае, если изменение этой меры является положительным, оно отражает поглощение тепла из окружающей среды. Кроме того, величина изменения энтальпии системы является выражением количества энергии, передаваемой в окружающую среду или из нее..
Чем больше величина ΔH, тем больше выделение энергии из системы в окружающую среду.
Это происходит потому, что в этих реакциях чистая энергия, которая выделяется при создании новых связей, больше, чем чистая энергия, используемая при фрагментации связей.
Из вышесказанного можно сделать вывод, что такого рода реакции очень распространены, поскольку продукты реакции имеют количество энергии, запасенное в связях, больше, чем то, что содержится в реагентах..
тип
Существуют различные виды экзотермических реакций в различных областях химии, будь то в лаборатории или в промышленности; некоторые выполняются спонтанно, а другие требуют особых условий или какого-либо типа вещества, такого как катализатор, который будет произведен.
Ниже приведены наиболее важные виды экзотермических реакций:
Реакции горения
Реакции горения представляют собой реакции окислительно-восстановительного типа, которые происходят, когда одно или несколько веществ вступают в реакцию с кислородом, обычно приводя к выделению света и тепловой энергии, то есть света и тепла, когда возникает пламя..
Реакции нейтрализации
Реакции нейтрализации характеризуются взаимодействием между кислотой и щелочным веществом (основанием) с образованием соли и воды, которые проявляют экзотермическую природу..
Реакции окисления
Существует много реакций такого типа, которые демонстрируют экзотермическое поведение, потому что окисление кислорода вызывает выделение большого количества энергии, как это происходит при окислении углеводородов..
Термитная реакция
Эта реакция может давать температуру около 3000 ° C, и из-за высокого сродства алюминиевого порошка с большим количеством оксидов металлов его используют при сварке стали и железа.
Реакция полимеризации
Этот тип реакции возникает тогда, когда реагирует определенное количество химических веществ, называемых мономерами, которые представляют собой единицы, которые при объединении повторяются в цепочках с образованием макромолекулярных структур, называемых полимерами..
Реакция ядерного деления
Этот процесс относится к разделению ядра атома, считающегося тяжелым, то есть с массовым числом (А), превышающим 200, для получения фрагментов или ядер меньшего размера с промежуточной массой..
В этой реакции, где образуются один или несколько нейтронов, выделяется большое количество энергии, потому что ядро с большим весом имеет более низкую стабильность, чем его продукты..
Другие реакции
Существуют также другие экзотермические реакции, имеющие большое значение, такие как обезвоживание некоторых углеводов при взаимодействии с серной кислотой, поглощение воды, в которой гидроксид натрия находится на открытом воздухе, или окисление металлических частиц во многих реакциях коррозии..
примеров
Ниже приведены некоторые примеры экзотермических реакций, которые вызывают изменение энтальпии, которое имеет отрицательное значение из-за того, что они выделяют энергию, как упомянуто выше..
Например, сгорание пропана является спонтанной экзотермической реакцией:
Другой случай экзотермического поведения показан реакцией нейтрализации между карбонатом натрия и соляной кислотой:
Представлено также окисление этанола в уксусную кислоту, используемое в алкотестерах, полная реакция которых показана в следующем уравнении:
Другим классом экзотермической реакции является так называемая термитная реакция, в которой алюминий объединяется с оксидом металла, как показано ниже:
В дополнение к объясненным выше примерам существует множество различных реакций, которые также считаются экзотермическими, такие как разложение определенных органических отходов для компостирования..
Это также подчеркивает окисление люциферинового пигмента под действием фермента люциферазы, чтобы произвести биолюминесценцию, характерную для светлячков, и даже дыхание, среди многих других реакций.
Горение (процесс горения)
Горение (процесс горения)
Вы можете посмотреть авторское определение термина «процесс горения» профессора Абдурагимова И.М. с подробными разъяснениями сути этого явления или прочитать определения из разных источников ниже:
Определение
Источник
экзотермическая реакция, протекающая в условиях ее прогрессивного самоускорения
пункт 2.1.1 ГОСТ 12.1.044-89 (ИСО 4589-84) «Пожаровзрывоопасность веществ и материалов»
экзотермическая реакция окисления вещества, сопровождающаяся по крайней мере одним из трех факторов: пламенем, свечением, выделением дыма
пункт 1.5 СТ СЭВ 383-87 «Пожарная безопасность в строительстве» термины и определения (утратил силу)
химическая реакция окисления, сопровождающаяся выделением большого количества тепла и обычно свечением
пункт 1 ОСТ 78-2-73 Горение и пожарная опасность веществ. Терминология (утратил силу)
экзотермическая реакция сгорания вещества в окислителе
химический процесс, основывающийся на избирательном сродстве кислотвора воздуха к горящему телу и во взаимном их химическом соединении
«Практическое наставление брандмейстерам» Санктпетерберг, Типография В. Плавильщикова 1818 г., стр.71
всякое быстрое соединение какого-нибудь вещества с кислородом, при котором отделяется такое количество тепла, что происходит накаливание, обыкновенно называется горением этого вещества. Но это определение не полно, потому что предметы могут гореть не в одном только кислороде, но и во многих других газах.Поэтому горением следует называть все происходящие в предметах изменения, называемые реакцией, которые только сопровождаются отделением света и большого количества теплоты.
Николаев А. Пожарная книга. Постановления закона о предосторожностях от огня и руководство к тушению всякого рода пожаров. С-Петерберг, Типография М. Стасюлевича 1875 г., стр.42
всякий химический экзотермический процесс, сопровождающийся столь энергичным выделением тепла, что при этом процессе появляется свечение
Тидеман Б.Г. Сциборский Д.Б. Химия горения, Издательство Наркомхоза РСФСР, Ленинград 1940 Москва, с 6
химический процесс, сопровождающийся выделением тепла и света
Демидов П.Г. Основы горения веществ, издательство Министерства коммунального хозяйства РСФСР, Москва, 1951 год. с.7
быстро протекающая химическая реакция, сопровождающаяся выделением тепла и излучением света
Годжелло М.Г., Демидов П.Г., Джалалов Е.М., Коршак З.В., Рябов И.В. «Легковоспламеняющиеся и горючие жидкости» Из-во Министерства коммунального хозяйства РСФСР, Москва, 1956
всякая быстро протекающая химическая реакция, сопровождающаяся выделением тепла и света
Хитрин Л.Н. Физика горения и взрыва, Москва, Издательство Московского универтитета 1957 год с.5
всякая химическая реакция, сопровождающаяся выделением тепла и излучением света, например, реакции взаимодействия водорода с хлором, красного фосфора с бромом, бензина с кислородом воздуха, разложение сжатого ацетилена и т.д.
Челышев Ф.С., Сомова З.М. Демидов П.Г. Пожарная опасность речных судов и противопожарные мероприятия, издательство «Речной транспорт», Москва, 1959 год с.5.
сложный физико-химический процесс взаимодействия горючего вещества и окислителя, сопровождающийся выделением тепла и излучением света.
Алексеев М.В., Демидов П.Г. Ройтман М.Я., Тарасов Агалаков Н.А. Основы пожарной безопасности. Учебное пособие для высших учебных заведений, «Высш. школа», 1971, с 7
основной процесс на пожаре, сложный физико-химический процесс превращения горючих веществ и материалов в продукты сгорания, сопровождаемый интенсивным выжедением тепла, дыма и световым излучением, в основе которого лежат быстротекущие химические реакции окисления в атмосфере кислорода воздуха
Абдурагимов И.М. Говоров В.Ю. Макаров В.Е. Физико-химические основы развития и тушения пожаров, М. 1980 ВИПТШ МВД СССР, с.5
физико-химический процесс, для которого характерны три признака: химическое превращение, выделение тепла, излучение света.
Демидов П.Г., Шандыба В.А., Щеглов П.П. «Горение и свойства горючих веществ». – 2-е изд., перераб. – М.: Химия, 1981. – с.7.
процесс быстрого окисления с выделением за единицу времени значительного количества тепла, успевающего поддерживать его на уровне достаточно высоких температур
Шувалов М.Г. Основы пожарного дела: Учебник для рядового и мл. нач. состава пожарнойе охраны. – 3-е изд., перераб. И доп. – М.: Стройиздат, 1975. – с 244
сложное, быстро протекающее химическое превращение, сопровождающееся выделением большого количества теплоты и обычно свечением
Шувалов М.Г. Основы пожарного дела: Учебник для рядового и мл. нач. состава пожарнойе охраны. – 3-е изд., перераб. И доп. – М.: Стройиздат, 1983. – с 275
сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым излучением
Абдурагимов И.М., Андросов А.С., Исаева Л.К., Крылов Е.В.. «Процессы горения». Учебник ВИПТШ М., 1984 г. с. 5
сложный физико-химический процесс превращения горючих веществ и материалов в продукты горения, сопровождающийся выделением тепла и света
Баратов А.Н., Андрианов Р.А., Корольченков А.Я. и др.; Под ред. А.Н. Баратова. – М.: Стройиздат, 1988, с.5
процесс протекания экзотермических химических реакций в условиях прогрессивного самоускорения, обусловленного накоплением в горючей среде тепла или катализирующих продуктов реакции.
сложный физико-химический процесс, при котором превращение вещества сопросвождается интенсивным выделением энергии и темпло- и массообменом с окружающей средой
совокупность одновременно протекающих физических процессов (плавление, испарение, ионизация) и химических реакций окисления горючих веществ и материалов, сопровождающихся ярким свечением (пламенем), тепловым излучением и выделением дыма
Шувалов М.Г. Основы пожарно-спасательного дела, учебное пособие. Москва, 2012 год, с. 327
инженер пожарной безопасности
историк пожарной охраны Москвы
Все права на текст статьи принадлежат автору. Копирование, распространение, использование и иные действия, за исключением ознакомления на данной странице сайта ptm01.ru запрещены.
Разрешено: копировать ссылку (url) на данную страницу и направлять скопированную ссылку неограниченному кругу лиц.
Горение
Горе́ние — сложный физико-химический процесс превращения компонентов горючей смеси в продукты сгорания с выделением теплового излучения, света и лучистой энергии. Описать природу горения можно как бурно идущее окисление.
Дозвуковое горение (дефлаграция) в отличие от взрыва и детонации протекает с низкими скоростями и не связано с образованием ударной волны. К дозвуковому горению относят нормальное ламинарное и турбулентное распространения пламени, к сверхзвуковому — детонацию.
Горение подразделяется на тепловое и цепное. В основе теплового горения лежит химическая реакция, способная протекать с прогрессирующим самоускорением вследствие накопления выделяющегося тепла. Цепное горение встречается в случаях некоторых газофазных реакций при низких давлениях.
Условия термического самоускорения могут быть обеспечены для всех реакций с достаточно большими тепловыми эффектами и энергиями активации.
Горение может начаться самопроизвольно в результате самовоспламенения либо быть инициированным зажиганием. При фиксированных внешних условиях непрерывное горение может протекать в стационарном режиме, когда основные характеристики процесса — скорость реакции, мощность тепловыделения, температура и состав продуктов — не изменяются во времени, либо в периодическом режиме, когда эти характеристики колеблются около своих средних значений. Вследствие сильной нелинейной зависимости скорости реакции от температуры, горение отличается высокой чувствительностью к внешним условиям. Это же свойство горения обусловливает существование нескольких стационарных режимов при одних и тех же условиях (гистерезисный эффект).
Содержание
Теория горения
При адиабатическом сжигании горючей смеси могут быть рассчитаны количество выделившегося при горении тепла, температура ТГ, которая была бы достигнута при полном сгорании (адиабатическая температура горения) и состав продуктов, если известны состав исходной смеси и термодинамические функции исходной смеси и продуктов. Если состав продуктов заранее известен, ТГ может быть рассчитана из условия равенства внутренней энергии системы при постоянном объёме или её энтальпии при постоянном давлении в исходном и конечном состояниях с помощью соотношения: ТГ = Т0 + Qr/C, где Т0 — начальная температура смеси, С — средняя в интервале температур от Т0 до ТГ удельная теплоёмкость исходной смеси (с учетом её изменения при возможных фазовых переходах), Qr — удельная теплота сгорания смеси при температуре ТГ. При относительном содержании а0 в смеси компонентов, полностью расходуемых в реакции, QГ = Q*а0 где Q — тепловой эффект реакции горения. Значение ТГ при постоянном объёме больше, чем при постоянном давлении, поскольку в последнем случае часть внутренней энергии системы расходуется на работу расширения. На практике условия адиабатичекого горения обеспечиваются в тех случаях, когда реакция успевает завершиться прежде, чем станет существенным теплообмен между реакционным объёмом и окружающей средой, например в камерах сгорания крупных реактивных двигателей, в больших реакторах, при быстро распространяющихся волнах горения.
Термодинамический расчёт даёт лишь частичную информацию о процессе — равновесный состав и температуру продуктов. Полное описание горения, включающее также определение скорости процесса и критических условий при наличии тепло- и массообмена с окружающей средой, можно провести только в рамках макрокинетического подхода, рассматривающего химическую реакцию во взаимосвязи с процессами переноса энергии и вещества.
В случае заранее перемешанной смеси горючего и окислителя реакция горения может происходить во всём пространстве, занятом горючей смесью (объёмное горение), или в сравнительно узком слое, разделяющем исходную смесь и продукты и распространяющемся по горючей смеси в виде так называемой волны горения. В неперемешанных системах возможно диффузионное горение, при котором реакция локализуется в относительно тонкой зоне, отделяющей горючее от окислителя, и определяется скоростью диффузии реагентов в эту зону.
Описание процессов горения
Важность процесса горения в технических устройствах способствовала созданию различных моделей, позволяющих с необходимой точностью его описывать. Так называемое нулевое приближение включает описание химических реакций, изменение температуры, давления и состава реагентов во времени без изменения их массы. Оно соответствует процессам происходящим в закрытом объёме, в который была помещена горючая смесь и нагрета выше температуры воспламенения. Одно-, двух- и трёхмерные модели уже включает в себя перемещение реагентов в пространстве. Количество измерений соответствует количеству пространственных координат в модели. Режим горения бывает как и газодинамическое течение: ламинарным или турбулентным. Одномерное описанное ламинарного горения позволяет получить аналитически важные выводы о фронте горения, которые затем используются в более сложных турбулентных моделях.
Объёмное горение
Объемное горение происходит, например, в теплоизолированном реакторе идеального перемешивания, в который поступает при температуре Т0 исходная смесь с относительным содержанием горючего а0; при другой температуре горения реактор покидает смесь с иным относительным содержанием горючего а. При полном расходе G через реактор условия баланса энтальпии смеси и содержания горючего при стационарном режиме горения могут быть записаны уравнениями:
где w(а, Т) — скорость реакции горения, V — объём реактора. Используя выражение для термодинамической температуры ТГ, можно из (1) получить:
и записать (2) в виде:
где q—T = GC(T — Т0) — скорость отвода тепла из реактора с продуктами сгорания, q+T = Qw(a, Т)V — скорость выделения тепла при реакции. Для реакции n-ного порядка с энергией активации:
Диффузионное горение
Характеризуется раздельным подачей в зону горения горючего и окислителя. Перемешивание компонентов происходит в зоне горения. Пример: горение водорода и кислорода в ракетном двигателе, горение газа в бытовой газовой плите.
Горение предварительно смешанной среды
Как следует из названия, горение происходит в смеси, в которой одновременно присутствуют горючее и окислитель. Пример: горение в цилиндре двигателя внутреннего сгорания бензиново-воздушной смеси после инициализации процесса свечой зажигания.
Особенности горения в различных средах
Беспламенное горение
В отличие от обычного горения, когда наблюдаются зоны окислительного пламени и восстановительного пламени, возможно создание условий для беспламенного горения. Примером может служить каталитическое окисление органических веществ на поверхности подходящего катализатора, например, окисление этанола на платиновой черни.
Твердофазное горение
Это автоволновые экзотермические процессы в смесях неорганических и органических порошков, не сопровождающиеся заметным газовыделением, и приводящие к получению исключительно конденсированных продуктов. В качестве промежуточных веществ, обеспечивающих массо-перенос, образуются газовые и жидкие фазы, не покидающие, однако, горящую систему. Известны примеры реагирующих порошков, в которых образование таких фаз не доказано (тантал-углерод).
Как синонимы используются тривиальные термины «безгазовое горение» и «твердопламенное горение».
Примером таких процессов служит СВС (самораспространяющийся высокотемпературный синтез) в неорганических и органических смесях.
Тление
Вид горения, при котором пламя не образуется, а зона горения медленно распространяется по материалу. Тление обычно наблюдается у пористых или волокнистых материалов с высоким содержанием воздуха или пропитанных окислителями.
Автогенное горение
Самоподдерживающиеся горение. Термин используется в технологиях сжигания отходов. Возможность автогенного (самоподдерживающегося) горения отходов определяется предельным содержанием балластирующих компонентов: влаги и золы. На основе многолетних исследований шведский учёный Таннер предложил для определения границ автогенного горения использовать треугольник-схему с предельными значениями: горючих более 25 %, влаги менее 50 %, золы менее 60 %.