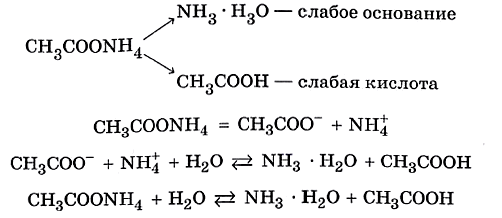Что называется гидролизом соли
ГИДРОЛИЗ СОЛЕЙ. Гидролизом соли называется реакция обменного взаимодействия соли с водой, в результате чего нарушается равновесие диссоциации воды:



Гидролизом соли называется реакция обменного взаимодействия соли с водой, в результате чего нарушается равновесие диссоциации воды:
Соли можно рассматривать как продукты реакции нейтрализации:
 |
Кислота + основание соль + вода
Кислоты и основания, образующие соли, могут быть сильными и слабыми, поэтому возможны 4 вида солей:
— сокращенное ионное уравнение;
Рассмотрим гидролиз FeCl3. Он будет протекать по катиону в три ступени:
I ступень Fе 3+ + Н2О ↔ FeОН 2+ + Н + ;
II ступень FeОН 2+ + Н2О ↔ Fe(ОН) + 2 + Н + ;
Рассмотрим гидролиз Na3РО4, он будет протекать по аниону в 3 ступени:
На всех трех ступенях гидролиз идет по аниону, среда щелочная (рН>7). Преобладает I ступень гидролиза.
Гидролиз идет по катиону и по аниону, среда нейтральная (рН=7).
Если смешать растворы двух солей, образованных катионом слабого основания и анионом слабой кислоты, произойдёт совместный необратимый гидролиз:
На равновесие гидролиза влияет температура и концентрация. Смещение равновесия гидролиза происходит в соответствии с принципом Ле-Шателье. Гидролиз – это реакция, обратная нейтрализации, а нейтрализация – экзотермический процесс, следовательно, гидролиз – эндотермический. Поэтому увеличение температуры усиливает гидролиз (т.е. смещает равновесие вправо). Гидролиз усиливается при разбавлении водой и при удалении продуктов гидролиза. Гидролиз подавляется (равновесие смещается влево), если увеличивать концентрацию продуктов гидролиза. Гидролиз может протекать необратимо, если продукты гидролиза уходят из сферы реакции (выпадение осадка, выделение газа):
Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
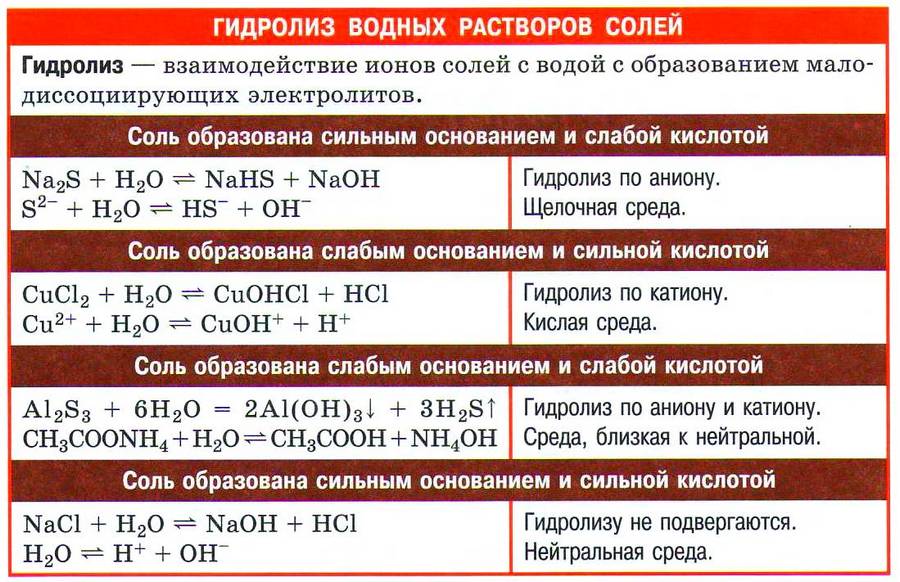
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
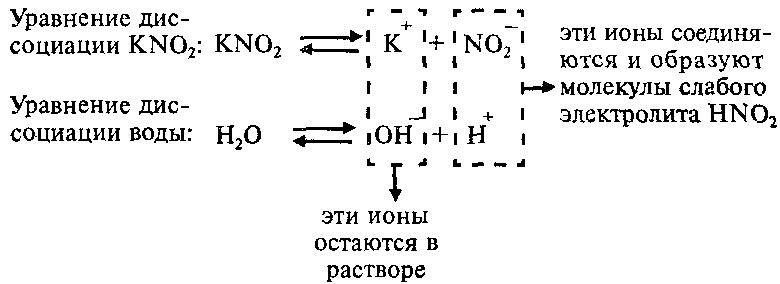
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
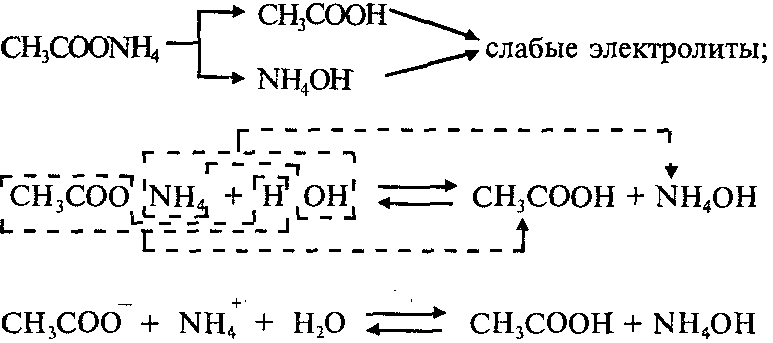
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
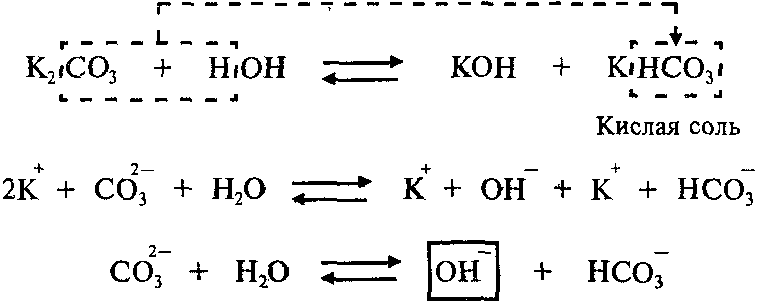
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Урок №14. Гидролиз
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо.
Примеры гидролиза
Неорганических веществ
CH 3 COONH 4 +H 2 O↔CH 3 COOH+NH 4 OH
Органических веществ
CH 3 COOCH 3 +H 2 O↔CH 3 COOH+CH 3 OH
C 2 H 5 ONa+H 2 O↔C 2 H 5 OH+NaOH
Факторы, влияющие на степень гидролиза
Степень гидролиза зависит от:
природы растворяемого вещества
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Чем меньше концентрация соли, тем выше степень ее гидролиза. При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
3). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO 4 + 2H 2 O (CuOH) 2 SO 4 + H 2 SO 4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
нагреть или разбавить раствор водой;
добавит раствор щёлочи (NaOH);
добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
Ослабить гидролиз этой соли можно, если:
растворение вести на холоду;
готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
FeCl 2 + H 2 O FeOHCl + HCl
Fe(OH)Cl + H 2 O Fe(OH) 2 + HCl
Гидролиз карбоната натрия включает две ступени:
Nа 2 СО 3 + H 2 O NаНСО 3 + NаОН
NаНСО 3 + Н 2 О NаОН + Н 2 СО 3
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S↑
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S↑ (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t°C =Al 2 S 3
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) и растворимые карбонаты/гидрокарбонаты.
При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl 2 + 2Na 2 CO 3 + H 2 O = Mg 2 (OH) 2 CO 3 + 4NaCl + CO 2
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
2AlCl 3 + 3K 2 S +6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6KCl
2CrCl 3 + 3K 2 CO 3 + 3H 2 O = 2Сr(ОН) 3 + 3СO 2 + 6KCl
2AlCl 3 + 3Na 2 SO 3 + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3SО 2
2AlCl 3 + 3Na 2 S + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3H 2 S
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl 3 + 3K 2 CO 3 + 3H 2 O = 2Fe(ОН) 3 + 3СO 2 + 6KCl
Обратите внимание: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl 3 + 3K 2 S (изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl,
SOCl 2 + 2 H 2 O = H 2 SO 3 + 2HCl,
PCl 5 + 4 H 2 O = H 3 PO 4 + 5HCl,
CrO 2 Cl 2 + 2H 2 O = H 2 CrO 4 + 2HCl,
PCl 5 + 8NaOH = Na 3 PO 4 + 5NaCl + 4H 2 O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl 3 + 3H 2 O = H 3 PO 4 + 3HCl
Примеры реакций гидролиза
(NH 4 ) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4 ) 2 CO 3 +H 2 O↔NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O↔NH 4 OH+H 2 CO 3
Реакция раствора слабощелочная pH>7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH)>К д (H 2 CO 3 )
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O↔NH 4 OH+СH 3 COOH
Реакция раствора нейтральная pH=7, т.к К д (CH 3 COOН)=К д (NH 4 OH)
1 ступень: K 2 HPO 4 +H 2 O↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O↔H 3 PO 4 +KOH
Реакция раствора 2 ступени слабокислая pH=6,4, так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O↔H 2 CO 3 +NaOH
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду.
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O↔H 2 SO 3 +NaOH
В этом случае константа диссоциации больше константы гидролиза, поэтому раствор NaHSO 3 имеет кислую среду.
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 CN +H 2 O ↔ NH 4 OH+ HCN
Что называется гидролизом соли
Ключевые слова конспекта: Гидролиз необратимый и обратимый. Гидролиз солей в зависимости от силы кислот и оснований, образующих соль. Роль гидролиза в обмене веществ. Роль гидролиза в энергетическом обмене.
Слово «гидролиз» (от др.-греч. hydor — вода и lysis — разложение) буквально означает «разложение вещества водой».
| Гидролиз — реакции обменного взаимодействия веществ с водой, приводящие к их разложению. |
Гидролиз бывает необратимым и обратимым.
Если соль образована слабым нерастворимым основанием и слабой летучей кислотой, она существует только в сухом виде, так как в воде полностью разлагается, т. е. подвергается необратимому гидролизу, например:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
Кроме некоторых солей, необратимому гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды и т. д. Например:
Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2PH3↑
Эта реакция лежит в основе применения фосфида цинка в качестве зооцида, т. е. вещества, используемого для борьбы с животными-вредителями, прежде всего грызунами.
В органической химии необратимый гидролиз используется для получения ацетилена карбидным способом:
Результаты опыта, наверное, для вас неожиданны: только во второй пробирке индикаторная бумага показала нейтральную среду, тогда как в первой — щелочную, а в третьей — кислотную. Почему? Объяснить результаты эксперимента нам поможет понятие обратимый гидролиз.
Гидролиз солей происходит вследствие взаимодействия катиона металла или аниона кислотного остатка, входящих в состав соли, с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение, в водном растворе появляется избыток катионов водорода или гидроксид–анионов, обусловливающих кислотную или щелочную реакцию среды.
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, карбонат натрия Na2CO3 образован сильным основанием (щёлочью) — гидроксидом натрия NaOH и слабой угольной кислотой Н2СО3.
В зависимости от силы основания и кислоты как электролитов все соли можно разделить на четыре типа. Рассмотрим поведение солей различных типов в водных раствора х.
✅ 1. Соли, образованные сильным основанием и слабой кислотой, например карбонат натрия:
Карбонат натрия хорошо растворим в воде и полностью диссоциирует на ионы:
Мы записали ионное уравнение гидролиза. В результате этого процесса в растворе накапливаются гидроксид-анионы, определяющие щелочную реакцию среды. В данном случае говорят, что идёт гидролиз по аниону.
Молекулярное уравнение гидролиза карбоната натрия имеет вид
✅ 2. Соли, образованные слабым основанием и сильной кислотой. Рассмотрим пример гидролиза хлорида цинка:
В водном растворе хлорид цинка полностью диссоциирует:
Гидролизу подвергается тот ион, который принадлежит слабому электролиту, поэтому данная соль гидролизуется по катиону. Отрывая от молекулы воды гидроксид-анион, катион Zn 2+ способствует накоплению в растворе катионов водорода:
Молекулярное уравнение гидролиза легко записать, если в ионном уравнении дописать хлорид-анионы:
Реакцию среды в растворе данной соли определяет наличие катионов Н + : среда кислотная.
✅ 3. Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу по катиону и по аниону. Катион и анион делят между собой молекулу воды, присоединяя соответственно гидроксид–анион и катион водорода. Например, ацетат аммония:
В растворе ацетата аммония среда нейтральная, поскольку нет избытка ни катионов водорода, ни гидроксид-анионов.
Необратимо гидролизуются и по катиону, и по аниону соли слабого нерастворимого основания и слабой летучей кислоты, что было рассмотрено в начале конспекта.
✅ 4. Не гидролизуются соли, образованные сильным основанием и сильной кислотой. В водном растворе подобных солей катионы металла (щелочного или щёлочноземельного) и анионы кислотного остатка окружены гидратными оболочками, взаимодействия с молекулами воды не происходит, поскольку это не приводит к образованию слабого электролита. Реакция среды в растворе таких солей нейтральная.
Термин «гидролиз» не должен ассоциироваться только с гидролизом солей. Это понятие значительно шире, а гидролиз солей – это лишь небольшая часть химических процессов, связанных с разложением веществ водой.
Реакции разложения органических соединений водой также называются гидролизом. Эти реакции играют исключительно важную роль и в промышленности, и в биологических процессах. В курсе органической химии вы изучали гидролиз сложных эфиров, ди- и полисахаридов, белков и других органических веществ.
Существует особая отрасль деревообрабатывающей промышленности, которая так и называется — гидролизная. Малоценные отходы лесопереработки (щепа, опилки, стружки), содержащие до 50% органического полисахарида целлюлозы, нагревают при повышенном давлении в присутствии серной кислоты (в качестве катализатора). В результате происходит гидролиз целлюлозы с образованием её мономера — глюкозы:
Полученные глюкозо-содержащие сиропы сбраживают и получают гидролизный этиловый спирт:
Важное значение имеют процессы гидролиза в живой природе. Основными компонентами пищи человека являются жиры, белки и углеводы. В пищеварительном тракте они подвергаются гидролизу с образованием аминокислот, глицерина и жирных кислот, глюкозы. Из этих «строительных кирпичиков» организм синтезирует свои собственные белки, жиры и углеводы.
Основу жизненных процессов составляет не только обмен веществ, но и обмен энергии. В энергетическом обмене главную роль играет аденозинтрифосфорная кислота (АТФ). Её молекулы гидролизуются с отщеплением остатков фосфорной кислоты и высвобождением энергии (40—60 кДж/моль):
АТФ + вода —> АДФ + фосфорная кислота + энергия
Энергия расходуется на основной обмен (поддержание температуры, рост клеток, движение и др.).
В ходе обратной реакции выделяемая за счёт окисления органических веществ энергия вновь накапливается в АТФ, которая синтезируется из аденозиндифосфорной кислоты (АДФ):
АДФ + фосфорная кислота + энергия —> АТФ + вода
Следовательно, процессы гидролиза — химический фундамент процессов ассимиляции и диссимиляции, лежащих в основе жизни на Земле.
Конспект урока по химии «Гидролиз». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие: