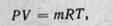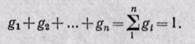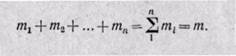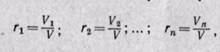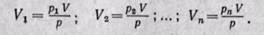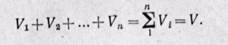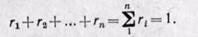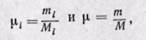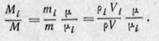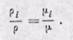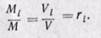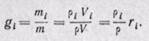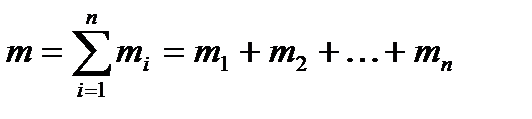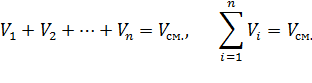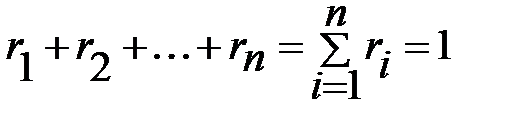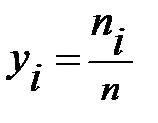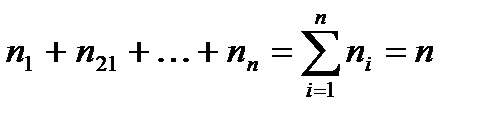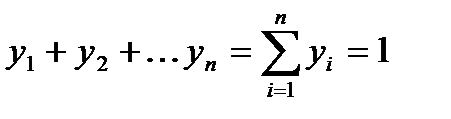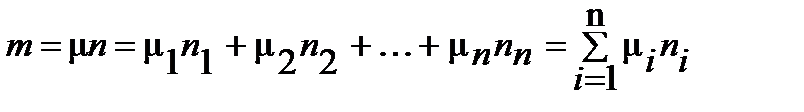Что называется газовой смесью
Основные свойства газовых смесей
В технике очень часто приходится иметь дело с газообразными веществами, представляющими механическую смесь отдельных газов, например, доменный и светильный газ, отходящие газы из котельных установок, двигателей внутреннего сгорания, реактивных двигателей и других тепловых установок. Воздух также представляет собой газовую смесь, состоящую из азота, кислорода, углекислого газа, водяных паров и одноатомных газов. Поэтому для решения практических задач необходимо уметь определять основные параметры газовой смеси: газовую постоянную, среднюю молекулярную массу, парциальные давления и др.
Под газовой смесью понимается механическая смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ в смеси, независимо от других газов, полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси. Молекулы газа создают давление на стенки сосуда, которое называется парциальным (частичным). Будем считать, что каждый отдельный газ, входящий в смесь, подчиняется уравнению состояния Клапейрона, т. е. является идеальным газом.
Газовая смесь идеальных газов подчиняется закону Дальтона, который гласит: общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь:
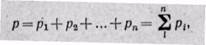
Парциальным давлением называют такое, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Параметры газовой смеси могут быть вычислены по уравнению Клапейрона
где все величины, входящие в уравнение относятся к смеси газов.
Таким образом, задачей расчета газовой смеси является определение на основании заданного состава смеси средней молекулярной массы, или газовой постоянной, смеси газов, после чего получение всех остальных параметров можно произвести по уравнению состояния для смеси.
Дополнительно часто требуется также определение и парциальных давлений газов, входящих в смесь.
При дальнейшем изложении этой главы все величины без значков будем относить к газовым смесям, а величины со значками — к отдельным газам.
Способы задания смеси газов. Газовая смесь может быть задана массовыми, объемными и мольными долями.
Массовой долей называют отношение массы каждого газа к общей массе смеси:
т—масса всей смеси. Сумма массовых долей равна единице:
Сумма масс всех газов равна массе смеси:
Объемной долейназывают отношение парциального (приведенного) объема каждого газа к общему объему смеси газов:
каждого газа; V — объем смеси газов.
Парциальным объемом газа называют объем, который занимал бы этот газ, если бы его температура и давление равнялись температуре и давлению смеси газов.
Парциальный объем каждого газа можно определить по закону Бойля — Мариотта. При постоянной температуре имеем
Сложив полученные уравнения, будем иметь
Сумма парциальных объемов газов, составляющих смесь, равна объему смеси газов.
Сумма объемных долей равна единице:
Задание смеси мольными долями равнозначно заданию ее объемными долями.
Действительно, если мольной долей назвать отношение числа киломолей каждого газа (Мi) к числу киломолей смеси газов (М), то, учитывая, что
Из закона Авогадро следует, что при одинаковых давлениях и температурах
Тогда окончательно
Соотношения между массовыми и объемными долями. Между удельными объемами, плотностями, молекулярными массами и газовыми постоянными какого-нибудь газа и всей смеси в целом на основании закона Авогадро и уравнения Клапейрона — Менделеева существует следующая зависимость:

где рi — плотность каждого газа; ρ — плотность смеси газов; μi — молекулярная масса каждого газа; μ — молекулярная масса смеси газов.
Можно записать также, что
Последние два соотношения позволяют составить несколько уравнений, связывающих массовые и объемные доли:
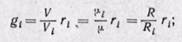
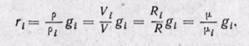
Газовая смесь
Смесь чистых газов, не вступающих друг с другом в химическую реакцию
3.7 газовая смесь (mixture): Газ, состоящий из основного газа и одного или более компонентов.
3.1.2 газовая смесь: Смесь чистых газов, не вступающих друг с другом в химическую реакцию.
Полезное
Смотреть что такое «Газовая смесь» в других словарях:
газовая смесь — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN gas mixture [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] Тематики охрана окружающей среды EN gas mixture DE Gasgemisch FR mélange gazeux … Справочник технического переводчика
газовая смесь — dujų mišinys statusas T sritis fizika atitikmenys: angl. gaseous mixture vok. Gasgemisch, n rus. газовая смесь, f pranc. mélange gazeux, m … Fizikos terminų žodynas
газовая смесь средней концентрации — Эквивалентной 40 60% величины диапазона значений. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN mid level [mid range] gas mixtures … Справочник технического переводчика
Газовая смесь для дыхания — Дыхательный газ это смесь газообразных химических элементов и соединений используемых для дыхания. Воздух это наиболее распространённый и единственный естественный дыхательный газ. Прочие искусственные газы, в чистом виде или в виде… … Википедия
поверочная газовая смесь — 3.1.12 поверочная газовая смесь; ПГС: Стандартный образец состава газовой смеси, предназначенный для градуировки, калибровки и поверки приборов. Источник … Словарь-справочник терминов нормативно-технической документации
Образцовая газовая смесь — Газовая смесь, предназначенная для проверки показаний газоанализатора, имеющая в своем составе известную концентрацию окиси углерода или окислов азота Источник … Словарь-справочник терминов нормативно-технической документации
первичная эталонная газовая смесь, находящаяся в баллоне под давлением — 3.3 первичная эталонная газовая смесь, находящаяся в баллоне под давлением: Газовая смесь в баллоне под давлением, входящая в состав эталонного комплекса аналитической, газосмесительной и гравиметрической аппаратуры государственного специального… … Словарь-справочник терминов нормативно-технической документации
первичный эталонный чистый газ (газовая смесь), находящийся (находящаяся) в баллоне под давлением — 3.3 первичный эталонный чистый газ (газовая смесь), находящийся (находящаяся) в баллоне под давлением: Чистый газ (газовая смесь), находящийся (находящаяся) в баллоне под давлением, входящий (входящая) в состав одного из эталонных комплексов… … Словарь-справочник терминов нормативно-технической документации
взрывоопасная газовая смесь — 2.1 взрывоопасная газовая смесь: Смесь горючих газов или паров с воздухом при нормальных атмосферных условиях, у которой при воспламенении горение распространяется на весь объем несгоревшей смеси. Примечание Несмотря на то, что смесь,… … Словарь-справочник терминов нормативно-технической документации
дыхательная газовая смесь — Естественная (воздух) или искусственно приготовленная смесь газов для дыхания водолазов под повышенным давлением. Примечание В состав дыхательной газовой смеси обязательно входит кислород, и могут входить различные газы азот, гелий, аргон и др.… … Справочник технического переводчика
Газовые смеси



На практике приходится встречаться как с индивидуальными газами, так и с газовыми смесями. К таким газовым смесям относятся следующие: воздух (атмосферный воздух состоит из кислорода, азота и некоторых других газов), дымовые газы (содержат, как правило, азот, диоксид углерода (углекислый газ), пары воды, сернистый газ и т.д.). В термодинамике изучают газовые смеси, представляющие собой механическую смесь различных газов, между которыми отсутствует химическая реакция, т.е. газовые смеси, не изменяющие своего состава. К таким смесям относятся окружающий нас воздух, состоящий из азота, кислорода, углекислого газа и т.д., природный газ, состоящий из метана и др. углеводородов. Газовыми смесями являются также продукты сгорания различных веществ на пожаре, в двигателях внутреннего сгорания, в топке паровых котлов. Некоторые газовые смеси являются взрывоопасными при определённой концентрации. Следовательно, при расчётах пожарной безопасности необходимо знание и использование законов для газовых смесей.
Закон Дальтона.
Индивидуальный газ, входящий в состав газовой смеси называется компонентом газовой смеси.
Каждый компонент смеси, оказывает на стенки сосуда такое давление, какое он имел бы, если бы он занимал при данной температуре весь объём газовой смеси. Такое давление называется парциальным.
Английский физик и химик Джон Дальтон (1766-1844) в 1801 г. экспериментально установил связь между парциальными давлениями отдельных газов и давлением смеси в целом. При постоянно температуре полное давление смеси нескольких газов равно сумме их парциальных давлений.
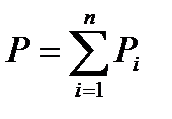
где Pi – парциальное давление i–го газа; п – количество газов, составляющих газовую смесь.
Закон Дальтона широко используется для описания газовых смесей и справедлив для идеальных газов. Чем выше давление смеси, т.е. чем дальше газы от идеального состояния, тем большие отклонения от закона Дальтона наблюдается в поведении газовой смеси.
Способы задания смеси газов.
Состав газовой смеси может быть охарактеризован массовыми, объёмными и мольными долями.
Газовая смесь, заданная массовым составом, характеризуется массовыми долями. Массовой долей называется отношение массы i-го газа к общей массе смеси:
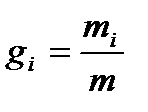
где gi – массовые доли; mi – масса i-го газа; т – масса газовой смеси.
Массовая доля может быть выражена как в долях, так и в процентах. При умножении gi на 100% получим массовую долю, выраженную в %.
Очевидно, что масса газовой смеси равна сумме масс всех входящих в неё газов (т.е. является аддитивной величиной):
Определим сумму массовых долей отдельных газов:
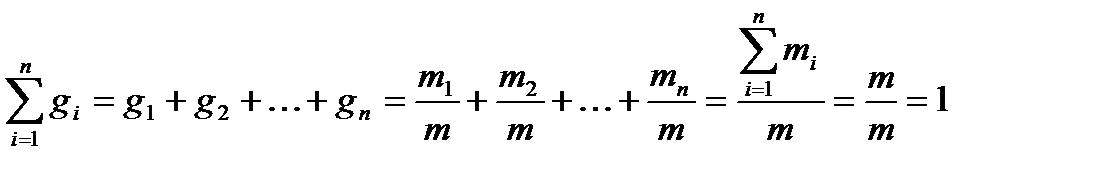
т.е. сумма массовых долей входящих в смесь газов равна 1 (или 100%).
Газовая смесь, заданная объёмным составом, характеризуется объёмными долями. Объёмная доля каждого газа выражается отношением.
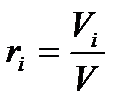
где ri – объёмная доля i-го газа; Vi – парциальный объём i-го газа; V – объём смеси газов.
Парциальным объёмом i-го газа называют объём, который занимал бы i-й газ, при температуре и давлении, равном температуре и давлению смеси газов.
Сумма парциальных объёмов газа, составляющих смесь равна объёму смеси газов (Закон Амага).
Сумма объёмных долей газов, составляющих смесь, равна 1.
По аналогии с массовыми долями, объёмные доли м. б. выражены также в процентах.
Газовая смесь, заданная мольным составом, характеризуется мольными долями. Мольной долей называется отношение количества моль i–го газа к общему числу моль газов, составляющих смесь:
где yi – мольная доля i–го газа; ni – число моль i–го газа; n – общее число моль газовой смеси.
Вполне очевидно, что сумма моль всех газов, составляющих смесь, равна общему числу моль газовой смеси, т.е.
Сумма мольных долей смеси газов равна 1.
Если известен массовый состав смеси, то по нему можно найти её мольный состав. Массы отдельных газов mi и полную массу смеси т можно выразить через число моль следующим образом:
Мольный состав газовой смеси совпадает с её объёмным составом. Так при одинаковых давлениях и температурах молярные объёмы газов одинаковы, то можно записать:
Для всей газовой смеси V = Vm n
Разделив почленно первое уравнение на второе, получим
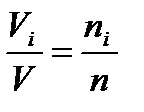
На практике часто необходим взаимный пересчёт из массовых и объёмных долей. Рекомендуется использовать следующие выражения:
Газовой смесью называют механическую смесь нескольких газов, химически не взаимодействующих между собой.



Каждый из газов называют компонентом (чистым веществом) и он ведёт себя так, как если бы другие газы в смеси отсутствовали.
Компонентом называют вещество, все молекулы которого одинаковы. Например: 

1.3.2. Состав смесей. Закон Дальтона.
Состав смесей можно выражать массовыми, мольными долями, а в газовой смеси ещё и объёмными долями компонентов смеси.
Массовой долей (концентрацией) компонента смеси называют величину, равную отношению массы данного компонента к массе всей смеси. Если смесь состоит из n компонентов, то 






Всегда сумма всех массовых долей компонентов, составляющих смесь, равна единице. (3.2) используется в качестве контрольного уравнения.
Молярной долей (концентрацией) компонента в смеси называют величину, равную отношению количества вещества компонента к количеству вещества смеси (отношение числа молей компонента к числу молей смеси).
Аналогично предыдущему запишем





Взаимосвязь между массовыми и мольными концентрациями




или 


суммируя (3.5) по всем компонентам и учитывая (3.2) и (3.4) находим


Данные уравнения позволяют определить молярную массу смеси, которую называют кажущейся, т.к. на самом деле её не существует. Она необходима для определения удельной газовой постоянной смеси Rсм.


В термодинамических расчётах реальные газы, входящие в смесь с относительно небольшими давлениями, рассматриваются как идеальные газы, при этом и сама смесь тоже рассматривается как идеальный газ, подчиняющийся закону Клайперона.
Считается, что эта смесь подчиняется также закону диффузионного равновесия, который сформулировал в 1809 году английский химик Дальтон «Каждый компонент газовой смеси распространён во всём объёме смеси при давлении, которое он развивал бы, занимая объём без участия других компонентов при температуре смеси».
Такое давление называют парциальным.
Давление смеси определится по формуле





Для газовой смеси, подчиняющейся закону Дальтона, справедливы следующие положения:
–каждый компонент имеет температуру смеси;
–каждый компонент распространён по всему объёму смеси;
–каждый газ в смеси подчиняется своему уравнению состояния;
–смесь в целом условно является как бы новым газом, подчиняющимся своему уравнению состояния.
Запишем уравнение Клайперона–Менделеева для компонента и смеси в целом, разделим их друг на друга









Объёмы компонентов уменьшатся до так называемых приведённых объёмов.
Приведёнными объёмами являются V₁иV₂ Приведённым объёмом называется объём компонента смеси при давлении и температуре смеси..