Что называется фазой сплава
Понятие сплав. Компоненты сплава. Фазы и структурные составляющие



Сплав – вещество, полученное сплавлением нескольких элементов. Другими словами, сплав – это твердое вещество, обладающее всеми признаками металлов и состоящее из 2-х и более химических элементов. Состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплавлегирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
Компонент – элемент или химическое соединение, входящее в состав сплава (элементы или химические соединения, образующие сплав). Компонент, преобладающий в сплаве количественно, называется основным. Компоненты, вводимые в сплав для придания ему нужных свойств, называются легирующими.
Фазовая составляющая (фаза) – однородная часть сплава, характеризующаяся определенным составом, свойствами, типом кристаллической решетки и отделенная от других частей сплава поверхностью раздела (при переходе через которую химический состав, структура, а, следовательно, свойства меняются скачкообразно).
Сплавы могут быть и однофазными и многофазными. Однофазные сплавы всегда состоят из кристаллов твердого раствора одного вида (состава).
В многофазных сплавах может одновременно присутствовать несколько структурных составляющих: 1) кристаллы твердого раствора (одного или нескольких составов), 2) кристаллы химических соединений, 3) кристаллы компонент сплава, 4) эвтектики и 5) эвтектоиды.
Основными структурами, составляющими железоуглеродистые сплавы, являются следующие.
Феррит – твердый раствор углерода в α-Fe. При температуре 723° С предельное содержание углерода 0,02 %. При отсутствии примесей не корродирует.
Цементит – карбид железа Fe3C – химическое соединение, содержащее 6,67 % углерода. Является составной частью эвтектической смеси, а также самостоятельной структурной составляющей. Способен образовывать твердые растворы путем замещения атомами других металлов, неустойчив, распадается при термической обработке. Цементит очень тверд (НВ 800) и хрупок.
Аустенит – твердый раствор углерода в γ–Fe. Атомы углерода внедряются в кристаллическую решетку, причем насыщение может быть различным в зависимости от температуры и примесей. Устойчив только при высокой температуре, а с примесями Mn, Сг – при обычных, даже низких температурах. Твердость аустенита НВ 170. 220.
Перлит – эвтектоидная смесь феррита и цементита, образуется при распаде аустенита при температуре 723° С и содержании углерода 0,83 %. Примеси Si и Мn способствуют образованию перлита и при меньшем содержании углерода. Твердость перлита НВ 160. 260. Структура перлита может быть пластинчатой и глобулярной (зернистой).
Ледебурит – эвтектическая смесь аустенита и цементита, образующаяся при 1130° С и содержании углерода 4,3 % Структура неустойчивая: при охлаждении аустенит, входящий в состав ледебурита, распадается на вторичный цементит и перлит. Ледебурит очень тверд (НВ 700) и хрупок.
Графит – мягкая и хрупкая составляющая чугуна, состоящая из разновидностей углерода. Встречается в серых и ковких чугунах.
1. В жидком состоянии компоненты сплава обычно неограниченно растворяются друг в друге, образуя жидкие растворы.
Фазы в металлических сплавах.
Основные понятия и определения теории сплавов.
Сплавом называют материал, образующийся в результате затвердевания расплавов, состоящих из двух или нескольких компонентов.
Сплавы могут быть получены сплавлением исходных компонентов, их спеканием, электролизом, возгонкой и другими способами. При этом свойства полученного сплава в значительной мере будут зависеть от его структуры.
Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Совокупность фаз, находящихся в состоянии равновесия, называют системой.
Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
· Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз;
· Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе.
Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса:
Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится:
С – число степеней свободы; К – число компонентов; Ф – число фаз; 1,2 – учитывает возможность изменения температуры.
Фазы в металлических сплавах.
Сплавы в зависимости от взаимодействия компонентов подразделяются на:
· смеси зерен с ограниченной растворимостью, т.е. механические смеси;
· растворы с неограниченной растворимостью компонентов, т.е. твердые растворы;
· химические соединения компонентов.
Твердый раствор – фаза, к которой один из компонентов сплава (растворитель) сохраняет свою кристаллическую решетку, а другой (другие) компонент располагается в решетке растворителя, изменяя ее размеры. Различают следующие виды твердых растворов – твердый раствор замещения и твердый раствор внедрения.
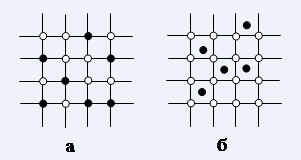
Рисунок 1. Расположение атомов в твердых растворах: а – замещения, б – внедрения (○ – атом компонента растворителя, ● – атом растворенного компонента).
При образовании твердого раствора замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке (Рис.1 а).
При образовании твердого раствора внедрения атомы растворенного компонента размещаются между атомами растворителя (Рис.1 б).
При образовании твердого раствора кристаллическая решетка всегда искажается, и периоды ее изменяются. При образовании твердого раствора замещения период решетки может увеличиваться или уменьшаться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента (Рис.2).
Рисунок 2. Искажение кристаллической решетки при образовании твердого раствора замещения.
Твердый раствор состоит из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Твердые растворы мягки и пластичны. Благодаря высокой пластичности они хорошо поддаются ковке и другим видам обработки давлением. Литейные свойства и обрабатываемость резанием у твердых растворов низкие.
Примерами твердых растворов внедрения, имеющих промышленное значение, являются твердые растворы внедрения углерода в железо.
Механическая смесь (рис. 3) образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Рисунок 3. Схема микроструктуры механической смеси.
Свойства механической смеси определяются количественным соотношением входящих в неё кристаллов компонентов. Сплавы механические смеси имеют хорошие литейные свойства.
Сплавы химические соединения образуются между элементами значительно различающимися по строению и свойствам, если сила взаимодействия между однородными атомами больше чем между разнородными.
Особенности сплавов химические соединения:
· постоянство состава, т.е. сплав образуется при определенном соотношении компонентов;
· образуется специфическая решетка с правильным упорядоченным расположением атомов, отличающаяся от решеток элементов, составляющих химическое соединение (Рис. 4);
· ярко выражены индивидуальные свойства;
Рисунок 4. Кристаллическая решетка химического соединения.
Химическим соединениям, находящимся в сплавах, свойственны повышенная твердость, хрупкость и постоянная температура плавления.
Кроме растворов и химических соединений возможно образование таких фаз, которые не могут быть полностью отнесены к перечисленным и являются промежуточными фазами.
Дата добавления: 2015-10-13 ; просмотров: 12166 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Понятие о сплавах. Фазы металлических сплавов.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекание, электролиз, возгонка. В этом случае вещества называются псевдосплавами. Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств, которые изменяются в зависимости от состава и метода обработки.
Характеристика основных фаз в сплавах
Чистые металлы обычно имеют низкую прочность и невысокие технологические свойства. В технике обычно применяются сплавы. Сплавами обычно называют сложные вещества, полученные сплавлением нескольких элементов.
Элементы или химические соединения, образующие сплав, называют компонентами. Компонентами металлических сплавов могут быть не только металлы, но и неметаллы. В зависимости от числа компонентов сплавы могут быть двойные, тройныеи т. д. В зависимости от физико-химического взаимодействия компонентов в сплавах образуются фазы, число и тип которых характеризуют состояние сплава.
Фазой называют однородную часть сплава, характеризующуюся определенным составом, свойствами, типом кристаллической решетки и отделенную от других частей сплава поверхностью раздела. Под структурой понимают форму, размеры и характер взаимного расположения фаз в сплаве. Фазовый состав и структура, определяющие свойства сплава, зависят от состава и технологии его обработки.
В сплавах возможно образование следующих фаз:
1) жидких растворов; 2) твердых чистых металлов; 3) твердых растворов; 4) химических соединений. В зависимости от количества фаз сплавы могут быть одно-, двух- и многофазными.
В жидком состоянии компоненты сплава обычно неограниченно растворяются друг в друге, образуя жидкие растворы. В твердом состоянии компоненты могут образовывать:
1) механические смеси, представляющие собой смесь двух или нескольких фаз; 2) химические соединения, когда компоненты вступают в химические взаимодействия; 3) твердые растворы, когда один компонент растворяется в другом, который называется растворителем.
Механические смеси
Химические соединения
К химическим соединениям металлов с неметаллами относят фазы с ионным типом связи и фазы внедрения.
Фазы с ионным типом связи образуются в тех случаях, когда атом металла отдает валентные электроны и становится положительным ионом, а атом неметалла (например, кислорода, серы) принимает их на свою внешнюю оболочку и становится отрицательным ионом. В такой кристаллической решетке элементы удерживаются электростатическими силами. Химические соединения этой группы имеют строго стехиометрический состав, их формулы определяются валентностью составляющих элементов. В структуре сплавов они находятся в виде неметаллических включений сульфидов, оксидов, фосфидов и т. д. Например, оксид марганца МnО, карбид железа Fe3C и др.
К P-соединениям с электронной концентрацией N1 = 3/2, обычно имеющим ОЦК решетку, относятся соединения CuZn, CuBe, Cu3Al и др. Например, для соединения CuZn N. = (1-1 + + 2 • 1)/(1 + 1) = 3/2.
К у-соединениям с электронной концентрацией 21/13 и сложной кубической решеткой относятся Cu5Zn8, Co5Zn21, Fe5Zn21. Для соединения Cu5Zng N2 = (1 • 5 + 2 • 8)/(5 + 8) = 21/13.
Электронные соединения характерны для сплавов на меднойоснове (латуней и бронз), где они являются упрочняющими фазами.
Фазы Лавеса имеют формулу АВ2. Они образуются между компонентами А и В при отношении их атомных диаметров от 1,1 до 1,6, обычно 1,2. К фазам Лавеса относятся соединения TiFe2, TiCr2, MoFe2, NbFe2, TiCo2, присутствующие в ряде жаропрочных сплавов и способствующие их упрочнению. Они имеют гексагональную плотноупакованную или гранецентрированную кубическую решетку.
Образование кристаллов о-фазы сопровождается увеличением твердости и резким охрупчиванием коррозионностойкихсталей.
Твердые растворы
Твердыми растворами называют фазы, в которых один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы других (растворяемых) компонентов располагаются в его решетке, искажая ее.
Различают твердые растворы замещения и внедрения. Твердый раствор замещения образуется замещением части атомов растворителя в его кристаллической решетке атомами растворенного компонента (рис. 1, а).
Полностью упорядоченные растворы образуются, когда отношение компонентов в сплаве составляют целые числа: 1:1, 1:2, 1:3
Рис. 1. Кристаллическая решетка ГЦК твердого раствора замещения (а) и твердого раствора внедрения (б)
Рис. 2. Размещение атомов в кристаллической решетке твердых растворов:
и т. д. Такой сплав с упорядоченной структурой можно характеризовать формулой химического соединения, например CuAu или Cu3Au.
Упорядоченные твердые растворы характеризуются более высокой твердостью и хрупкостью и могут рассматриваться как промежуточные фазы между неупорядоченными твердыми растворами и химическими соединениями.
В связи с различием в размерах атомов, при замещении атомов одного компонента атомами другого компонента происходит искажение кристаллической решетки. Это искажение тем больше, чем больше разница в размерах атомов и строенииих кристаллических решеток. При чрезмерном искажении решетки дальнейшая растворимость становится невозможной. Наступает предельная растворимость, при которой дополнительно вводимые атомы не могут войти в решетку и образуют самостоятельную фазу. Если же оба компонента имеют однотипные кристаллические решетки, а атомные диаметры различаются не более чем на 8-15 %, то возможна неограниченная растворимость.
Неограниченно растворяются в твердом состоянии такие металлы с ГЦК решеткой, имеющие небольшую разницу в атомных размерах AR, как Ag и Au (AR = 0,2 %), Ni и Си (AR = 2,7 %) и др., а также металлы с ОЦК решеткой: Мо и W (AR = 9,9 %), V и Ті (AR = 2 %). Металлы с большим атомным диаметром (Na, Са, РЬ) в Fe, Си, Ni нерастворимы.
Предельная растворимость зависит также от различия в строении валентных оболочек электронов. Одновалентные металлы полностью растворяются только в одновалентных: Cu-Ag, Ag-Au, Cu-Ni.
Ограниченная растворимость компонентов наступает при достижении критической величины электронной концентрации в
твердом растворе N, где электронная концентрация — это количество валентных электронов на атом. Для ОЦК решетки N = 1,36, для ГЦК решетки N = 1,40. Если электронная концентрация превышает эти значения, то образуется новая фаза с другой кристаллической решеткой.
Образование твердых растворов внедрения, как правило, сопровождается увеличением параметров кристаллической решетки и ее искажением.
Твердый раствор внедрения характерен для сплавов металлов с элементами 1-го и 2-го периодов, имеющими малые атомные диаметры (С, В, N, Н, О). Концентрация второго компонента в твердом растворе внедрения обычно невысока и всегда ниже, чем в твердых растворах замещения и химических соединениях этих элементов. В отличие от химических соединений твердые растворы внедрения имеют кристаллическую решетку металла-растворителя, в то время как химические соединения образуют решетку, отличающуюся от решетки металла.
Характеристика основных фаз в сплавах








Характеристика основных фаз в сплавах
В зависимости от физико-химического взаимодействия компонентов в сплаве образуется фаза, количество и вид которой характеризуют состояние сплава. Фаза представляет собой однородную часть сплава, характеризующуюся определенным составом, свойствами, типом кристаллической решетки, и отделена от остальной части сплава границей раздела. Под структурой понимают форму, размер и свойства взаимного расположения фаз в сплаве. Фазовый состав и структура, определяющие свойства сплава, зависят от состава и технологии его обработки.
В сплавах возможно образование следующих фаз: 1)жидкий раствор;2)твердый чистый металл;3)твердый раствор;4) соединение. Людмила Фирмаль
В зависимости от количества фаз, сплав может быть однофазным, двухфазным, многофазным. В жидком состоянии компоненты сплава обычно растворяются бесконечно друг с другом, образуя жидкий раствор. В твердом состоянии компоненты могут образовываться: 1) смесь двух фаз или более-это механические смеси;2) соединение, когда компоненты вступают в химическое взаимодействие;3) твердый раствор-это смесь двух фаз или более. Когда элементы, содержащиеся в сплаве, затвердевают из жидкого состояния, если они не растворяются и не взаимодействуют друг с другом, образуется механическое перемешивание. Механические смеси>образуются при кристаллизации многих сплавов, например Pb-Sb, 144ал-Си. Структура смеси неоднородна.
При металлургическом анализе на поверхности резания видны кристаллы различных компонентов, образующих механическую смесь. Химический анализ также определяет различные элементы. Методом рентгеновской дифракции были определены два типа кристаллических решеток, образующих такие смеси. Если элементы, составляющие составной сплав, взаимодействуют друг с другом, то образуется соединение. По структуре они представляют собой однородное твердое тело. Свойства соединений отличаются от свойств их компонентов. Они имеют постоянную температуру плавления (диссоциации). Рентгеноструктурный анализ выявил разницу между кристаллической решеткой соединения и исходным элементом.
Соединения этой группы имеют строго стехиометрический состав, их формула определяется валентностью составляющих элементов. В структуре сплава, они находятся в виде неметаллических включений, таких как сульфиды, оксиды, фосфиды. Например, оксид марганца MPO, карбид железа Fe3C и так далее. Фаза введения состоит из железа, марганца, хрома, вольфрама, молибдена и других металлов, а также фаз с неметаллами малого атомного диаметра, таких как углерод, азот, бор и водород. Условиями для образования введенной фазы являются: отношение атомного диаметра в неметаллах и металлах меньше 0,59.
Атомы металла размещаются на узлах решетки, а атомы не размещаются на узлах решетки- 145 металлов в октаэдрических или тетраэдрических отверстие. Людмила Фирмаль
Из-за малого объема пор тетраэдра в нем могут быть размещены только атомы водорода. Этот этап имеет простые химические формулы меня, Х (Fe4N, Mn4N), Me2x (Fe2N, Mo2c), Мекс (твердосплавные ВК, крестики, туалет, NBC и нитрида Фэн ВН олово), где me представляет собой металл, а X-неметаллические. Такие стадии введения, как карбиды и нитриды, обладают высокой твердостью. На основе стадии введения с избытком атомов металла может быть образован твердый раствор. Системы металл-металл включают электронные составные соединения (фаза перегара-четки), фазу лавеса и о-фазу. С одной стороны, электронное соединение образуется между металлом одновалентного (si, Ag, Li) металла или переходной группы (Fe, MP, Co) и металлом (A1, Be, Mg, Zn), имеющим валентность от 2 до 5. Электронное соединение представляет собой фазу переменного состава.
Этот тип соединения имеет определенную концентрацию электронов, то есть отношение числа валентных электронов к числу атомов: 3/2, 21/13, 7/4. Фазу с таким значением электронной концентрации обычно обозначают как P-фазу, u-фазу и E-фазу соответственно. К [3-электронной концентрации a=3/2 соединения обычно относятся соединения с BCC решеткой, CuZn, CuBe, Cu3Al и др. Например, в случае соединения CUZN.= (1 ■ 1 + + 2 • 1)/(1 + 1) = 3/2. Cu5zn8, Co5Zn21, Fe5Zn21 относятся к соединению U с электронной концентрацией 21/13 и сложной кубической решеткой. Соединение Cu5zng n 2= (1 ■ 5 + 2 • 8)/(5 + 8) = 21/13. Концентрация электронов 7/4 с гексагональной решеткой характерна для электронных соединений CuZn3, Cu3Sn, Cu3Si
. Для подключения cuzn3 к шестигранной решетке e N 3= (1 ■ 1 + 2 • 3) /(1 + 3) = 7/4. Электронные соединения характерны для сплавов на основе меди (латуни и бронзы), где они усиливают фазу. Стадия лавеса имеет формулу AB2. Они образуются между компонентами а и в от 1,1 до 1,6, обычно 1,2 при соотношении их атомных диаметров. Фаза Лавеса находится в ряде жаропрочных сплавов и содержит соединения tife2, TiCr2, MoFe2, NbFe2, TiCo2, которые способствуют упрочнению. Они имеют шестиугольную плотную или гранецентрированную кубическую решетку. Сигма-фаза, образованная на основе металлов с близким атомным диаметром (например, о-фаза системы Fe-SG), характеризуется очень медленным охлаждением при 600-800 ° с или высоким содержанием хрома в сплаве при изотермической выдержке.
Твердый раствор-это фаза, в которой один из компонентов (растворитель) удерживает свою кристаллическую решетку, а атомы другого(растворимого) компонента располагаются в ее решетке, искажая ее. Химический анализ твердых растворов показывает, что одним типом решетки с однородным кристаллическим зерном является несколько элементов, таких как металлический растворитель, а также металлографическая и рентгеновская дифракция. Существуют твердые растворы замещения и внедрения. Твердый замещающий раствор образуется путем замены части атомов растворителя в его кристаллической решетке атомами растворенного компонента(рис. 4.1, а).
Атомы растворенных элементов обычно не занимают особого места в кристаллической решетке, а только атомы растворителя некоторых узлов. Такое расположение атомов называется беспорядком(рис. 4.2, а). Он образуется, когда взаимодействие разнородных элементов твердого раствора недостаточно выражено. Когда атомы различных элементов в твердых растворах взаимодействуют несколько сильнее, чем однородные, они имеют тенденцию располагаться в определенном порядке. Атомы растворителя и растворенных элементов расположены на разных кристаллических плоскостях. Например, в системе Au-si после медленного охлаждения расплава некоторые кристаллографические плоскости полностью состоят из атомов меди и состоят из других атомов золота. 4.2, б).
Его называют твердым раствором, таким как: Полностью упорядоченные растворы формируются при целочисленном соотношении компонентов сплава: 1:1, 1:2, 1:3 Рис 4.1. Кристаллическая решетка замещенного твердого раствора ГЦК (А) и интегрированного твердого раствора (Б)) Рис 4.2. Расположение атомов в кристаллической решетке твердого раствора: а-неровности (сплав cu-Au); б-ордорность (сплав cu-Au); в-вычитание решетки твердого раствора Незаполненный узел решетки Сплавы с такой регулярной структурой могут характеризоваться формулой соединений, например, CuAu или Cu3Au. Упорядоченный твердый раствор характеризуется высокой твердостью и хрупкостью и считается промежуточной фазой между неупорядоченным твердым раствором и соединением.
Из-за разницы в размерах атомов, когда атомы одного компонента заменяются атомами другого, кристаллическая решетка искажается. Это искажение настолько велико, что разница в размерах атома и структуре его кристаллической решетки больше. Кроме того, когда искажение решетки чрезмерно, растворимость становится невозможной. Конечная растворимость происходит еще дальше, когда введенный атом входит в решетку и не может образовать независимую фазу. Если оба компонента имеют одинаковый тип кристаллической решетки, а атомы различаются по диаметру от 8 до 15% и менее, то возможна неограниченная растворимость. Металлы с такими ГЦК решетками имеют незначительную разницу в атомных размерах АВ, таких как Ag и Au(LV=0,2%), Ni и si (AB=2,7%) и др.
Подобно металлам с ГЦК решетками, МО и W (AB=9,9%), V и Ti (AB=2%) бесконечно растворяются в твердом состоянии. Металлы с большими атомными диаметрами (Na, CA, R) Fe, si, Ni нерастворимы. Конечная растворимость также зависит от различия в структуре валентной оболочки. Одновалентных металлов полностью растворяются только в моновалентных КР-АГ, АГ-п, медно-никелевый. Ограниченная растворимость компонентов возникает при достижении критического значения электронной концентрации Концентрация электронов в растворе составляет 148 Н, что соответствует числу валентных электронов на атом. Для ОЦК решетки в N=1.36,для ГЦК решетки Н=1.40.
Если концентрация электронов превышает эти значения, то образуется новая фаза с другой кристаллической решеткой. Например, из диаграммы состояния si-Zn известно, что предел растворимости Zn в si составляет 39%. Для сплавов, содержащих 61% si и 39% Zn, N= (61 • 1 + 39 ■ 2)/100 = 1,39, это меньше, чем предельное значение 1,40. Твердый раствор образуется путем встраивания атомов растворенного компонента в междоузлия(пустоты) кристаллической решетки (рис. 4.1, б). В решетке ГЦК такие пустоты находятся в центре куба, образуя сферу диаметром 0,42), где D-диаметр атома растворителя. В ОЦК решетке пустоты расположены в центре Грани, образуя сферу диаметром 0,290. Образование твердого раствора воды, как правило, сопровождается увеличением параметров кристаллической решетки и ее искажением.
Твердый раствор не характерен для металлических сплавов с элементами 1-й и 2-й ступеней с малым атомным диаметром (C, B, N, H, O). Концентрация второго компонента в твердом растворе введения обычно ниже, чем при замещении этих элементов и твердого раствора соединения, всегда ниже. В отличие от соединений, твердые растворы не имеют кристаллической решетки растворителей металлов, а соединения образуют решетку, отличную от металлической решетки. На основе соединения-стадии введения может образовываться твердый раствор вычитания (рис. Его иногда называют твердым раствором с дефектной решеткой 4.2, б).
В таком твердом растворе число атомов растворителя уменьшается, и в решетке появляются свободные узлы. Субтрактивный раствор твердых тел образуется путем растворения атомов V, Ti, Nb, Zr в Карбидах VC, TiC, NbC, ZrC узлов, которые ранее были заняты атомами углерода. Атомы растворенного элемента накапливаются преимущественно в кристаллической решетке вблизи дислокаций, уменьшая их упругую энергию(рис. 4.3). В замещающем растворе атомы меньшего размера, чем растворитель, присутствуют в области сжатой решетки, а атомы большего размера присутствуют в зоне расширения. При образовании твердого раствора эти атомы располагаются в зоне растянутой решетки, под экстрапланой. Ближе к развертыванию они образуют группу в виде облака, называемого атмосферой Коттрелла.
Такое расположение 149 стр. 4.3. Положение атома замещения (D) и вложение (B)в область дислокации В Это сопровождается уменьшением деформации кристаллической решетки, что соответствует запасу минимальной свободной энергии. Присутствие атомов в атмосфере Котрелла вблизи дислокации тормозит их миграцию в кристаллической решетке твердого раствора и повышает его прочность. Дальнейшее напряжение необходимо для того, чтобы дислокации отошли от атмосферы Котрелла. Границы блоков и частиц являются местами скопления дислокаций и окружающей их атмосферы Котрелла, благодаря чему они оказывают большое влияние на прочность твердого раствора. Закон существования устойчивой фазы в равновесии определяется фазовым законом Гиббса.
Фазовый закон, устанавливающий количественную зависимость между числом фаз F, числом компонентов K и числом степеней свободы C, позволяет прогнозировать процессы, происходящие в сплавах при нагреве и охлаждении, и определять число фаз систем в этих условиях. Фазовый закон выражается формулой C=K+P-F. Понимается количество внешних Р (температура, давление) и внутренних (концентрация) факторов, которые могут изменяться без изменения числа фаз равновесия, под числом степеней свободы или изменчивостью системы. В случае металлических сплавов внешним коэффициентом равновесия является только температура, поскольку при работе в атмосферных условиях давление практически постоянно. Итак, для металлического сплава правило фазы принимает вид: C=K+1-F.
исперсия не может быть отрицательной. Поэтому для равновесия металлических сплавов необходимо, чтобы число фаз в их структуре не превышало 1 числа компонентов. Из этой формулы следует, что в случае кристаллизации чистого металла, если имеются две фазы (жидкая и твердая), C=K+1-f=1 + 1 — 2 =0. Эта система неизменна. Обе фазы находятся в равновесии при строго определенной температуре (температуре затвердевания). Температура меняется только тогда, когда исчезает любая из фаз. Если чистый металл находится в жидком состоянии, и существует только одна жидкая фаза, то число степеней свободы будет равно 1 (моновариантная система): C=K+1-f=1 + 1 — 1 =1. Наличие определенной степени свободы указывает на возможность изменения температуры в определенных пределах без изменения числа фаз. В двойной системе следует правило фазы, что число одновременно существующих фаз не может превышать 3. В большем количестве фаз сплав не приходит к равновесию. Правило фазы используется при построении диаграммы состояния сплава.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института