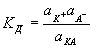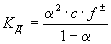Что называется электролитической диссоциацией или ионизацией
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Полезное
Смотреть что такое «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ» в других словарях:
электролитическая диссоциация — Диссоциация р р. веществ в растворе или расплаве электролитов. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN electrolytic dissociation … Справочник технического переводчика
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — см … Большая политехническая энциклопедия
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — полный или частичный распад молекул растворенного вещества на ионы в результате взаимодействия с растворителем. Обусловливает ионную проводимость растворов электролитов … Большой Энциклопедический словарь
электролитическая диссоциация — – полный или частичный распад растворенного вещества на ионы. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролитическая диссоциация — – полный или частичный распад молекул растворенного вещества в результате взаимодействия с растворителем; обусловливает ионную проводимость растворов электролитов. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ… … Энциклопедия терминов, определений и пояснений строительных материалов
Электролитическая диссоциация — ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад растворенного вещества на ионы в результате взаимодействия с растворителем. Обусловливает электропроводность электролитов. … Иллюстрированный энциклопедический словарь
Электролитическая диссоциация — У этого термина существуют и другие значения, см. Диссоциация. Электролитическая диссоциация процесс распада электролита на ионы при его растворении или плавлении. Содержание 1 Диссоциация в растворах 2 … Википедия
электролитическая диссоциация — полный или частичный распад молекул растворённого вещества на ионы в результате взаимодействия с растворителем. Обусловливает ионную проводимость растворов электролитов. * * * ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный… … Энциклопедический словарь
электролитическая диссоциация — elektrolitinė disociacija statusas T sritis chemija apibrėžtis Ištirpintos medžiagos virtimas jonais jai sąveikaujant su tirpiklio molekulėmis. atitikmenys: angl. electrolytic dissociation rus. электролитическая диссоциация … Chemijos terminų aiškinamasis žodynas
электролитическая диссоциация — elektrolitinė disociacija statusas T sritis fizika atitikmenys: angl. electrolytic dissociation vok. elektrolytische Dissoziation, f rus. электролитическая диссоциация, f pranc. dissociation électrolytique, f … Fizikos terminų žodynas
Электролитическая диссоциация
Полезное
Смотреть что такое «Электролитическая диссоциация» в других словарях:
электролитическая диссоциация — Диссоциация р р. веществ в растворе или расплаве электролитов. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN electrolytic dissociation … Справочник технического переводчика
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — см … Большая политехническая энциклопедия
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — полный или частичный распад молекул растворенного вещества на ионы в результате взаимодействия с растворителем. Обусловливает ионную проводимость растворов электролитов … Большой Энциклопедический словарь
электролитическая диссоциация — – полный или частичный распад растворенного вещества на ионы. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролитическая диссоциация — – полный или частичный распад молекул растворенного вещества в результате взаимодействия с растворителем; обусловливает ионную проводимость растворов электролитов. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ… … Энциклопедия терминов, определений и пояснений строительных материалов
Электролитическая диссоциация — ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад растворенного вещества на ионы в результате взаимодействия с растворителем. Обусловливает электропроводность электролитов. … Иллюстрированный энциклопедический словарь
Электролитическая диссоциация — У этого термина существуют и другие значения, см. Диссоциация. Электролитическая диссоциация процесс распада электролита на ионы при его растворении или плавлении. Содержание 1 Диссоциация в растворах 2 … Википедия
электролитическая диссоциация — полный или частичный распад молекул растворённого вещества на ионы в результате взаимодействия с растворителем. Обусловливает ионную проводимость растворов электролитов. * * * ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный… … Энциклопедический словарь
электролитическая диссоциация — elektrolitinė disociacija statusas T sritis chemija apibrėžtis Ištirpintos medžiagos virtimas jonais jai sąveikaujant su tirpiklio molekulėmis. atitikmenys: angl. electrolytic dissociation rus. электролитическая диссоциация … Chemijos terminų aiškinamasis žodynas
электролитическая диссоциация — elektrolitinė disociacija statusas T sritis fizika atitikmenys: angl. electrolytic dissociation vok. elektrolytische Dissoziation, f rus. электролитическая диссоциация, f pranc. dissociation électrolytique, f … Fizikos terminų žodynas
Какой процесс называется электролитической диссоциацией
Чистая вода не является проводником тока. Проводимость у нее появляется благодаря растворенным примесям. Происходит это в случае, когда растворенное вещество является электролитом, т.е. способно распадаться на ионы — разноименно заряженные частицы.
Электролитическая диссоциация — что это в химии, теория
С давних времен люди обращали внимание на способность некоторых растворов проводить электрический ток. Этим свойством обладают не все растворы. Например, раствор поваренной соли в воде является отличным электропроводником; растворы уксусной кислоты, как и растворы углекислого и сернистого газов, проводят ток немного хуже. А растворы спирта, сахара и ряда прочих веществ не проводят ток вовсе.
М. Фарадей в XIX веке (30-е годы) изучал эти процессы. Он ввел термин «электролит», в значение которого вложил понятие о веществе, способном к электропроводности в растворенном или расплавленном виде. Его авторству принадлежат также термины «катион», «анион», «ион», «электролиз».
Электролит — вещество, способное проводить электрический ток в растворе и расплаве. Такая возможность обуславливается наличием в растворах и расплавах частиц, имеющих заряд — ионов.
Электролитическая диссоциация — физический процесс, при котором в растворе или при плавлении происходит распад веществ на ионы.
Однако о том, что именно ионы являются причиной проводимости, стало известно гораздо позже. Тогда считали, что молекулы распадаются на частицы вследствие воздействия электрического тока, после чего эти частицы приобретают электрический заряд.
В 1887 году Сванте Аррениус (шведский ученый) выдвинул гипотезу, что в растворе молекулы распадаются на ионы, которые притягиваются и двигаются к двум разноименно заряженным электродам — катоду и аноду. По его мнению, в этом заключалась причина появления электропроводности у растворов.
С. Аррениус был сторонником физической теории растворов. Он считал, что в растворе содержатся ионы в свободном виде. Не мог согласиться с Аррениусом Д.И.Менделеев. По его «химической» теории растворов, в них происходят химические реакции, в которых задействованы растворенные вещества и растворители. А в 1889 году Менделеев написал «Заметку о диссоциации растворенных веществ», где высказывал сомнения о протекании процессов распада электролитов в растворах.
Согласно современным представлениям при растворении вещества диссоциируют, т.е. распадаются на ионы. При этом также протекает процесс гидратации — взаимодействия ионов с водой, в результате которого образуются ассоциаты ионов с молекулами Н 2 О (гидратированные ионы).
Аналогичные процессы протекают в растворах, к примеру, серной кислоты.
Виды электролитов, какие бывают
В химии существует классификация электролитов в зависимости от их способности к диссоциации и типа образующихся ионов. Различают виды:
Беря за основу силу электролита, различают сильные (неассоциированные) и слабые (ассоциированные) электролиты. Сильные — вещества с ионным или ковалентным сильно полярным типом связи, растворимые соли, щелочи (растворимые основания), сильные кислоты. Они легко необратимо распадаются на ионы, их степень диссоциации более 0,5 (50%). Слабые — вещества с ковалентной слабополярной связью, распадаются с трудом, степень диссоциации составляет менее 0,1 (10%).
Cуществуют также вещества, имеющие промежуточное значение степени диссоциации — от 10 до 50%. Их можно назвать электролитами средней силы.
Для ассоциированных электролитов, в свою очередь, существует классификация на типы, а именно:
Как определить степень диссоциации, уравнение
В растворах электролитов могут содержаться как ионы, так и недиссоциированные частицы. Соотношение продиссоциировавших и недиссоциированных частиц получило название степени диссоциации. Обозначение — α (альфа).
Степень диссоциации — величина, показывающая отношение количества электролита, который распался на ионы, к его общему количеству электролита в растворе.
Величина степени диссоциации конкретных веществ определяется экспериментальным путем. Единицей для измерения этой величины является доля единицы или процент. Каждый электролит характеризуется различной степенью диссоциации, которая определяется:
Для сильных электролитов свойственен практически полный распад на ионы, их степень диссоциации в разбавленных растворах стремится к единице. В растворах слабых электролитов степень диссоциации незначительна и стремится к нулю.
Уравнение диссоциации сильного электролита выглядит следующим образом:
Для слабых электролитов уравнение их распада на ионы будет выглядеть так:
Рассмотрим пример решения задач на определение степени диссоциации электролита:
Для решения задачи составляем уравнение диссоциации:
Константа диссоциации не зависит от концентрации раствора, однако находится во взаимосвязи с температурой и природой самого растворителя. По закону Оствальда можно записать:
Классификация и некоторые особенности диссоциации кислот, оснований, солей
Кислотный остаток — это отрицательные ионы (анионы), образующиеся при диссоциации кислот.
В зависимости от числа атомов водорода в молекуле кислоты выделяют кислоты различной основности. Примеры:
При этом в случае многоосновных кислот процесс отделения катионов Н+ не происходит одномоментно. Сначала отщепляется один ион водорода, следом — второй и третий (в зависимости от количества атомов водорода в молекуле).
Таким образом, диссоциация двухосновной кислоты происходит в две ступени:
Аналогично в три ступени проходит диссоциация трехосновной кислоты. При этом степень диссоциации максимальна для первой ступени. Каждая последующая стадия протекает хуже, чем предыдущая.
Диссоциация слабых многокислотных оснований, аналогично кислотам, протекает ступенчато:
Соли распадаются в водном растворе на катионы (металлы) и анионы (кислотные остатки). Существует классификация солей по составу:
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация