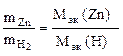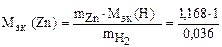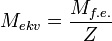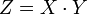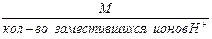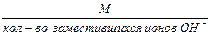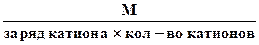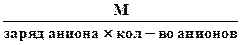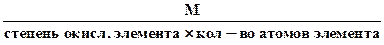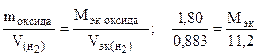Что называется эквивалентной массой элемента
Эквивалент элемента
Эквивалент вещества — его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на основность(число ионов водорода) кислоты. Например, эквивалент H2SO4 равен ее молярной массе, деленной на два. Эквивалент соли равен ее молярной массе, деленной на произведение зарядов образующих ее катионов и анионов. Например, эквивалент Na3РО4 равен его молярной массе, деленной на три.
В реакциях окисления-восстановления эквивалент окислителя равен частному от деления его молярной массы на число электронов, получаемое атомом восстановленного элемента. Например, в кислой среде КМnО4 восстанавливается до Мn(II), атом марганца в KMnO4 приобретает пять электронов и его эквивалент равен молярной массе, деленной на пять. В зависимости от числа принятых окислителем электронов эквивалент может быть различным. Так, в среде, близкой к нейтральной, атом марганца в КМnО4 приобретает три электрона, переходя в MnO2, и в этом случае эквивалент KMnO4 будет равен его молярной массе, деленной на три.
Используя понятие эквивалента, можно производить расчёты количеств взаимодействующих веществ без написания и уравнивания химических уравнений.
См. также
Смотреть что такое «Эквивалент элемента» в других словарях:
эквивалент элемента — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN dummy element … Справочник технического переводчика
химический эквивалент элемента — [chemical equivalent of element] его масса (выраженная в углеродных единицах), которая присоединяет или замещает одну атомную масса водорода или половину атомной массы кислорода. В реакциях окисления восстановления химический эквивалент… … Энциклопедический словарь по металлургии
Эквивалент никеля и хрома — множитель, учитывающий влияние элементов, способствующих превращению (ферритизации) или препятствующих этому превращению (аустенизации) в Cr Ni сталях. К аустенитообразующим элементам, т. е. действующим аналогично Ni, относятся С, N, Mn; к… … Энциклопедический словарь по металлургии
Эквивалент — [equivalent] предмет или количество, равноценные, равнозначные или соответствующие в каком либо отношении другим и могущие служить или выражением, или заменой: Смотри также: Эквивалент никеля и хрома электрохимический эквивалент хромовый… … Энциклопедический словарь по металлургии
ЭКВИВАЛЕНТ — (ново лат., от aeque равно, и valere стоить). 1) в химии: число, обозначающее количество какого нибудь вещества, которое может заменить собою другое вещество в известном химическом соединении, причем характер и свойства последнего останутся те же … Словарь иностранных слов русского языка
ЭКВИВАЛЕНТ — (1) химический масса хим. элемента, которая присоединяет или замещает массу водорода, равную его атомной массе (1,0079) (или массу кислорода, равную половине его атомной массы). Так, хим. Э. хлора в НСl равен атомной массе хлора (35,45).… … Большая политехническая энциклопедия
Эквивалент (химия) — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно… … Википедия
Эквивалент вещества — Эквивалент вещества или Эквивалент это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно восстановительных… … Википедия
Эквивалент(химия) — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент химический — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент (химия)
Эквивалент (химия)
Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H + в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Содержание
Фактор эквивалентности
Эквивалентом является частица ½Zn(OH)2. Число ½ получило название фактора эквивалентности и может обозначаться, как «fэкв«. или «z».
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Молярная масса эквивалента вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Эквивалент — условная частица вещества, в целое число раз Z меньшее формульной единицы (Z — число эквивалентов; показывает, во сколько раз эквивалент меньше формульной единицы).
| вещество | реакция | |||
|---|---|---|---|---|
| простое ˆ | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| X | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
| Y | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
ˆ — для инертных газов Z = 1
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов: все вещества реагируют в эквивалентных отношениях. Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кисло-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Ссылки
Полезное
Смотреть что такое «Эквивалент (химия)» в других словарях:
Эквивалент(химия) — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент — – равнозначащий, равносильный продукт. Эквивалентность особенно важна при сравнении товаров и их обмене друг на друга. С этой целью применяются товарные эквиваленты, то есть товары, равноценные другим,… … Энциклопедия терминов, определений и пояснений строительных материалов
ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ — условная частица, в целое число раз меньшая (или равная) соответствующей ей формульной единицы атома, молекулы, иона, радикала и др. В одной формульной единице в ва В может содержаться z(B) Э. х. этого в ва. Число z(B) (эквивалентное число)… … Химическая энциклопедия
ХИМИЯ. РАСТВОРЫ И РАСТВОРИМОСТЬ — Благодаря неравномерному распределению электрического заряда в молекулах, т.е. наличию у них отрицательных и положительных полюсов (если говорить более строго дипольного момента), даже нейтральные в целом молекулы притягиваются друг к другу. Сила … Энциклопедия Кольера
Электрохимический эквивалент — масса вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества: где постоянная Фарадея … Википедия
химический эквивалент — – реальная или условная частица вещества x, которая эквивалентна одному иону водорода в данной кислотно основной реакции или одному электрону в данной окислительно восстановительной реакции. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Углеродный эквивалент — – условная величина содержания углерода, получаемая из набора основных химических элементов арматурной стали. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г. 110 стр.] … Энциклопедия терминов, определений и пояснений строительных материалов
Периодическая законность химических элементов — После открытий Лавуазье (см.) понятие о химических элементах и простых телах так укрепилось, что их изучение положено в основу всех химических представлений, а вследствие того взошло и во все естествознание. Пришлось признать, что все вещества,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЭКВИВАЛЕНТНАЯ МАССА — (химический эквивалент). Эквивалентная масса элемента это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических… … Энциклопедия Кольера
Что называется эквивалентной массой элемента
1 . Атомная масса. Молекулярная масса
Атомной массой элемента называется масса его атома выраженная в атомных единицах массы. Иными словами, атомная масса показывает, во сколько раз масса данного атома больше 1/12 массы атома 12 С. Так атом азота в 14/12 раза тяжелее атома углерода.
Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Например М(СО2) = 44 а.е.м.
До 1961 года для измерения атомных масс использовалась кислородная единица (к. е.), равная 1/16 атома кислорода. Введение углеродной шкалы атомных масс вместо кислородной связано с различием эталонов физической и химической атомных шкал. При масс-спектроскопических измерениях атомных масс в качестве единицы измерения принималась 1/16 массы изотопа кислорода-16, а в основе химической шкалы была 1/16 средней массы атома природного кислорода, состоящего из смеси изотопов 16 О, 17 О, 18 О. Поэтому величины некоторых констант рассчитанные по физической и химической шкалам были различными. Кроме того изотопный состав природного кислорода также непостоянен. В связи с чем и был осуществлён переход на углеродную единицу.
Зная формулу химического соединения, можно рассчитать его молекулярную массу как сумму масс всех входящих в неё атомов. Например:
М(H2SO4) = 1 · 2 + 32 + 16 · 4 = 98 а.е.м.
Широко применяется в химии и единица количества вещества — моль.
Моль — это количество вещества содержащее столько структурных единиц (атомов, молекул, ионов, электронов и др.), сколько их содержится в 12 г изотопа углерода-12.
Чтобы представить себе, как велико число Авогадро, допустим, что нам удалось пометить все молекулы, содержащиеся в одном моле воды (18 г). Если эту воду вылить в океан и дождаться, когда воды Мирового океана перемешаются, то набрав в любом месте стакан воды, мы найдём в нём примерно 100 меченых молекул.
Масса одного моля вещества называется его молярной массой. Молярную массу обычно выражают в граммах на моль (г/моль) или килограммах на моль (кг/моль). Так, М(СаСО3) = 100 г/моль = 0,1 кг/моль.
Моль любого вещества содержит одно и тоже число структурных элементов независимо от его химических свойств и агрегатного состояния.
Из этого следует, что моль молекул различных газов при одних и тех же условиях занимает одинаковый объём. Этот вывод был подтверждён опытными данными.
Объём, занимаемый одним молем газа при нормальных условиях (температура 0 °С, давление 760 мм рт. ст. или 101325 Па) называют мольным объёмом. Он равен 22,4 литра.
2 . Закон эквивалентов
Закон постоянства состава позволил установить количественные соотношения, в которых различные химические элементы соединяются между собой, Д. Дальтон ввёл в науку понятие о соединительных весах элементов, впоследствии названных эквивалентами.
Эквивалентной массой элемента называют такое его количество, которое соединяется единицей (точнее 1,008)массы водорода или с 8 единицами массы кислорода или замещает эти же количества в их соединениях.
Теперь эквивалентом элемента называют такое его количество, которое взаимодействует с 1 молем атомов водорода. Например, в соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота и углерода равен соответственно 1, 1/2, 1/3 и 1/4 моль. Масса 1 эквивалента элемента называется эквивалентной массой. В приведённых выше примерах эквивалентная масса хлора равна 35,5 г/моль, серы — 16 г/моль, азота — 4,67 г/моль, углерода — 3 г/моль. Из опытных данных следует, что единица массы водорода эквивалентна (равноценна) 8 единицам массы кислорода, или 16 единицах массы серы или 9 единицам массы алюминия, или 35,5 единицам массы хлора и т. д.
Важной характеристикой химического элемента является его валентность. Валентностью называется свойство атомов данного элемента присоединять или замещать в соединении определённое число атомов другого элемента. За единицу валентности принята валентность атома водорода, которая во всех соединениях равна единице. Валентность элемента выражается только целым числом.
Величина обратная к валентности называется числом эквивалентности:
Валентность, эквивалентная масса и молярная масса связаны соотношением:
Из этого уравнения следует, что эквивалентная масса элемента можно рассчитать, разделив мольную массу атомов элемента на его валентность.
Введение в химию понятия эквивалент позволило сформулировать закон эквивалентов:
вещества вступают в реакцию в количествах, пропорциональных их эквивалентам.
При решении некоторых задач удобно пользоваться другой формулировкой закона: массы реагирующих веществ пропорциональны их эквивалентным массам.
Для определения эквивалентной массы элемента необходимо знать состав его соединения с другим элементом, эквивалентная масса которых известна.
1. Определим эквивалентную массу и эквивалент кальция, если известно, что при сгорании 0,5 г этого металла образуется 0,7 г оксида.
Следовательно оксид содержит 0,5 г металла и 0,2 г кислорода, а эквивалентная масса кислорода 8 г/моль, отсюда:
0,5 г металла взаимодействует с 0,2 г кислорода,
а M(1/z)(Ca) взаимодействует c 8 г кислорода
Эквивалент кальция равен 1/2.
2. Определить M(1/z)(Al) и эквивалент алюминия, зная, что в хлориде алюминия содержится 20,2 % алюминия.
Хлор в соединениях с металлами имеет валентность 1, следовательно M(1/z)(Cl) = 35,5 г/моль, отсюда:
M(1/z)(Al) соединяется с 35,5 г хлора,
а 20,2 г соединяется с 79,8 г
Эквивалент алюминия равен 1/3.
Если один элемент образует с другим элементом несколько соединений, то его эквивалентная масса в этих соединениях неодинакова. Например, сера с кислородом образует диоксид серы SO2 и триоксид серы SO3. В первом соединении на 8 единиц массы кислорода приходится 8 единиц массы серы. В триоксиде серы на 8 единиц массы кислорода приходится 5,3 единицы массы серы. Следовательно, в диоксиде серы её эквивалент равен 1/4 моль, а в триоксиде 1/6 моль.
Понятие об эквиваленте и эквивалентной массе распространяются и на сложные вещества. Химическим эквивалентом сложного вещества называют такое количество его, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
При решении задач на вычисление эквивалентных масс необходимо иметь в виду следующее:
1) эквивалентная масса оксида равна сумме эквивалентных масс кислорода и элемента, входящего в состав оксида;
2) эквивалентная масса кислоты равна сумме эквивалентных масс водорода и кислотного остатка;
3) эквивалентная масса основания равна сумме эквивалентных масс металла и гидроксильной группы;
4) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка.
Для вычисления эквивалентной массы кислоты необходимо разделить её мольную массу на основность кислоты, которая для данной реакции определяется числом атомов водорода, замещающихся металлом.
Так, ортофосфорная кислота Н3РО4 в зависимости от условий протекания реакций может быть вступать как одно-, двух- или трёхосновная. Так при образовании дигидрофосфата, гидрофосфата и фосфата эквивалент фосфорной кислоты будет соответствовать 1, 1/2 и 1/3 моль.
Чтобы вычислить эквивалентную массу основания, необходимо его молярную массу разделить на кислотность основания, определяемую числом вступающих в реакцию гидроксильных групп.
M(1/z)(NaOH) = M ( NaOH )/1= 40 г/моль;
Из приведённых примеров следует, что эквивалентная масса сложного вещества в общем случае не является величиной постоянной, а зависит от химической реакции, в которой принимает участие данное соединение.
Если в реакции принимают участие газообразные вещества, пользуются понятием об эквивалентном объёме, т. е. объёме, который занимает при данных условиях один эквивалент газообразного вещества. Так, при нормальных условиях эквивалентный объём водорода равен 11,2 л, эквивалентный объём кислорода — 5,6 л.
Семинар-погружение «Химический эквивалент»
Цель: познакомить учащихся с понятием «эквивалент» и его применением.
Эквивалентом (Э) называется весовое количество элемента, соединяющееся с одной (точнее, 1,008) весовой частью водорода или замещающее ее в соединениях. Следовательно, состав всякого соединения может быть выражен целыми числами эквивалентов входящих в него элементов.
Нахождение численных значений эквивалентов не представляет трудностей, если известен процентный состав соединения данного элемента с другим, эквивалент которого уже установлен.
Эквивалентной массой (Эm) называется масса 1 эквивалента вещества.
Вычислите эквивалентный вес кислорода, исходя из процентного состава воды: 11,2% водорода, 88,8% кислорода.
Если на 11,2 вес. ч. водорода приходится 88,8 вес. ч. кислорода, то на 1,008 вес. ч. водорода придется Э вес. ч. кислорода. Очевидно, что
Эm = 1,008*88,8: 11,2 = 8,0 и будет эквивалентным весом кислорода.
Вычислите эквивалентный вес меди, исходя из процентного состава оксида: 79,9% меди и 20,1% кислорода.
Для вычисления эквивалента меди составляем пропорцию:
на 79,9 вес. ч. меди приходится 20,1 вес. ч. кислорода
на Э вес. ч. меди приходится 8,0 вес. ч. кислорода
Эm = 8,0*79,9 : 20,1 = 31,8 и будет эквивалентным весом меди.
Определить эквивалент и эквивалентные массы элементов в соединениях HBr, H2O, CH4, NH3.
Исходя из мольных масс атомов этих элементов, находим, что эквивалентные массы равны Эm(Br) = 79,9 г/моль, Эm(O) = 8 г/моль, Эm(N) = 4,67 г/моль, Эm(С) = 3 г/моль.
Эm (элемента) = М (элемента) / Валентность
Формулы для вычисления эквивалентных масс сложных веществ:
Эm (оксида) = Число атомов элемента * Валентность элемента
Эm (кислоты) = основность кислоты которое отдает молекула кислоты, реагируя с основанием.
Эm (основания) = кислотность основания которое присоединяет молекула основания, реагируя с кислотой
Необходимо обратить внимание на то, что эквивалент и эквивалентная масса кислоты и основания зависят от конкретной реакции, в которую они вступают.
Так при взаимодействии серной кислоты и гидроксида натрия с образованием кислой соли серная кислота проявляется свойства одноосновной кислоты, следовательно, ее эквивалент равен 1, а Эm (H2SO4) = M (H2SO4) = 98 г/моль.
А в случае образования средней соли, соответственно: эквивалент равен 1/2,
а Эm (H2SO4) = M (H2SO4) /2 = 98/2 г/моль = 49 г/моль.
Важность понятия эквивалент для химии определяется тем, что элементы всегда соединяются между собой в определенных весовых количествах, соответствующих (пропорциональных) их эквивалентам (закон паев, позднее закон эквивалентов).
При решении задач более удобно пользоваться другой формулировкой:
Массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам).
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества.
Эквивалентный объем H2, Cl2, Br2, I2, F2 равен Эv = 22,4 л/моль * 1/2 = 11,2 л/моль
Эквивалентный объем О2 равен Эv = 22,4 л/моль * 1/4 = 5,6 л/моль
ПРИМЕНЕНИЕ ПОНЯТИЯ «ЭКВИВАЛЕНТ»:
Решение задач на определение неизвестного вещества.
При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определите металл.
m (MexOy) = 9,44 г
При взаимодействии металла с кислородом теоретически может получиться оксид с валентностью металла от 1 до 8. Практически же наиболее вероятно получение оксида с валентностью до 4.
5,00/А моль 0,13875 (моль)
2x моль y моль 2 моль
Обозначим M(Me) = А г/моль
Определим n (Me) = 5,00/А (моль)
Методом подбора будем определять возможные значения:
Таким образом, искомый металл алюминий.
Составим уравнение реакции: 4Al + 3O2 = 2Al2O3
m (MexOy) = 9,44 г
Зная, что Эm(O)= 8 г/моль составим уравнение для закона эквивалентов:
Выразим Эm(Ме) = Эm(O)* m (Me)/ m (О) и найдем значение:
Методом подбора будем определять возможные значения:
M(Me) = Эm (Me) * валентность(Me)
Таким образом, искомый металл алюминий.
Составим уравнение реакции: 4Al + 3O2 = 2Al2O3
Второй способ значительно проще.
В аналитической химии понятие эквивалент широко применяется в количественном анализе.
Количественные отношения веществ в титриметрическом анализе основаны на законе эквивалентов: В химической реакции с n эквивалентами одного вещества всегда вступает во взаимодействие n эквивалентов второго и образуется n эквивалентов каждого из продуктов реакции.
Для иллюстрации приведем ряд химических реакций:
KOH + HCl = KCl + H2O
1 экв. 1 экв. 1 экв. 1 экв.
2 экв. 2 экв. 2 экв. 2 экв.
3 экв. 3 экв. 3 экв. 3 экв.
6 экв. 6 экв. 6 экв. 6 экв.
Задача: На нейтрализацию 0,2299 г кислоты израсходовано 0,1460 г гидроксида натрия. Определить кислоту.
Для расчетов удобно пользоваться формулой: Vк-ты* Сщ-чи = Vщ-чи * С к-ты
Эквиваленты и эквивалентные массы



Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов: массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы.
Математическое выражение закона эквивалентов:
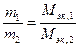
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента) = 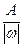
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn)=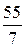
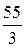
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты =
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэк основания =
Пример 6. Определить эквивалентную массу H2SO4 в реакциях:
Решение. В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли =
или Мэк соли =
4. Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида =
Например, Z(Fe2O3) = 3 × 2 = 6, Мэк = М(Fe2O3) = 160 : 6 = 26,6 г/моль эк. Но в реакции
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160 : 4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
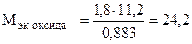
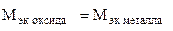
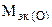
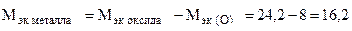
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
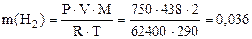
Согласно закону эквивалентов