Что называется диаграммой состояния сплавов ее назначение
Понятие о диаграммах состояния сплавов
Диаграммы состояния дает возможность изучать фазы и структурные составляющие сплава, устанавливать возможность проведения термической обработки и ее режимы, температуры литья, горячей пластической деформации и т. д.
В любой системе число фаз, находящихся в равновесии, зависит от внутренних и внешних условий. Изменения, происходящие в системе, подчинены общему закону равновесия, который называется правилом фаз или законом Г и б б с а.
Правило фаз выражает зависимость между числом степеней свободы С (вариантностью) системы, числом компонентов К и числом фаз системы Ф, находящихся в равновесии. В общем виде
где 2 — число переменных внешних факторов равновесия (температура и давление).
Вариантность C (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе.
Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз.
Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе.
Обычно все превращения в металлах и сплавах происходят при постоянном атмосферном давлении. Тогда правило фаз записывают так:
где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
Уравнение правила фаз позволяет корректировать правильность построения диаграмм состояния.
Построение диаграмм состояния осуществляют различными экспериментальными методами. Наиболее часто пользуются методом термического анализа. Сущность этого метода: отбирают несколько сплавов данной системы с различным соотношением масс входящих в них компонентов. Сплавы помещают в огнеупорные тигли и нагревают в печи. После расплавления сплавов тигли со сплавами медленно охлаждают и фиксируют скорость охлаждения. По полученным данным строят термические кривые в координатах время-температура. В результате измерений получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
По полученным кривым охлаждения (критическим точкам) для различных сплавов изучаемой системы строят диаграмму состояния в координатах: по оси абсцисс — концентрация компонентов (компонента В), по оси ординат — температура.
Температуры, соответствующие фазовым превращениям, называются критическими точками.
Основные линии (рис.4.5) диаграммы: линии ликвидуса, солидуса, а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
5. Диаграммы состояния сплавов
5. Диаграммы состояния сплавов
Сплавы можно получать при соединении большинства металлов друг с другом, а также с неметаллами. Диаграммы состояния сплавов дают наглядное представление о протекающих в сплавах превращениях в зависимости от их химического состава и температуры.
При построении диаграмм состояния сплавов на оси абсцисс указывают химический состав или концентрацию сплава в процентах. Для этого горизонтальную линию определенной длины делят на сто одинаковых частей и каждое деление принимают за 1 % одного из компонентов сплава.
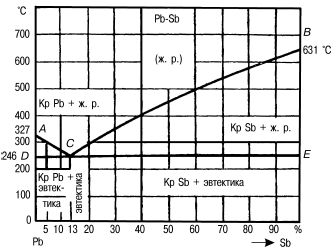
Рис. 5. Диаграмма состояния сплавов системы свинец—сурьма (Pb—Sb)
Точка А соответствует чистому свинцу, а точка В – чистой сурьме. По оси ординат в определенном масштабе указывают температуру. Для того чтобы построить диаграмму состояния сплавов, сначала строят ряд кривых охлаждения сплавов одних и тех же элементов с различной концентрацией.
На основе этих кривых строят диаграмму. Сплавы, компоненты которых при затвердевании образуют только механические смеси, относятся к первой группе. Диаграмма этих сплавов условно называется диаграммой состояния первого рода. Диаграмма сплавов, образующих при затвердевании только твердые растворы, называется диаграммой состояния второго рода. Наиболее типичными для диаграмм первого рода являются сплавы свинца с сурьмой.
Построение диаграммы (первого рода) состояния сплавов Pb—Sb:
1) кривые охлаждения доэвтектических сплавов;
2) диаграмма состояния сплавов Pb—Sb;
3) кривые охлаждения заэвтектических сплавов. Диаграмма построена для пяти видов сплава свинца с сурьмой:
1) 5 % сурьмы и 95 % свинца;
2) 10 % сурьмы и 90 % свинца;
3) 20 % сурьмы и 80 % свинца;
4) 40 % сурьмы и 60 % свинца;
5) 80 % сурьмы и 20 % свинца.
Все они имеют две критические температуры: верхнюю и нижнюю. Изучение процессов кристаллизации этих сплавов показывает, что верхняя критическая температура соответствует началу, а нижняя – концу затвердевания сплава. Таким образом, процесс кристаллизации сплавов Pb—Sb резко отличается от кристаллизации чистых металлов. Сплавы кристаллизуются в интервале температур, а чистые металлы – при постоянной температуре.
Механическая смесь кристаллов, выделяющихся из жидкого сплава одновременно, называется эвтектикой (в переводе с греческого – «хорошо сложенный»). Сплавы указанной концентрации называют эвтектическими. Линия АСВ на диаграмме называется линией ликвидуса (в переводе с греческого – «жидкий»). Выше этой линии любой сплав свинца с сурьмой находится в жидком состоянии. Линия ДСВЕ получила название линии солидуса (в переводе с греческого – «твердый»), или эвтектической линии. Точка С показывает состав эвтектики. Сплавы, расположенные левее этой точки, называют доэвтектическими, правее ее – заэвтектическими. В структуре доэвтектических сплавов, кроме эвтектики, всегда есть некоторое количество свинца, а в заэвтектических, кроме эвтектики, – сурьмы.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Читайте также
Аккумуляторы для мобильных устройств – оценка состояния
Оценка состояния аккумулятора потребителем
Оценка состояния аккумулятора потребителем Оценка реальной электрической емкости. Сделать это можно двумя способами. Первый способ – качественный и очень приблизительный. Заключается он в примерной оценке среднего времени продолжительности работы вашего мобильника.
Профессиональная оценка состояния аккумулятора
Профессиональная оценка состояния аккумулятора Тут уж не посидишь перед зарядным устройством с часами в руках. Особенно когда необходимо произвести входной контроль, например, сотни аккумуляторов. Для принятия решений в этом случае требуются количественные и точные
5.2.3. Экранные состояния объектов
5.2.3. Экранные состояния объектов Элементы человекоориентированного интерфейса должны быть доступными для начинающего пользователя и эффективными для опытного пользователя, причем переход от одного к другому не должен требовать переучивания. Хороший интерфейс должен
13.2.3. Общий обзор состояния производства наночастиц
13.2.3. Общий обзор состояния производства наночастиц Коммерческое использование любого метода должно быть обосновано экономически. В лабораторных условиях ученым удалось разработать множество интересных и красивых способов синтеза нанопорошков, но очень многие из них
18.2. Обзор состояния и перспектив промышленности
18.2. Обзор состояния и перспектив промышленности В настоящее время можно уверенно утверждать, что примерно к 2015 году осуществляемые и планируемые научно-технические разработки в области нанотехнологий приведут к весьма серьезным качественным и количественным
17.Основные термодинамические параметры состояния газа
18. Состояния тел. Термодинамическая система. Адиабатический процесс
18. Состояния тел. Термодинамическая система. Адиабатический процесс Существуют три агрегатных состояния: твердое, жидкое и газообразное.Если параметры системы не изменяется со временем, то можно говорить о термодинамическом равновесии системы.Совокупность тел и полей,
25. Уравнение состояния идеального газа
26. Универсальное уравнение состояния идеального газа
26. Универсальное уравнение состояния идеального газа Отношение массы mгаза (вещества) к количеству газа (вещества) vэтой системы называют молярной массой газа (вещества):М = m/ v.Размерность молярной массы следующая: [M] = 1 кг / 1 моль.Следствие из закона Авогадро позволяет
41. Уравнение состояния Ван-дер-Ваальса
41. Уравнение состояния Ван-дер-Ваальса В общем случае для реальных газов при вычислении параметров состояния нельзя использовать уравнение состояния pv = RT,которое верно для идеальных газов.Общее уравнение состояния для реальных газов. в котором коэффициенты Bi –
43. Частные производные параметров состояния. Термические коэффициенты
43. Частные производные параметров состояния. Термические коэффициенты Свойства реальных веществ описываются термическими коэффициентами.Определение 1. Коэффициентом объемного расширенияaназывается изменение объема вещества при повышении его температуры на один
3.3. Диаграммы состояния ювелирных сплавов
3.3. Диаграммы состояния ювелирных сплавов В ювелирной технике применяются сплавы на основе благородных металлов: серебра, золота и платины. Это основные металлы. Для имитации золотых и серебряных сплавов используют некоторые сплавы на основе меди и алюминия. Они
26. Выбор сплавов для определенного назначения на основе анализа диаграмм состояния
26. Выбор сплавов для определенного назначения на основе анализа диаграмм состояния Чистые металлы используют в электрорадиотехнике (проводниковые, электровакуумные). Основнымиконструкционными материалами являются металлические сплавы. Сплавом называют вещество,
27. Строение и свойства железа; метастабильная и стабильная фазовые диаграммы железо-углерод. Формирование структуры углеродистых сталей. Определение содержания углерода в стали по структуре
27. Строение и свойства железа; метастабильная и стабильная фазовые диаграммы железо-углерод. Формирование структуры углеродистых сталей. Определение содержания углерода в стали по структуре Сплавы железа с углеродом являются самыми распространенными металлическими
Понятие о диаграммах состояния



Диаграмма состояния показывает равновесные, устойчивые состояния, т.е. такие, которые при данных условиях обладают минимальной свободной энергией. Они имеют большое теоретическое и практической значение, так как изучение любого сплава начинается с построения и анализа диаграммы состояния с целью изучения фаз и структурных поставляющих сплава.
С помощью диаграммы состояния можно установить возможность проведения термической обработки и ее режимы, температуры литья, горячей пластической деформации и т.д.
Под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в системе.
В результате измерений получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Рассмотрим диаграмму состояния для сплавов, образующих механические смеси из чистых компонентов (1 рода).
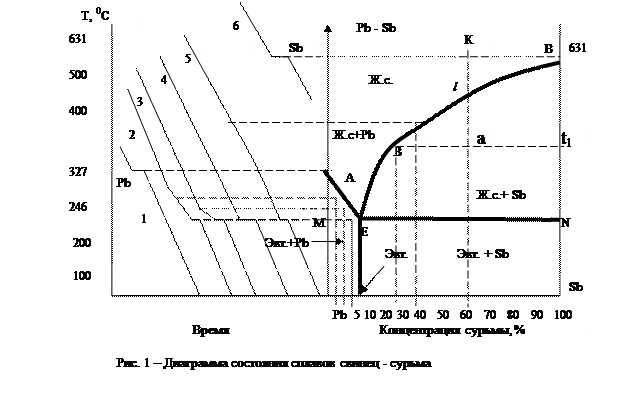
Для построения этой диаграммы выбирают три-четыре сплава различной концентрации, перенасыщенных либо свинцом, либо сурьмой, и на вспомогательной диаграмме температура – время (рис. 1 слева) наносят, пользуясь данными наблюдений температуры кристаллизации чистого свинца и чистой сурьмы, а также нижеперечисленных сплавов:
Вначале вычерчивают кривые кристаллизации Pb и Sb (1 и 6).
Свинец кристаллизуется при 327 0 С, сурьма – при 631 0 С. Их кристаллизация отмечена горизонтальным участком кривой. Первый сплав (кривая 2) начинает кристаллизоваться при 300 0 С с выделением избыточных кристаллов свинца. Оставшаяся часть сплава бедна свинцом, значит, концентрация сурьмы в ней возрастает, и, когда она достигает 13 %, при 246 0 С происходит окончательная кристаллизация (см. горизонтальный участок кривой). Второй сплав (кривая 3) кристаллизуется аналогично первому, но точка начала кристаллизации у него ниже, а кончается кристаллизация также при 246 0 С, когда концентрация сурьмы достигает 13 %. Третий сплав (кривая 4) кристаллизуется полностью при одной температуре (246 0 С) с одновременным выпадением кристаллов свинца и сурьмы. Четвертый сплав (кривая 5) начинает кристаллизоваться при 400 0 С с выделением избыточных кристаллов сурьмы. В жидком сплаве сурьмы становится все меньше, и, когда ее содержание снизится до 13 %, при 246 0 С произойдет окончательная кристаллизация.
Все точки начала и конца кристаллизации свинца, сурьмы и указанных четырех сплавов перенесем на основную диаграмму. Соединив все точки начала кристаллизации, получают линию АЕВ. Эта линия называется ликвидусом. Все сплавы, лежащие выше ликвидуса, находятся в жидком состоянии. Линия МЕN называется солидусом. Ниже этой линии все сплавы находятся в твердом состоянии. В интервале между ликвидусом и солидусом имеется две фазы: жидкий сплав (ж.с.) и кристаллы одного из компонентов. В области МАЕ – жидкий сплав и кристаллы свинца, а в области ЕВN – жидкий сплав и кристаллы сурьмы.
Сплав, содержащий 13 % сурьмы, кристаллизующийся при одной температуре, называется эвтектическим. Он имеет самую низкую температуру кристаллизации и отличается равномерной структурой. Сплавы, содержащие менее 13 % сурьмы, лежащие влево от эвтектики, называются доэвтектическими, а более 13 % сурьмы – заэвтектическими. Структуры эвтектического, доэвтектического и заэвтектического сплавов сильно различаются между собой. Эвтектика – структура с равномерно распределенными компонентами. В доэвтектических сплавах наряду с эвтектикой имеются кристаллы свинца, в заэвтектических – наряду с эвтектикой кристаллы сурьмы.
Различие структур определяет различие свойств сплавов. Для определения состояния сплава при любой температуре и нахождения точек кристаллизации с помощью диаграммы нужно из точки концентрации данного сплава восстановить перпендикуляр до пересечения с линиями ликвидуса и солидуса. Точки пересечения перпендикуляра укажут начало и конец кристаллизации.
Практическое применение диаграммы свинец – сурьма находят, например, при выборе подшипникового сплава. Пользуясь этой диаграммой, установили, что наиболее пригодными для подшипниковых сплавов являются заэвтектические сплавы, состоящие из мягкой эвтектики и твердых вкраплений сурьмы. Мягкая основа несколько изнашивается, а твердые кристаллы сурьмы сохраняются, и поэтому в микроуглублениях мягкой основы хорошо удерживается смазка. Наиболее подходящими сплавами для подшипников из всех заэвтектическими оказались сплавы с содержанием 15- 20 % Sb, так как температуры кристаллизации (плавления) этих сплавов (340-360 0 С) соответствуют температурам, при которых происходит заливка подшипников.
Итак, по диаграмме состояния первого типа затвердевают те сплавы, компоненты которых в жидком состоянии неограниченно растворяются друг в друге, а в твердом состоянии образуют простую механическую смесь кристаллов обоих компонентов. По диаграмме состояния второго типа затвердевают сплавы, компоненты которых обладают неограниченной растворимостью как в жидком, так и в твердом состоянии.
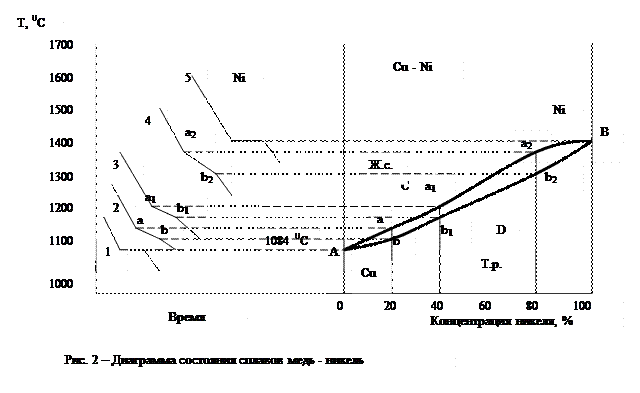
Диаграмма 2-го рода соответствует сплавам, у которых компоненты и в жидком и в твердом состоянии образуют раствор. К ним относятся сплавы медь – никель, железо – никель и др. Диаграмма состояния медь – никель приведена на рис. 2.
Кривая 1 относится к чистой меди, точка кристаллизации которой 1083 0 С, а кривая 5 – к никелю, точка кристаллизации которого 1452 0 С. Кривая 2 характеризует кристаллизацию 20 %-го сплава никеля (или 80 %-го сплава меди). Началу кристаллизации этого сплава соответствует точка а, когда кристаллизуется решетка меди, в которой имеется 20 % никеля. В точке b кристаллизация заканчивается.
Аналогично кристаллизуется 40 %-ный (кривая 3) и 80 %-ный (кривая 4) сплавы никеля, однако точки начала (а1 и а2) и конца (b1 и b2) кристаллизации у первого сплава ниже, чем у второго.
Перенеся все точки начала и конца кристаллизации меди и никеля и указанных выше сплавов на основную диаграмму (рис. 9 справа) и соединив эти точки, получим линии ликвидуса АаВ и линию солидуса АbВ. Выше линии АаВ сплавы меди с никелем находятся в жидком состоянии, а ниже линии АbB – в твердом. В зоне между АаВ и АbB имеются две фазы: жидкий сплав и кристаллы твердого раствора никеля в меди. Диаграмма 2-го рода отличается от диаграммы 1 –го рода тем, что здесь образуется одна кристаллическая решетка, а значит, нет и эвтектического сплава, как это наблюдается у сплавов, образующих механическую смесь. Подавляющее число металлов в жидком состоянии образует однородные жидкие растворы.
При переходе в твердое кристаллическое состояние во многих сплавах сохраняется однородность, следовательно, сохраняется взаимная растворимость. Такая однородная фаза называется твердым раствором.
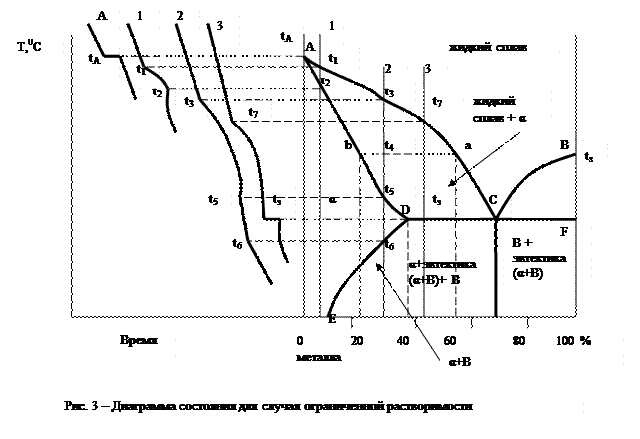
На рис. 3 приведена диаграмма состояния для этого случая в общем виде. Линии АС и СВ соответствуют линии ликвидуса. По линии АС из жидкого сплава кристаллизуется твердый раствор компонента В в компоненте А (α), по линии СВ – чистый компонент В.
Линия ADCF отвечает линии солидуса. Точка D характеризует предельную растворимость В и А при эвтектической температуре tэ, а точка Е – предельную растворимость компонента В в компоненте А при нормальной комнатной температуре. Следовательно, линия DE показывает изменение растворимости В и А с понижением температуры; каждая точка линии DE указывает на предел растворимости В и А (предел насыщения) при соответствующей температуре.
В точке С одновременно из жидкой фазы кристаллизуется твердый раствор В в А (α) предельной растворимости (точка D) и компонент В с образованием эвтектики, т.е. механической смеси обеих фаз.
Рассмотрим процесс кристаллизации сплавов 1, 2, 3. Кристаллизация сплава 1 начинается при температуре t1 и заканчивается при температуре t2. После затвердевания сплав состоит только из твердого раствора α (В и А) и при дальнейшем понижении температуры никаких превращений не испытывает. Процесс кристаллизации сплава 2 начинается при температуре t3 и заканчивается при температуре t5.
Состав жидкой фазы в процессе кристаллизации меняется по линии ликвидуса, а твердой фазы по линии солидуса. Так, например, при температуре t4 состав жидкой части сплава определяется точкой а, а кристаллов твердого раствора точкой b. После окончания кристаллизации сплав 2 будет состоять только из твердого раствора α. После достижения температуры t6 твердый раствор этого состава оказывается насыщенным, а при более низких температурах – пересыщенным, что влечет за собой его распад с выделением избыточного количества металла В. Следовательно, при температуре ниже t6 сплав состоит из двух фаз: α +В. Состав α –раствора с понижением температуры изменяется по точкам линии DE и при нормальной комнатной температуре сплав будет состоять из кристаллов твердого раствора α состава, отвечающего точке Е, и кристаллов металла В.
Сплав 3 начинает затвердевать при достижении температуры t7 и окончательно затвердевает при температуре tэ.
В процессе кристаллизации состав жидкой части сплава непрерывно меняется по линии ликвидуса, стремясь к эвтектическому составу (точка С), а состав твердой фазы изменяется по линии солидуса в сторону предельной растворимости (точка D). Соотношение между жидкой и твердой фазой в процессе кристаллизации сплава определяется по правилу отрезков. По достижении температуры tэ состав жидкой фазы достигает эвтектической концентрации С, и сплав окончательно затвердевает с одновременным выделением из жидкой фазы кристаллов твердого раствора α (концентрации точки D) и кристаллов компонента В, образующих эвтектику. Следовательно, после затвердевания сплав будет состоять из первичных предельно насыщенных (точка D) кристаллов твердого раствора α, выделившихся в интервале температур t7 – tэ и эвтектики (αD +В), образовавшейся при температуре tэ.
Вследствие изменения растворимости В в А при дальнейшем понижении температуры твердый раствор α (как свободный, так и входящий в состав эвтектики) претерпевает распад с выделением избыточного металла В. После окончательного охлаждения состав α – фазы определится точкой Е.
Сплав, имеющий концентрацию, соответствующую точке С, после затвердевания будет состоять из одной эвтектики (α+В).
Кристаллизация заэвтектических сплавов будет протекать совершенно аналогично сплаву 3, только вместо первичных кристаллов α будет выделяться кристаллы чистого компонента В.
Поэтому в сплавах, предназначенных для обработки давлением, максимум растворимости при эвтектической температуре является верхним пределом содержания компонентов. Наоборот, для обеспечения высоких литейных свойств концентрация компонентов в литейных сплавах обычно превышает максимальную растворимость в твердом состоянии при эвтектической температуре. Сплавы, обладающие ограниченной растворимостью в твердом состоянии, могут быть упрочнены путем термической обработки.
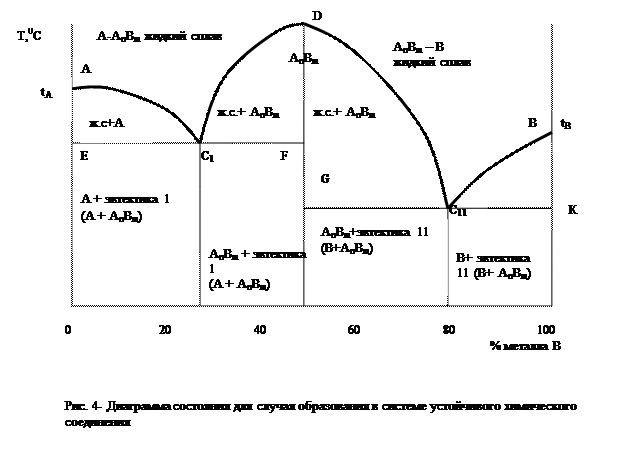
По диаграмме состояния четвертого типа (рис. 4) затвердевают сплавы, компоненты которых в жидком состоянии неограниченно растворяются друг в друге, а при затвердевании образуют химическое соединение.
Химическое соединение представляет собой фазы постоянного состава, обычно имеющие свою особую кристаллическую решетку, отличную от решеток образующих его компонентов. Поэтому свойства химического соединения самостоятельны и не зависят от свойств компонентов.
На базе химических соединений могут образовываться твердые растворы. При образовании твердого раствора кристаллическая решетка химического соединения сохраняется, а избыточное количество атомов, например компонента В, замещает в решетке часть атомов компонента А.
Нормальные валентные соединения типа Mg2Si, Mg2Sn (станнум), Mg2Pb в металлических сплавах образуются редко. В большинстве случаев образующиеся в металлических системах химические соединения не подчиняются нормальным правилам валентности.
В металлических системах большое значение имеют электронные соединения.
Соединения этого типа имеют совершенно определенное отношение числа валентных электронов к числу атомов, входящих в соединение. Так, существует ряд соединений, у которых это отношение равно 3:2, у других 21:13, у третьих 7:4. Каждому из этих соотношений соответствует и определенный тип кристаллической решетки. Все соединения, имеющие отношение числа валентных электронов к числу атомов, равное 3:2, имеют кристаллическую решетку центрированного куба. К этому типу относятся такие соединения, как CuZn (цинкумат), Cu3Al, Cu5Sn и другие, известные под названием β-фаз.
Соединениям Cu5Zn8, Cu9Al4 и другим, имеющим отношение 21:13, свойственна сложная кубическая решетка; эти соединения носят название γ-фазы.
Наконец, таким соединениям, как CuZn3, Cu3Sn, Cu3Si и другим, имеющим отношение 7:4, свойственна гексагональная решетка. Эти соединения носят название ε-фазы. Большая группа металлов (Fe, Cr, Mo, W, Ti и др.) образуют с углеродом, азотом, водородом, и бором, имеющими малый атомный радиус, химические соединения, которые носят название фазы внедрения. Эта группа соединений образуется при условии, если отношение атомного радиуса металлоида к атомному радиусу металла меньше или равно 0,59. В этом случае образуется соединение, имеющее формулу М4Х (Mn4N, Fe4N и т.д.), М2Х (W2N, Fe2N), MX (TiN, TiC, WC, VC) или (ZrH2).
Металлические атомы в фазах внедрения образуют одну из наиболее простых кристаллических решеток (кубическую, гексагональную), в которую внедряются атомы металлоидов, занимая в ней свободные поры.
Диаграмма состояния для случая, когда два компонента обладают полной взаимной растворимостью в жидком состоянии, не растворимы в твердом состоянии и образуют устойчивое химическое соединение, представлена на рис. 4.
Процесс кристаллизации сплавов А-АnВm начинается при температурах, отвечающих линии АС1D; при этом по линии АС1 кристаллизуется металл А, а по линии C1D – химическое соединение АnВm. Окончание процесса кристаллизации соответствует эвтектической температуре (линия ЕС1F).
Однако следует иметь в виду, что в подавляющем большинстве случаев чистые компоненты и химическое соединение образуют области твердых растворов в ограниченных пределах. В этом случае диаграмму следует рассматривать как сложную, состоящую из двух диаграмм эвтектического типа с ограниченной растворимостью в твердом состоянии.