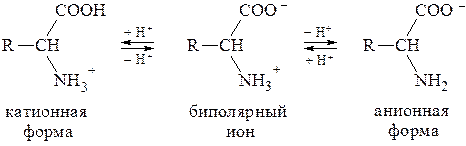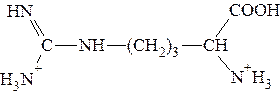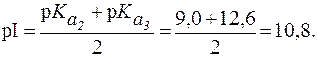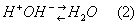Что называется буферной системой
Типы буферных систем
Буферные системы
Например, в процессе метаболических превращений в клетках организма образуются кислоты (угольная, серная, фосфорная, молочная и др.) и основания (аммиак, азотистые основания). Выделе-ние этих веществ в количествах, превышающих допустимую норму, может привести к ацидозу или алкалозу.
В процессе тканевого дыхания в организме высвобождается большое количество углекислого газа. Транспорт СО2 осуществля-ется кровью, которая представляет собой одну из важнейших внут-ренних сред организма и характеризуется определенным диапазоном колебаний рН – от 7,37 до 7,45 со средней величиной 7,38-7,40. Даже небольшие отклонения рН крови от нормы свидетельствуют о патологических нарушениях метаболизма. Величины рН крови ниже 6,8 и выше 7,8 несовместимы с жизнью.
Присутствие кислотных оксидов (таких как СО2) может вызвать сдвиг значений рН раствора в область более низких значений, что в данном случае может привести к серьезным физиологическим нару-шениям. Действительно, вопреки распространенному мнению, дли-тельное пребывание человека в замкнутом пространстве приводит к удушью и гибели не из-за недостатка кислорода, а из-за избытка СО2.
Однако, присутствие в крови допустимых концентраций кислот, оснований или углекислого газа не вызывает нарушений кислотно-основного гомеостаза. Это означает, что в организме присутствуют системы, способные поддерживать концентрацию ионов водорода на заданном уровне. Таких систем в организме человека три: дыхатель-ная система (легкие), выделительная система (почки) и комплекс буферных систем.
Действительно, от кислотных оксидов (CO2) организм освобож-дается благодаря процессу дыхания, а нелетучие кислоты и основа-ния выводятся через почки с мочевыведением. Однако эти физиоло-гические процессы протекают медленно, быстрая же нейтрализация этих веществ и поддержание постоянства pH в норме осуществляется за счет физико-химических процессов, среди которых главная роль принадлежит протолитическим равновесиям в буферных системах биологических сред организма.
Типы буферных систем
Буферные системы (буферы) – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему некоторого количества сильной кислоты или щелочи. Эта способность буферных систем называется буфер-ным действием.Растворы, содержащие одну или несколько буфер-ных систем называются буферными растворами.Интервал значений рН, в котором система проявляет буферные свойства, называется зоной буферного действия.
Буферные растворы применяются для сохранения активной реакции среды на определенном уровне, если тот или иной процесс (например, выращивание культуры бактерий, проведение фермента-тивной реакции и т.п.) должен быть проведен при постоянном значении рН.
Буферные системы могут быть двух типов. Некоторые примеры буферных систем и их характеристики приведены в таблице 1.
В биологических объектах буферные системы могут быть также образованы из ионов и молекул амфолитов, например, аминокислот-ные и белковые буферные системы.
В водных растворах a-аминокислоты присутствуют в виде равно-весной смеси биполярного иона, катионной и анионной форм:
Таблица 1. Типы буферных систем.
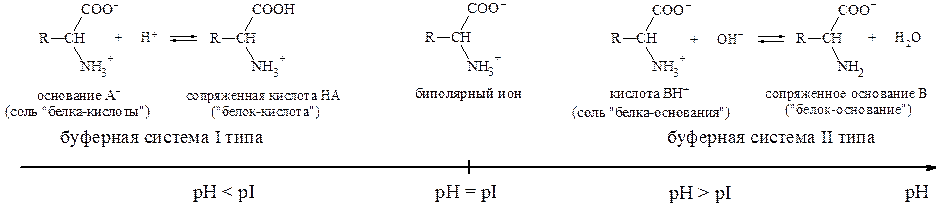
Полностью протонированная a-аминокислота (катионная форма), не содержащая ионогенных групп в радикале, с позиций теории Бренстеда является двухосновной кислотой, диссоциация которой описывается при помощи двух констант: 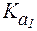
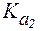
Значение pH, соответствующее наибольшей концентрации бипо-лярного иона, называется изоэлектрической точкой (pI). В общем случае величину pI вычисляют по формуле:
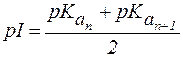 , , | (1) |
Для аминокислот, не содержащих ионогенных групп в радикале, величину pI вычисляют по формуле:
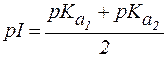 | (2) |
Пример 1. Рассчитать величину pI аргинина, если для этой a-аминокислоты: 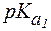
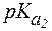
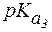
Полностью протонированная форма аргинина выглядит так:
Видно, что n = 2. Поэтому:
Дата добавления: 2015-12-22 ; просмотров: 6717 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Буферные системы
Полезное
Смотреть что такое «Буферные системы» в других словарях:
Буферные системы крови — (от англ. buffer, buff смягчать удар) физиологические системы и механизмы, обеспечивающие кислотно основное равновесие в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых… … Википедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Буферные растворы — см. Буферные системы … Большая советская энциклопедия
Буферный раствор — Буферные растворы (англ. buffer, от buff смягчать удар) растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и… … Википедия
Кислотно-щелочное равновесие — I Кислотно щелочное равновесие (синоним: кислотно основное равновесие, кислотно щелочной баланс, равновесие кислот и оснований) относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность… … Медицинская энциклопедия
Кровь — I (sanguis) жидкая ткань, осуществляющая в организме транспорт химических веществ (в т.ч. кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему … Медицинская энциклопедия
Гомеостаз — (др. греч. ὁμοιοστάσις от ὁμοιος одинаковый, подобный и στάσις стояние, неподвижность) саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций,… … Википедия
Электрофорез белков в полиакриламидном геле — Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожке У этого термина существуют и другие значения, см. Электрофорез в полиакриламидном геле. Электрофорез белков в полиакриламидном… … Википедия
Бу́ферные раство́ры — (синоним: буферные смеси, буферные системы, буферы) растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных… … Медицинская энциклопедия
Определение буферных систем и их классификация



Буферные растворы
Особенно актуально это для биохимических процессов, протекающих в живых организмах. Большинство из них катализируется различными ферментами или гормонами, проявляющими свою биологическую активность только в строго определенном и достаточно узком интервале значений рН.
Растворы, способные сохранять постоянной концентрацию ионов Н + при добавлении к ним небольших количеств сильной кислоты или щелочи, а также при разбавлении, называются буферными растворами или буферными системами.
Свойство данных растворов сохранять неизменным присущее им значение рН при вышеперечисленных обстоятельствах, называется иначе буферным действием.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Кислотные буферные системы обычно образованы слабой неорганической или органической кислотой и солью этой же кислоты с сильным основанием. Например:
| 1) | СН3СООН | + | СН3СООNa | – | ацетатный буфер |
| слабая кислота | соль кислоты |
| 2) | Н2СО3(Н2О + СО2) | + | NaНСО3 | – | гидрокарбонатный или бикарбонатный буфер |
| слабая кислота | соль кислоты |
С точки зрения теории Бренстеда-Лоури кислотной буферной системой является равновесная смесь слабой кислоты и сопряженного ей основания. Причем роль сопряженного основания играют образующиеся при диссоциации солей анионы слабых кислот. В связи с этим состав буферных растворов можно записать иначе:
| 1) | СН3СООН | / | СН3СОО – | – | ацетатный буфер |
| слабая кислота | сопряженное основание |
| 2) | Н2СО3(Н2О + СО2) | / | НСО3 – | – | гидрокарбонатный буфер |
| слабая кислота | сопряженное основание |
Кислотная буферная система может быть образована и смесью двух солей многоосновной кислоты, соответствующих различным стадиям нейтрализации этой кислоты. В этом случае кислотный остаток одной из солей (менее замещенный) играет роль слабой кислоты, а кислотный остаток второй соли (более замещенный) – сопряженного ей основания.
Примером таких систем могут служить:
1) карбонатная буферная система, представляющая собой смесь кислой (NaHCO3) и средней (Na2CO3) солей угольной кислоты
| HCO3 – | / | СО3 2– |
| слабая кислота | сопряженное основание |
2) фосфатные буферные растворы
| NaH2PO4 + Na2HPO4 | (H2PO4 – | / | HPO4 2 – |
| слабая кислота | сопряженное основание |
| Na2HPO4 + Na3PO4 | (HPO4 2 – | / | PO4 3 – |
| слабая кислота | сопряженное основание |
Следует отметить, что не только смеси, но и растворы некоторых индивидуальных солей (например: тетрабората натрия (Na2B4O7), карбоната аммония ((NH4)2CO3) и др.) тоже обладают буферными свойствами, которые объясняются сильным гидролизом этих солей и образованием вследствие этого компонентов, необходимых для буферного действия:
Оснóвные буферные системы образованы слабым неорганическим или органическим основанием и солью этого основания с сильной кислотой. Например:
| 1) | NH3 · H2O(NH4OH) | + | NH4Cl | – аммиачный буфер |
| слабое основание | соль |
| 2) | C2H5–NH2 | + | C2H5NH3Cl | – этиламиновый буфер |
| слабое основание | соль |
С точки зрения теории Бренстеда-Лоури оснóвная буферная система также представляет собой равновесную смесь слабой кислоты и сопряженного ей основания, только роль кислоты в данном случае выполняет образующийся при диссоциации соли катион:
| 1) | NH4 + | / | NH3 | – аммиачный буфер |
| слабая кислота | сопряженное основание |
| 2) | C2H5–NH3 + | / | C2H5–NH2 | – этиламиновый буфер |
| слабая кислота | сопряженное основание |
Определенным буферным действием обладают также и растворы многих органических веществ, молекулы которых одновременно содержат в своем составе функциональные группы, проявляющие как слабые кислотные (СООН-группы), так и оснóвные (NH2-группы) свойства. По своей природе данные соединения являются амфолитами. К ним относятся аминокислоты, белки, пептиды.
Буферные системы, их типы. Механизм действия буферных систем.
Буферные растворы – это растворы, которые способны поддерживать значение рН при добавление кислот и щелочей.
Способность противостоять смещению рН называется буферной ёмкостью, которая выражается в количестве грамм/эквивалент сильной кислоты(основания), которая смещает значение рН на 1 в одном литре буферного раствора.
Буферные системы бывают кислотные, щелочные, солевые. Кислотные состоят из слабой кислоты и ее соли, образованной сильным основанием (СН3СООН и СН3СООNa). Щелочные состоят из слабого основания и его соли, образованной сильной кислотой (NH4OH и NH4Cl). Солевые состоят из 2х разнозамещенных солей (КН2РО4 и К2НРО4)
Механизм действия буферных систем (ацетатный буфер):
При добавление щелочи в реакцию вступают молекулы уксусной кислоты, при этом образуются соль и вода
Диализ. Электрофорез.
Диализ- это метод очистки белковых растворов от низкомолекулярных примесей. Для проведения диализа необходим цилиндр, у которого вместо дня ППМ, поры которой пропускают мелкие молекулы, но не пропускают молекулы белков. Цилиндр с раствором белка с примесями погружается в емкость с дистиллированной водой. Мелкие молекулы примесей свободно проходят через поры мембраны, равномерно распределяясь между областями внутри и снаружи цилиндра. Для полной очистки необходимо погружать цилиндр в проточную воду. С помощью диализа очищаются белковые растворы фармакологической промышленности. Этот метод лежит в основе «искусственной почки».
Электрофарез – это метод разделения белков на отдельные фракции. В основе работы аппарата эф лежит способность заряженных белковых молекул двигаться в электрическом поле к противоположно заряженному электроду. Различные молекулы – различная скорость, зависящая от молекулярной массы, суммарного заряда, формы. Аппарат для эф состоит из горизонтально расположенного носителя (гелиевого) и электродов, создающих электрическое поле. На носитель наносится раствор с электролитами. Исследуемый раствор наносят в стартовую зону и подают напряжение. Через определенный промежуток времени белки с разной молекулярной массой распределяются по зонам. Из каждой зоны белки можно извлечь и измерить количественно.
61.Явление осмоса. Осмотическое давление.
Представим, что сосуд с двумя горлами для залива раствора разделен мембраной M. В каждую часть сосуда зальем растворы, отличающиеся концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведет к переходу части растворителя в ту часть сосуда, где концентрация растворенного вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнется в сторону с меньшей концентрацией растворенного вещества.
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
БУФЕРНЫЕ СВОЙСТВА
Полезное
Смотреть что такое «БУФЕРНЫЕ СВОЙСТВА» в других словарях:
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
Буферные системы крови — (от англ. buffer, buff смягчать удар) физиологические системы и механизмы, обеспечивающие кислотно основное равновесие в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых… … Википедия
КРОВЬ — КРОВЬ, жидкость, заполняющая артерии, вены и капиляры организма и состоящая из прозрачной бледножелтоват. цвета плаз мы и взвешенных в ней форменных элементов: красных кровяных телец, или эритроцитов, белых, или лейкоцитов, и кровяных бляшек, или … Большая медицинская энциклопедия
Трис — Общие Систематическое наименование 2 ами … Википедия
Кровь — I (sanguis) жидкая ткань, осуществляющая в организме транспорт химических веществ (в т.ч. кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему … Медицинская энциклопедия
ВОДОРОДНЫЕ ИОНЫ — ВОДОРОДНЫЕ ИОНЫ, представляют собой положительно заряженные атомы водорода. Атом водорода состоит из положительного ядра и одного единственного электрона, при потере которого он превращается в В. и., обозначаемый Н ; В. ион, т. о., тождествен с… … Большая медицинская энциклопедия
Кариес зубов — Зуб, поражённый кариесом МКБ 10 K … Википедия
Кариес — зубов Зуб, поражённый кариесом МКБ 10 K02. МКБ 9 … Википедия
Костоеда — Кариес зубов Зуб, поражённый кариесом МКБ 10 K02. МКБ 9 … Википедия
ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия