Что назначают при остеопорозе
Современные возможности медикаментозного лечения постменопаузального остеопороза и пути решения проблем комплаентности
Описаны подходы к лечению остеопороза с применением бисфосфонатов, стронция ранелата, деносумаба. Обязательной составной частью любой схемы лечения остеопороза является адекватный прием кальция и витамина D. Указана роль заместительной гормональной терапи
Approaches to osteoporosis treatment, using bisphosphonates, strontium ranelate, denosumab were described. Adequate dose of calcium and D vitamin is a necessary element of any scheme of osteoporosis treatment. The meaning of substitution hormone therapy for osteoporosis prevention was underlined.
.jpg)
В докладе ВОЗ (2007) приводятся данные, свидетельствующие о высокой распространенности этого заболевания в различных популяциях. Так, остеопороз является причиной 8,9 млн переломов, происходящих в мире ежегодно. Риск в течение жизни сломать предплечье, бедро или позвоночник составляет 30–40%, что соответствует риску ишемической болезни сердца. Важно также, что остеопороз занимает одно из ведущих мест среди заболеваний, приводящих к обездвиженности, инвалидности и смерти [1]. Подавляющее большинство случаев остеопороза касается женщин, находящихся в периоде постменопаузы (постменопаузальный остеопороз).
Согласно подсчетам, в Российской Федерации 14 млн человек (10% населения страны) страдают остеопорозом, еще 20 млн имеют остеопению. Таким образом, в России в группу потенциального риска остеопоротических переломов входит 24% (34 млн) жителей. При этом каждую минуту в стране у людей старше 50 лет происходит 7 переломов позвонков, каждые 5 минут — перелом шейки бедра [2].
Диагностика постменопаузального остеопороза и последующее назначение лечения базируются на клинических проявлениях и оценке риска перелома. Постменопаузальный остеопороз можно диагностировать клинически, на основании перенесенного пациенткой малотравматичного перелома. Сам факт наличия такого перелома в анамнезе является свидетельством того, что риск последующих переломов очень высок. Кроме этого, оценить риск перелома можно при денситометрическом исследовании костной ткани (рентгеновская двухэнергетическая абсорбциометрия), а также при подсчете 10-летнего абсолютного риска переломов (FRAX) на сайте http://www.shef.ac.uk/FRAX/index.jsp?lang=rs. Калькулятор FRAX определяет вероятность остеопоротических переломов костей на основе наличия у больного клинических факторов риска остеопороза и переломов, причем подсчет возможен даже без проведения денситометрического исследования.
Главной причиной потери костной ткани у женщин в постменопаузе является дефицит эстрогенов. Уже в первые 5 лет постменопаузы ежегодная убыль костной массы в позвоночнике составляет около 3%. Постменопаузальный остеопороз развивается из-за существенного увеличения скорости ремоделирования костной ткани, обусловленного тем, что дефицит эстрогенов приводит к повышению числа и активности остеокластов. Связанная с этим повышенная резорбция, не компенсируемая адекватным костеобразованием, приводит к необратимой потере кости. Высокая активность остеокластов вызывает перфорацию трабекул в месте резорбции, что ведет к нарушениям микроархитектоники кости и снижению ее плотности. Таким образом, фармакологическая коррекция данных патогенетических механизмов должна быть направлена на подавление чрезмерной костной резорбции остеокластами и стимулирование костеобразования остеобластами.
Лечение постменопаузального остеопороза
Основной целью лечения остеопороза является предупреждение переломов. Исходя из сущности самого заболевания, эта цель достигается увеличением минеральной плотности кости и улучшением ее качества. Кроме того, пациентку с болевым синдромом необходимо адекватно обезболить, особенно это касается больных с поражением позвоночника. Одной из важнейших задач лечения является также предупреждение падений.
Эффективность лекарственного средства в лечении остеопороза должна быть доказана в многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях, в которых первичной конечной точкой является снижение числа переломов характерных для остеопороза локализаций. Также должно быть продемонстрировано снижение маркеров костной резорбции и повышение костной минеральной плотности на фоне продолжительного лечения (3–5 лет). Согласно рекомендациям Российской ассоциации по остеопорозу [3], препаратами первой линии лечения остеопороза являются азотсодержащие бисфосфонаты и стронция ранелат. В последнее время к ним присоединился новый препарат деносумаб.
Бисфосфонаты являются стабильными аналогами естественно образующихся пирофосфатов. Они встраиваются в костный матрикс, надолго там сохраняются и подавляют костную резорбцию за счет снижения активности остеокластов. В настоящее время бисфосфонаты являются признанным методом профилактики и лечения остеопороза у мужчин и у женщин. Исследования, успешно проведенные на десятках тысяч пациентов, показали, что бисфосфонаты безопасны, хорошо переносятся, имеют мало побочных эффектов, подавляют костную резорбцию, способствуют повышению минеральной плотности кости (МПК) и снижают риск переломов.
В настоящее время в клинической практике используется несколько бисфосфонатов (алендронат, ризедронат, ибандронат, золедроновая кислота) с различными путями и режимами введения. Наиболее известным и хорошо изученным бисфосфонатом является алендронат. Его клиническая эффективность доказана в качественных исследованиях у больных остеопорозом, в частности, при наличии переломов позвонков (уровень рекомендаций А). Кроме того, он эффективен при профилактике остеопороза у женщин в постменопаузе с остеопенией (уровень рекомендаций А). В среднем алендронат снижает риск переломов различной локализации на 50%, а риск множественных переломов позвонков на 90%. Препарат назначается в дозе 70 мг (1 табл.) раз в неделю. При постменопаузальном остеопорозе также применяется ризедронат в дозе 35 мг в неделю.
Бисфосфонаты имеют низкую биодоступность, а также обладают рядом побочных действий, в частности, могут вызывать воспалительные поражения и эрозии нижнего отдела пищевода. Для профилактики этого побочного эффекта и повышения биодоступности таблетку бисфосфоната необходимо принимать утром натощак, запив 1–1,5 стаканом воды, после чего в течение 40–60 минут не принимать горизонтальное положение и не есть. Столь сложный режим приема, к сожалению, приводит к низкой приверженности пациентов к соблюдению рекомендаций. Известно, что через год продолжают лечение только 30% тех больных, кто принимает бисфосфонаты ежедневно, и около 45% тех, кто принимает их раз в неделю.
В последнее время появились новые бисфосфонаты, показавшие высокую эффективность и хорошую переносимость при более редком приеме, что повышает комплаентность и приверженность пациентов лечению. Это ибандронат, который принимается внутрь в виде таблетки 150 мг раз в месяц или внутривенно в дозе 3 мг раз в 3 мес, показан при постменопаузальном остеопорозе; и золедроновая кислота, которая назначается один раз в год (5 мг).
Стронция ранелат — первый антиостеопоротический препарат, который обладает двойным механизмом действия: он одновременно стимулирует образование костной ткани и подавляет костную резорбцию. Стронция ранелат восстанавливает баланс костного обмена в пользу образования новой и прочной костной ткани, что обеспечивает раннюю и продолжительную эффективность в профилактике переломов позвоночника и периферического скелета при постменопаузальном остеопорозе. Препарат принимается в порошке (саше 2 г) один раз в сутки, желательно на ночь, предварительно его растворяют в стакане воды. Лечение стронция ранелатом, как и другими средствами от остеопороза, необходимо сочетать с приемом кальция и витамина D, но принимать не ранее чем через 2 часа после кальция.
Деносумаб представляет собой новый самостоятельный класс лекарственных препаратов. Это биологический препарат, представляющий собой моноклональное антитело к лиганду рецептора активатора фактора каппа-В (RANKL). Сам рецептор (RANK) является важнейшим звеном в активации остеокластов, однако без присутствия лиганда (RANKL) его активация не происходит. Показано, что избыточная продукция остеобластами RANKL лежит в основе развития постменопаузального остеопороза. Она приводит к образованию большого количества и чрезмерной активности остеокластов, что проявляется в усилении костной резорбции. Блокада RANKL соответствующим моноклональным антителом, каковым является деносумаб, приводит к быстрому снижению в сыворотке крови концентрации маркеров костной резорбции и увеличению минеральной плотности костной ткани во всех отделах скелета. Эти процессы сопровождаются снижением риска переломов, включая переломы позвоночника, проксимального бедра и других внепозвоночных переломов. Деносумаб вводится подкожно через уже заполненный препаратом шприц-тюбик раз в 6 месяцев.
Перед назначением антиостеопоротических препаратов необходимо исследовать кальций сыворотки крови и клиренс креатинина. Низкая концентрация кальция сыворотки чаще всего бывает вызвана дефицитом витамина D и при его назначении полностью корректируется при условии адекватного поступления кальция с пищей и/или лекарственными препаратами. При клиренсе креатинина менее 30 мл/мин бисфосфонаты и стронция ранелат не назначаются. Вместе с тем деносумаб может назначаться при хронической почечной недостаточности, при этом коррекции его дозы не требуется.
Лечение остеопороза любым из указанных препаратов должно быть длительным — не менее 3–5 лет. Обязательной составной частью любой схемы лечения остеопороза является адекватный прием кальция и витамина D, хотя самостоятельного значения в лечении заболевания они не имеют за исключением предупреждения перелома шейки бедра у пожилых больных с дефицитом витамина D.
Суточная потребность кальция зависит от возраста пациента и колеблется от 800 до 1500 мг ионизированного кальция [3]. Основным источником кальция являются молочные продукты. Кроме того, кальций содержится в зеленых листовых овощах, злаках и мягких костях рыб, однако в существенно меньших количествах, чем в молочных продуктах. Для покрытия суточной потребности в кальции достаточно принять в пищу 6 стаканов нежирного молока или кисломолочных продуктов, либо 200 г твердого сыра, либо 1,5 кг нежирного творога. В случае низкого поступления кальция с пищей, что чаще всего бывает при непереносимости молочных продуктов либо нежелании включать их в рацион питания, с целью профилактики остеопороза (или при уже развившемся заболевании) необходимо добавлять к еде кальций в виде лекарственных препаратов. Более 70% жителей России потребляют менее половины требуемого по возрасту кальция с продуктами питания, что нуждается в коррекции [8].
Витамин D — это группа стероидных гормонов, которые образуются в организме на основе поступающих с пищей витаминов D2 и D3 и синтезирующегося в коже под действием ультрафиолетовых лучей (UVB) витамина D3. Витамин D — важный регулятор костного обмена. Он усиливает абсорбцию кальция в желудочно-кишечном тракте, снижает экскрецию кальция в почках, улучшает качество кости и усиливает ее репарацию. Очень важным эффектом витамина D является увеличение мышечной силы и координации движений. Было показано, что совместное назначение витамина D3 с кальцием приводит к достоверному снижению риска падений, а у пожилых женщин — к снижению частоты перелома шейки бедра. В последнее время появились данные о том, что дефицит витамина D может ассоциироваться с развитием других заболеваний, таких как артериальная гипертензия, сахарный диабет, рассеянный склероз, опухоли различных локализаций и др.
Люди, живущие севернее 40-й широты, в течение 3–4 зимних месяцев (а в некоторых местностях и до 6 мес) не подвергаются воздействию солнечных лучей, а значит, в течение этого времени витамин D у них в коже не синтезируется. Считается, что для жителей северных широт солнечного света недостаточно без приема витамина D с пищей. Однако витамин D содержит лишь ограниченное число пищевых продуктов. Это — жирная рыба (сельдь, скумбрия, лосось), рыбий жир, печень и жир водных млекопитающих.
Известно, что у пожилых людей снижается способность кожи продуцировать D3. Есть данные, что его абсорбция в кишечнике с возрастом также снижается. Кроме того, много людей старших возрастных групп не выходят из дома из-за хронических заболеваний, вызывающих одышку или боли в суставах, что ограничивает у них инсоляцию. Все это делает чрезвычайно важным дополнительное введение витамина D. Нелишне напомнить, что прием витамина D должен обязательно сопровождать патогенетическое лечение остеопороза антирезорбтивными агентами или стронция ранелатом. Дополнительным преимуществом является снижение риска падений на фоне приема препаратов витамина D, что играет позитивную роль при профилактике переломов. Суточная доза витамина D должна составлять не менее 800 МЕ. Витамин D желательно добавлять к препаратам кальция, поскольку он увеличивает всасывание кальция в желудочно-кишечном тракте на 50–80%. Следует отметить, что адекватное поступление кальция и витамина D важно в любом периоде жизни женщины и не должно ограничиваться постменопаузой. При недостатке в рационе молочных продуктов, а также в конце зимы — начале лета полезно дополнительно принимать препараты кальция и витамина D.
Помимо указанных выше средств первой линии лечения остеопороза в отдельных случаях может использоваться кальцитонин лосося — синтетический аналог гормона щитовидной железы кальцитонина, участвующего в регуляции кальциевого гомеостаза. Особенностью препарата Миакальцик, содержащего кальцитонин лосося, является то, что он снижает риск переломов при отсутствии выраженной динамики МПК, что объясняется его позитивным влиянием на качество костной ткани (ее микроархитектонику). Риск новых переломов позвонков при лечении Миакальциком снижается на 36%. При этом препарат обладает еще одним свойством, которое широко используется в клинической практике: Миакальцик оказывает выраженный анальгезирующий эффект при болях, вызванных переломами.
Заместительная гормональная терапия (ЗГТ) женскими половыми гормонами высокоэффективна у женщин в постменопаузе с низкой минеральной плотностью (остеопенией) в профилактике остеопороза и переломов позвонков и других переломов, включая шейки бедра (уровень рекомендаций А). Вместе с тем известно, что риск от ее применения может превышать преимущества. Так, показано, что длительный прием (больше 5 лет) ассоциируется с риском развития рака молочной железы, ишемической болезни сердца и инсульта (уровень рекомендаций А). Кроме того, одним из серьезных побочных эффектов заместительной гормональной терапии является венозный тромбоз (А). Поэтому при назначении этого лечения пациентку следует предупредить и о возможных осложнениях.
Вместе с тем ЗГТ является профилактической терапией первого ряда у женщин с менопаузой до 45 лет (уровень рекомендаций D), а также средством, эффективно снимающим клинические вегетативные симптомы, свойственные менопаузе. В любом случае вопрос о назначении пациентке ЗГТ требует тщательного гинекологического и маммологического обследования и мониторинга.
С целью мониторирования эффективности лечения остеопороза с интервалом 1–2 года проводится оценка минеральной плотности костной ткани. При этом прирост минеральной плотности или даже отсутствие отрицательной динамики трактуются как проявление того, что лечение эффективно. При наличии возможности полезным оказывается исследование в динамике маркеров костной резорбции (например, продукты деградации коллагена I типа — N-телопептид (NTX) в моче или С-телопептид (CTX) в сыворотке крови): до начала терапии и через 3 месяца. Снижение их уровня на 30% свидетельствует об эффективности проводимого лечения, а также о том, что пациентка правильно его принимает. Если на фоне приема рекомендованного лечения у пациентки не наблюдается снижения уровня маркеров резорбции, либо снижается минеральная плотность кости, либо происходит малотравматичный перелом, прежде чем сделать вывод о неэффективности лечения, врач должен оценить следующие факторы. Во-первых, проверить, принимает ли пациентка лечение, если да, то насколько постоянно и не делает ли перерывы. Во-вторых, правильно ли она его принимает (соблюдая режим и кратность приема) и сопровождает ли лечение антиостеопоротическими препаратами приемом витамина D и кальция. Как показывает опыт, именно в этих простых вещах чаще всего кроется причина неэффективности.
В целом низкая комплаентность представляет собой серьезную проблему в лечении остеопороза. Они проявляются в невыполнении или неполном выполнении врачебных рекомендаций по диете и физической активности, полном отказе от лечения, в прерывании начатой терапии. Даже создание удобных для приема лекарственных форм (назначающихся один раз в неделю, раз в год, выпуск препаратов с меньшим количеством побочных эффектов и т. д.) не ведет к значительному улучшению показателей комплаентности. Одна из возможных причин — неправильные или неполные представления пациентов об остеопорозе, непонимание целей и способов его лечения. Так, по результатам проведенного нами исследования, из 128 опрошенных пациентов с остеопорозом 54 чел. (42%) не знали о том, что пропуск приема назначенного препарата повышает риск переломов; 118 опрошенных (92%) считали, что для предотвращения переломов достаточно только приема витамина D и кальция в терапевтических дозах; 55 чел. (43%) были уверены, что фармакотерапия позволяет отказаться от выполнения физических упражнений. При этом подавляющее большинство (> 90%) врачей, осуществлявших лечение этих больных, отмечали, что на каждой или почти на каждой консультации сообщают пациентам информацию по этим вопросам. Низкая информированность приводила к снижению мотивации больных: пациенты не видели преимуществ от лечения остеопороза, и каждый третий из них не принимал антиостеопоротических препаратов.
Кроме того, комплаентность ухудшают и другие факторы: тяжелое физическое состояние пациента; финансовые сложности; отсутствие поддержки в семье; негативный опыт (произошедшие переломы на фоне назначенной терапии); отрицание пациентом личной ответственности за свое здоровье. Особое место в ряду этих факторов занимают психосоциальные составляющие, прежде всего наличие у больного депрессивного расстройства. По данным популяционных исследований, депрессивные симптомы, превышающие пороговый уровень, имеют около 42% населения, а в старших возрастных группах этот показатель возрастает до 76% [4].
Взаимосвязи остеопороза и депрессивных расстройств носят сложный и многоуровневый характер. Имеется ряд общих факторов риска и патогенетических составляющих, ассоциированных с обоими заболеваниями: женский пол, преклонный возраст, хроническая боль, хронические инвалидизирующие заболевания, нарушения питания (низкий вес или, наоборот, абдоминальное ожирение), длительная иммобилизация, нарушения сна, склонность к падениям из-за немощности, гиперкортизолемия, дефицит витамина D и т. д. Специфические для пожилых людей факторы риска депрессии, имеющие отношение и к остеопорозу, падениям и переломам — ухудшение зрения и слуха, нарушения сна, недавнее выявление нового заболевания, курение и злоупотребление алкоголем [5]. Последние два — доказанные факторы риска остеопороза. Доказано, что депрессивные расстройства ведут к снижению минеральной плотности кости и увеличению риска переломов. В свою очередь, депрессия ухудшает течение остеопороза, замедляя реабилитацию и снижая приверженность лечению.
Затрудняют диагностику депрессии особенности клинической картины этой патологии в пожилом возрасте. Это отсутствие или минимальная выраженность печали, тоски, жалоб на плохое настроение и манифестация только (или преимущественно) соматическими нарушениями: упорными болями разной локализации, вегетативной дисфункцией, ухудшением физической работоспособности, изменениями сна, аппетита, веса [6]. Все вышеназванное диктует необходимость своевременного целенаправленного выявления и лечения депрессии у больных с остеопорозом, равно как и выявление и лечение остеопороза у пациентов с депрессий в общемедицинской сети, что согласуется с рекомендациями ВОЗ, но пока не является повседневной практикой.
С другой стороны, низкая комплаентность при остеопорозе может быть связана с отсутствием у врачей навыков консультирования пациента с этой патологией. Распространенными ошибками являются злоупотребление медицинскими терминами, директивный (патерналистский) подход к назначению рекомендаций, игнорирование психологических особенностей и обстоятельств жизни больного, чрезмерные попытки «подтолкнуть» пациента к принятию единственно правильного (с точки зрения врача) решения, культурные, языковые барьеры и т. д. Поэтому на сегодняшний день существует необходимость приобретения врачами навыков поведенческого консультирования. Такое консультирование направлено на модификацию образа жизни и систематический прием лекарств у пациента, еще не имеющего симптомов заболевания (и проблем, связанных с ним), однако имеющего высокий риск осложнений. Ключевыми особенностями поведенческого консультирования при остеопорозе являются умение врача определить уровень знаний пациента о его болезни и индивидуальном риске переломов, умения оценить готовность больного к лечению, найти индивидуальные источники мотивации пациента и грамотное побуждение больного к изменению поведения (диете, физическим упражнениям, приему медикаментов).
В целом возможные пути повышения комплаентности при остеопорозе просматриваются по следующим направлениям. Во-первых, это — улучшение качества взаимодействия врача и пациента. Так, ряд исследований свидетельствует об эффективности образовательных программ для врачей (по выявлению и лечению депрессии, тренингов по проведению профилактического мотивационного интервью и т. д.), хотя этот вопрос требует дальнейшего изучения [7]. Во-вторых, хорошо зарекомендовали себя образовательные программы — так называемые «Школы здоровья для больных остеопорозом». Кроме того, желательно долгосрочное ведение пациента с остеопорозом одним врачом, что позволяет проводить мониторинг факторов риска, наблюдать и консультировать его в динамике, осуществлять коррекцию терапии с учетом сопутствующей патологии, психологическую поддержку и работу с семьей. Оптимальным образом проводить такую работу позволяют компетенции врача общей практики, однако любой квалифицированный специалист может взять на себя функции «врача-менеджера» и проводить качественное лечение больного с остеопорозом.
Литература
О. М. Лесняк, доктор медицинских наук, профессор
А. Г. Закроева, кандидат медицинских наук, доцент
ГБОУ ВПО УГМА Минздравсоцразвития России, Екатеринбург
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
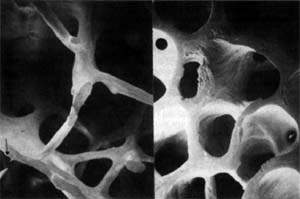 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
маркеры
мочи
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
При этом снижение МПК шейки бедра и увеличение маркеров костной резорбции, независимо друг от друга, связаны с высоким риском переломов шейки бедра. Для оценки эффективности проводимой терапии рекомендуется исследовать биохимические маркеры через каждые три месяца после начала лечения. При исследовании биохимических маркеров необходимо принимать во внимание факторы, влияющие на воспроизводимость результатов: диета, условия хранения материала, биологические факторы (циркадные и сезонные колебания, менструальный цикл, возраст, пол, наличие сопутствующих заболеваний и т. д.).
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.