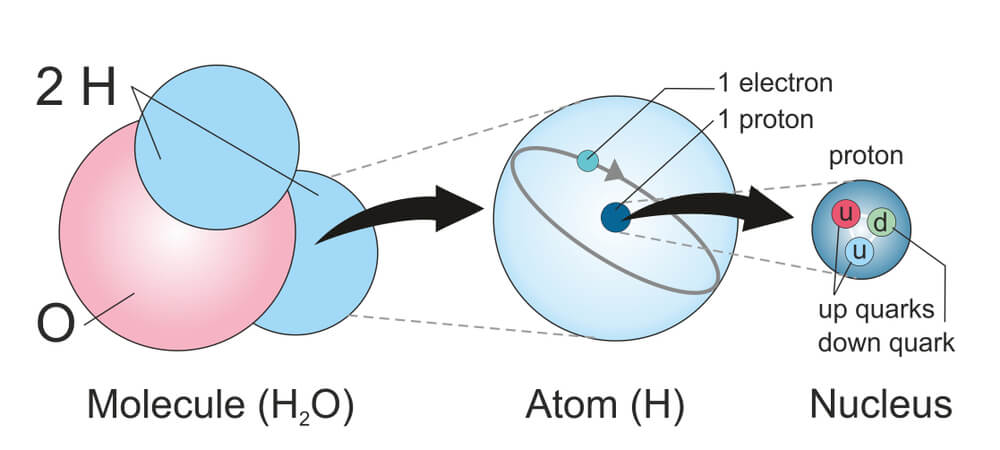
Что находится внутри ядра атома
Что находится внутри атомного ядра?
Большая часть массы атома сосредоточена в его ядре. Ядро атома окружено чрезвычайно маленькими и легкими электронами, которые вращаются в атоме, но не нарушают значительного пустого пространства между ядром и границами атома. Чтобы получить четкое изображение ядра атома, нужно сначала знать, что происходит с электронами и остальной частью атома.
Электроны вокруг ядра атома
Электроны имеют свои специфические орбиты, а именно: S, P, D, F, а затем G. Каждая орбита представляет собой сферическую оболочку, и имена выводятся из спектра испускаемого света из этих оболочек, описывающих характер спектральных линий. Другой факт об электронах заключается в том, что они находятся везде, что позволяют квантовые законы.
Электроны вращаются вокруг плотного ядра атома в облаках отрицательного заряда.
В атоме углерода, например, шесть электронов. Два из них занимают сферическую оболочку в центре атома, а остальные четыре распределены в смеси сферических оболочек и трехлопастных оболочек. Таким образом, ядро окружено чем-то вроде облаков отрицательного заряда, а электроны находятся везде, где только могут быть, но не заполняют пустые пространства. Электроны помогают создавать молекулы.
Электронные связи между атомами
Если два атома углерода подходят достаточно близко, их ближайшие электроны взаимодействуют и образуют одинарную связь. Эта связь в химии называется сигма-связью. Затем облака изгибаются и соединяются, создавая «Пи-связь», которая выглядит как деревья, соединяющие верхние ветви над улицей.
Связи становятся все более и более сложными в различных ситуациях, и это выходит за рамки данной статьи. Тем не менее одна вещь остается постоянной во всех этих связях: электроны все еще рассеяны в относительно огромном облаке вокруг очень плотного ядра, и там все еще много пустого пространства. Электрические поля и электронные облака удерживают эту огромную пустоту вместе. Что же тогда находится внутри ядра атома?
Протоны и нейтроны
Внутри протонов и нейтронов
В 1950-х годах наука поняла, что протоны и нейтроны состоят из более мелких частиц. Несколько лет спустя, в 1964 году, американский физик Мюррей Гелл-Манн представил кварки. Он не знал, сколько типов кварков существует, но сегодня открыто по крайней мере шесть кварков: верхний (символ u α ), нижний (символ d α ), странный (символ s α ), очарованный (символ c α ), красивый (символ b α ) и истинный (символ t α ).
Если рассматривать протон как баскетбольный мяч, каждый кварк будет меньше песчинки. Следовательно, большая часть протона и нейтрона также является пустым пространством, в то время как кварки перемещаются со скоростью, близкой к скорости света.
Маленькие ядра удерживают частицы настолько малы, что наше самое мощное и самое точное оборудование не может их видеть. В то же время они обладают самой сильной силой, когда-либо существовавшей в пустых пространствах и сверхмалых частицах, называемых кварками.
Общие вопросы об атомном ядре
Вопрос: Что находится в ядре атома?
Ядро атома состоит из протонов и нейтронов. Протоны несут положительный заряд, равный электронам, вращающимся вокруг, а нейтроны не несут заряда, но весят столько же, сколько протоны.
Вопрос: Какова функция ядра атома?
Ядро атома создает силу, необходимую для того, чтобы держать атом вместе и в порядке. Это самая тяжелая часть атома и очень плотная. Размер ядра по отношению ко всему атому подобен мячу на футбольном поле.
Вопрос: Ядро атома нейтрально?
Ядро атома несет положительный электрический заряд. Однако атом нейтрален, поскольку количество электронов с отрицательным зарядом равно количеству протонов в ядре.
Что у атома внутри
А в самом конце XIX века вдруг выяснилось, что атом вовсе не неделимый! Он состоит из крошечного тяжёлого ядра и очень лёгких электронов, крутящихся вокруг. Потом оказалось, что и ядро можно разделить на части (хотя и очень трудно!): оно состоит из двух очень похожих видов частиц — протонов и нейтронов. Их массы почти равны, а у электрона масса почти в 2000 раз меньше (соотношение примерно как между человеком и мышкой).
Главное различие между этими частицами в том, что протоны притягивают электроны (и сами к ним притягиваются). А два протона (или два электрона) отталкиваются друг от друга с такой же силой. Эти силы называются электрическими. Нейтроны же вовсе не притягивают электроны, да и между собой и с протонами хоть и взаимодействуют, но совсем по-другому (про это мы скажем чуть ниже): в электрическом взаимодействии они не участвуют.
Не путайте электрическую силу с гравитационным притяжением! В самом деле, все тела, имеющие массу, притягивают друг друга. Но эта сила крошечная даже для таких «средне-тяжёлых» тел, как, например, мы с вами. Большая она только тогда, когда одно из тел очень тяжёлое — звезда, планета или хотя бы астероид. А сила гравитационного притяжения протонов (и тем более протона и электрона) ничтожна.
Электрическая сила, напротив, очень велика: если бы можно было закрепить в каком-то месте протон (и воздух, конечно, убрать), а в трёх сантиметрах над ним поместить другой протон, то второй протон не упал бы вниз, а полетел бы вверх — отталкивание одного протона сильнее гравитационного притяжения всей Земли!
Обычно вещи вокруг нас не имеют электрического заряда — в них столько же электронов, сколько и протонов. Но от некоторых атомов электроны довольно легко отрываются. И вот если отодрать от атомов одного предмета тысячу или миллион-другой электронов и «прицепить» к атомам другого предмета, эти два предмета окажутся заряжены: один — положительно (в нём протонов больше, чем электронов), а другой — отрицательно (в нём лишние электроны). А ведь тысяча протонов, если они рядом, притягивают каждый электрон в тысячу раз сильнее, чем один протон. И начнут эти два предмета притягиваться друг к другу. Случалось вам видеть что-нибудь похожее? Например, когда вы старательно причёсываетесь пластмассовой расчёской, а волосы сами собой поднимаются ей навстречу?
И ещё. В отличие от, например, животных одного вида, которые всё-таки немножко отличаются друг от друга, все протоны (или все нейтроны, или электроны) совершенно одинаковы. Так что, например, электрон, «потерявший» свой атом, уже не сможет найти его среди других таких же.
Задача 1
Взяли две пары маленьких незаряженных шариков. В первой паре от атомов одного шарика «оторвали» 100 электронов и «посадили» их на второй шарик. Во второй паре то же самое сделали с тысячей электронов. Потом шарики в каждой паре разнесли на одно и то же довольно большое расстояние. (Пары далеко друг от друга, гораздо дальше, чем шарики в каждой паре.) Будут ли шарики каждой пары притягиваться или отталкиваться? В какой паре сила их взаимодействия больше и во сколько раз?
Шарики каждой пары притягиваются, во второй паре притяжение сильнее в 100 раз. Действительно, во втором случае «без электрона» осталось 1000 протонов, в 10 раз больше, чем в первом. Они притягивают каждый «убежавший» электрон в 10 раз сильнее. Но и «убежавших» электронов во втором случае в 10 раз больше! Значит, суммарная действующая на них сила отличается в 100 раз.
Заметим, что остальные, «неразлучённые» протоны и электроны тоже притягивают или отталкивают каждую заряженную частицу, но их действие скомпенсировано: с какой силой протон притягивает, с такой же электрон рядом с ним отталкивает, или наоборот.
Электрическое притяжение к протонам и держит электроны в атоме, не даёт им улететь. Как мы вскоре убедимся, оно же скрепляет атомы в молекулы. Но не только! Оно же заставляет молекулы одних тел действовать на молекулы других. Если не считать силы гравитационного притяжения, с которой все мы знакомимся с детства (глядя, как падают на пол выпущенные из руки игрушки), все остальные наблюдаемые нами физические явления вызваны как раз электрической силой. Упругость пружины, трение, прилипание разных вещей друг к другу или, наоборот, их взаимное отталкивание — за всё это отвечает взаимодействие электронов одних атомов с ядрами и электронами других.
Но вернёмся к нашим атомам. В нормальной ситуации атом электронейтрален, то есть не имеет заряда: у него электронов столько, сколько протонов в ядре. Если это не так (например, кто-то похитил у атома электрон или атом где-то захватил себе чужой), такой «калечный» атом называется ионом. Тогда он заряжен — положительно, если электронов не хватает, и отрицательно, если есть лишние.
Теперь можно догадаться, чем отличаются друг от друга разные сорта атомов: у них разное количество электронов. И, соответственно, протонов в ядре. Номер элемента в таблице Менделеева (число, написанное крупно в правом верхнем углу каждой клетки) — это число протонов в атомах этого элемента. А как узнать количество нейтронов? По массе атома, ведь массы протонов и нейтронов равны! Например, в атоме водорода — самом маленьком и самом лёгком — всего один протон. А в ядре атома гелия два протона, и при этом атом гелия в 4 раза тяжелее атома водорода. Электроны не в счёт — значит, в ядре гелия 2 нейтрона!

Но почему эта масса нецелая? Не может же, например, у хлора быть 18 с половиной нейтронов? Конечно, нет. Просто это значит, что в природе бывают атомы с 17 электронами, 17 протонами и 18 нейтронами, а бывают такие, у которых электронов и протонов столько же, а число нейтронов отличается. И те и другие — атомы хлора, ведь электронов и протонов столько же. Такие «подвиды» атомов одного вида называют изотопами. В таблице Менделеева написана средняя масса атомов каждого вида (с учётом распространённости их изотопов).
В большинстве клеток средняя масса близка к целому числу. Это значит, что, как правило, в природе больше всего какого-то одного изотопа атомов каждого вида, а атомы с другим количеством нейтронов встречаются не так уж часто. Почти всегда можно не обращать на них внимания и округлять массу до ближайшего целого числа.
Когда хотят уточнить, какой именно изотоп имеется в виду, заряд ядра и его массу пишут прямо рядом с названием элемента: например, \(<>^<1>_<1>\mathrm
Ну-ка, проверим — всё ли понятно?
Задача 2
Сколько у атома \(<>^<12>_<6>\mathrm
\(<>^<12>_<6>\mathrm
Задача 3
Если 1 кг воды «расщепить» на кислород и водород, сколько получится граммов газа кислорода?
В молекуле воды на каждый атом кислорода приходится 2 атома водорода. Но в атоме кислорода 8 протонов + 8 нейтронов, он весит в 16:2 = 8 раз больше, чем оба эти атома водорода, вместе взятые (в них ведь всего по одному протону). Значит, на атомы кислорода приходится 8/9 всей массы воды. Когда атомы кислорода «отцепятся» от атомов водорода и «слепятся» по два в молекулы кислорода О2, их суммарная масса останется прежней: 8/9 кг.
Задача 4
Во что превратится атом кислорода \(<>^<16>_<8>\mathrm
Если добавить нейтрон, получится тяжёлый изотоп кислорода, \(<>^<17>_<8>\mathrm
Задача 5
У хлора два распространённых изотопа. Более редкий из них имеет 20 нейтронов. Во сколько раз изотопов хлора-37 в природе меньше, чем изотопов хлора-35?
Если бы был только изотоп \(<>^<35>_<17>\mathrm
(Более аккуратный подсчёт по указанному в таблице значению средней массы, (35,45−35):2 = 0,225, не даёт более точной оценки — ведь есть ещё другие изотопы хлора. Хоть их и совсем мало, но точнее сосчитать они помешают.)
Итак, изотоп \(<>^<37>_<17>\mathrm
Контрольная задача
В первом списке молекулы состоят из одинаковых атомов (атомов только одного вида); во втором — каждая молекула состоит из разных атомов, но все молекулы одинаковы. В третьем — вещества состоят из смеси молекул разных видов.
Художник Мария Усеинова
1 А разобрались ли вы? Для проверки и чтобы понять, как непросто было до всего этого догадаться, предлагаем вам решить «контрольную задачу» в конце статьи.
2 Вообще-то, когда договаривались, про электроны и протоны ещё ничего не знали — это было лет за 150 до их открытия. Тогда положительным назвали заряд, который получается на стекле, если его потереть шёлковой тряпочкой. Теперь мы знаем, что электроны со стекла «убегают» на шёлк.
3 Зато на этих маленьких расстояниях они очень большие — надо ведь «победить» электрическое отталкивание! Поэтому они так и называются — «сильные силы» (strong force), сильное взаимодействие.
4 Тут мы чуть-чуть обманываем читателя, но это не беда: дальше придётся обманывать ещё сильнее.
Ядра атомов: в самом сердце материи

Рис. 1
Ядро атома получается крохотным, его радиус в 10 000–100 000 раз меньше всего атома. Каждое ядро содержит определённое количество протонов (обозначим его Z) и определённое количество нейтронов (обозначим его N), скреплённых вместе в виде шарика, по размеру не сильно превышающего сумму их размеров. Отметим, что протоны и нейтроны вместе часто называют «нуклонами», а Z+N часто называют A – общее количество нуклонов в ядре. Также Z, «атомное число» – количество электронов в атоме.
Типичное мультяшное изображение атома (рис. 1) чрезвычайно преувеличивает размер ядра, но более-менее правильно представляет ядро как небрежно соединённое скопление протонов и нейтронов.
Содержимое ядра
Откуда нам известно, что находится в ядре? Эти крохотные объекты просто охарактеризовать (и это было просто исторически) благодаря трём фактам природы.
1. Протон и нейтрон отличаются по массе всего лишь на тысячную часть, так что если нам не нужна чрезвычайная точность, можно сказать, что у всех нуклонов масса одинакова, и назвать её массой нуклона, mнуклон:
(≈ означает «примерно равно»)
2. Количество энергии, необходимой для удержания вместе протонов и нейтронов в ядре, относительно мало – порядка тысячной доли части энергии массы (E = mc 2 ) протонов и нейтронов, так что масса ядра почти равна сумме масс его нуклонов:
3. Масса электрона равняется 1/1835 массы протона – так что почти вся масса атома содержится в его ядре:
Тут подразумевается наличие четвёртого важного факта: все атомы определённого изотопа определённого элемента одинаковы, как и все их электроны, протоны и нейтроны.
Поскольку в самом распространённом изотопе водорода содержится один электрон и один протон:
масса атома Mатом определённого изотопа просто равна Z+N, помноженному на массу атома водорода
и погрешность этих уравнений примерно равна 0,1%.
Поскольку нейтроны электрически нейтральны, электрический заряд Qядро ядра просто равен количеству протонов, помноженному на электрический заряд протона («e»):
В отличие от предыдущих уравнений, это уравнение выполняется точно.
Эти уравнения проиллюстрированы на рис. 2

Рис. 2
Используя открытия последних десятилетий XIX века и первых десятилетий XX, физики знали, как измерить в эксперименте оба обозначенных красным значения: заряд ядра в e, и массу любого атома в атомах водорода. Так что эти значения были известны уже в 1910-х. Однако правильно интерпретировать их смогли только в 1932 году, когда Джеймс Чедвик определил, что нейтрон (идею которого предложил Эрнест Резерфорд в 1920-м) является отдельной частицей. Но как только стало понятно, что нейтроны существуют, и что их масса практически равна массе протона, сразу же стало ясно, как интерпретировать числа Z и N — количество протонов и нейтронов. А также сразу родилась новая загадка – почему у протонов и нейтронов почти одинаковая масса.
Честно говоря, физикам того времени с научной точки зрения страшно повезло, что всё это было так легко установить. Закономерности масс и зарядов настолько просты, что даже самые долгие загадки были раскрыты сразу после открытия нейтрона. Если бы хотя бы один из перечисленных мною фактов природы оказался неверным, тогда на то, чтобы понять, что происходит внутри атомов и их ядер, ушло бы гораздо больше времени.

Рис. 3
Откуда нам известно, что ядро атома маленькое?
Одно дело – убедить себя, что определённое ядро определённого изотопа содержит Z протонов и N нейтронов; другое – убедить себя, что ядра атомов крохотные, и что протоны с нейтронами, будучи сжатыми вместе, не размазываются в кашу и не разбалтываются в месиво, а сохраняют свою структуру, как подсказывает нам мультяшное изображение. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу; сквозь неё ничего не видно. Поскольку она непрозрачная, вы можете решить, что атомы алюминия:
1. Настолько крупные, что между ними нет просветов,
2. Настолько плотные и твёрдые, что свет сквозь них не проходит.
Насчёт первого пункта вы будете правы; в твёрдом веществе между двумя атомами почти нет свободного пространства. Это можно наблюдать на изображениях атомов, полученных при помощи особых микроскопов; атомы похожи на маленькие сферы (краями которых служат края электронных облаков), и они довольно плотно упакованы. Но со вторым пунктом вы ошибётесь.

Рис. 4
Если бы атомы были непроницаемыми, тогда сквозь алюминиевую фольгу ничто не смогло бы пройти – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Всё, что вы направили бы в сторону фольги, либо застревало бы в ней, либо отскакивало бы – точно так же, как любой кинутый объект должен отскочить или застрять в гипсокартонной стенке (рис. 3). Но на самом деле электроны высокой энергии легко могут пройти через кусочек алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра, и так далее. Электроны и другие частицы – почти все, если точнее – могут пройти через материал, не потеряв ни энергии, ни импульса в столкновениях с чем-либо, содержащимся внутри атомов. Лишь малая часть их ударится об атомное ядро или электрон, и в этом случае они могут потерять большую часть своей начальной энергии движения. Но большая часть электронов, протонов, нейтронов, рентгеновских лучей и всякого такого просто спокойно пройдут насквозь (рис. 4). Это не похоже на швыряние гальки в стену; это похоже на швыряние гальки в сетчатый забор (рис. 5).

Рис. 5
Чем толще фольга – к примеру, если складывать всё больше и больше листов фольги вместе – тем вероятнее частицы, запущенные в неё, столкнуться с чем-либо, потеряют энергию, отскочат, изменят направление движения или даже остановятся. То же было бы верно, если бы вы наслаивали одну за другой проволочные сетки (рис. 6). И, как вы понимаете, из того, насколько далеко средняя галька может проникнуть сквозь слои сетки и насколько велики разрывы в сетке, учёные могут подсчитать на основании пройденной электронами или атомными ядрами дистанции, насколько атом пустой.

Рис. 6
Посредством таких экспериментов физики начала XX века установили, что внутри атома ничто – ни атомное ядро, ни электроны – не может быть большим, чем одна тысячная миллионных миллионных долей метра, то есть в 100 000 раз меньше самого атома. То, что такого размера достигает ядро, а электроны по меньшей мере в 1000 раз меньше, мы устанавливаем в других экспериментах – например, в рассеянии высокоэнергетических электронов друг с друга, или с позитронов.
Чтобы быть ещё более точным, следует упомянуть, что некоторые частицы потеряют часть энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это дальнодействующий эффект, и столкновением на самом деле не является. Итоговая потеря энергии значительна для летящих электронов, но не для летящего ядра.
Вы можете задуматься над тем, похоже ли то, как частицы проходят сквозь фольгу, на то, как пуля проходить сквозь бумагу – расталкивая части бумаги в стороны. Возможно, первые несколько частиц просто расталкивают атомы в стороны, оставляя большие отверстия, через которые проходят последующие? Мы знаем, что это не так, поскольку мы можем провести эксперимент, в котором частицы проходят внутрь и наружу контейнера, сделанного из металла или стекла, внутри которого вакуум. Если бы частица, проходя через стенки контейнера, создавала отверстия по размеру превышающие атомы, тогда внутрь устремились бы молекулы воздуха, и вакуум бы исчез. Но в таких экспериментах вакуум остаётся!
Также довольно легко определить, что ядро – это не особенно структурированная кучка, внутри которой нуклоны сохраняют свою структуру. Об этом уже можно догадаться по тому факту, что масса ядра очень близка к сумме масс содержащихся в нём протонов и нейтронов. Это выполняется и для атомов, и для молекул – их массы почти равны сумме масс их содержимого, кроме небольшой коррекции на связывающую энергию – и это отражено в том факте, что молекулы довольно легко разбить на атомы (к примеру, нагрев их так, чтобы они сильнее сталкивались друг с другом), и выбить электроны из атомов (опять-таки, при помощи нагрева). Сходным образом относительно легко разбить ядра на части, и этот процесс будет называться расщеплением, или собрать ядро из более мелких ядер и нуклонов, и этот процесс будет называться синтезом. К примеру, относительно медленно двигающиеся протоны или небольшие ядра, сталкивающиеся с более крупным ядром, могут разбить его на части; нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.

Рис. 7
Но чтобы понять, что это не является неизбежным, упомяну, что этими свойствами не обладают сами протоны и нейтроны. Масса протона не равняется примерной сумме масс содержащихся в нём объектов; протон нельзя разбить на части; а для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.