Что находится внутри молекулы
Атомы: строительные блоки молекул
Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Из чего состоит все вокруг или что такое молекула?
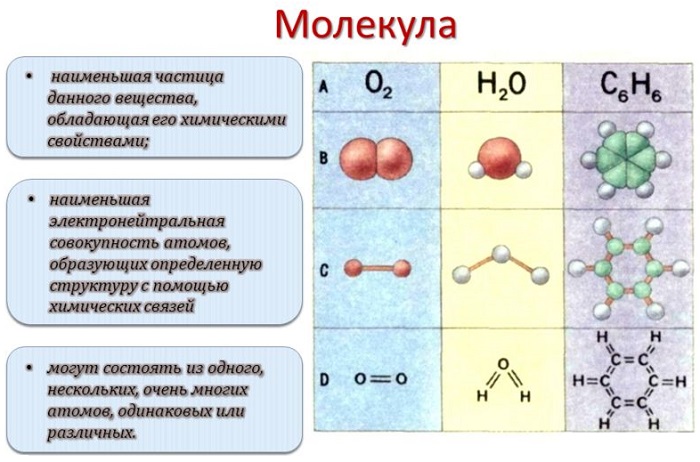
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных типов молекул. Понятие молекулы было принято в 1860 году на международном съезде химиков в Карлсруэ. Согласно принятому определению молекула – это наименьшая частица химического вещества, которая обладает всеми его химическими свойствами (растворимость, вкус, способность вступать в соединения и пр). Введение понятия молекулы подтолкнуло развитие физики, химии и других естественных наук. В более общем понимании молекулой называют частицу, образованную из двух или более атомов, соединенных между собой ковалентными связями.
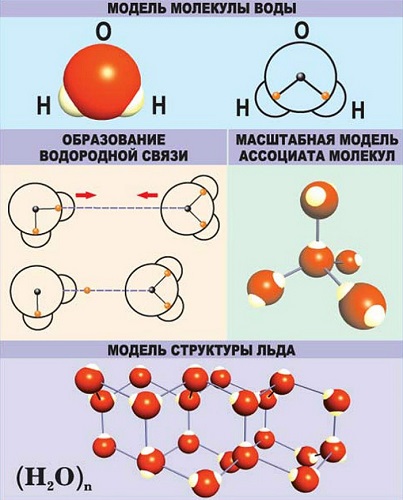
Молекула воды содержит 1 атом кислорода и 2 атома водорода
Атом – мельчайшая частица вещества, которая обладает всеми его физическими свойствами (цвет, твердость, плотность и пр.)
Когда атомы различных типов элементов соединяются вместе, они образуют молекулы, называемые соединениями. Так, вода состоит из сложных молекул, состоящих из 2 атомов водорода и 1 атома кислорода. Вот почему она называется H2O: у молекулы воды всегда будет в 2 раза больше атомов водорода, чем атомов кислорода. Существует чуть более 100 типов атомов, но типов различных веществ миллионы. Причина такого неравенства кроется в том, что они состоят из различных типов молекул.
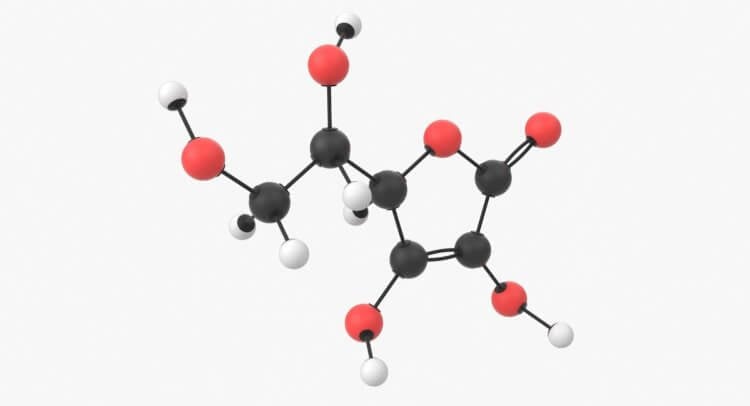
Важно понимать, что молекулы состоят не только из различных типов атомов, но и из различных соотношений. Как и в приведенном выше примере с водой, молекула воды состоит из двух атома водорода и одного атома кислорода, что записывается как H2O. Другими примерами являются углекислый газ (C02), аммиак (NH3) и сахар или глюкоза (C6H12O6). Некоторые молекулярные формулы могут получиться довольно длинными и сложными. Давайте посмотрим на молекулу сахара:
Чтобы она получилась, нужны определенные атомы в определенном количестве. Но молекулы могут быть гораздо больше. Одна молекула витамина С состоит из 20 атомов (6 атомов углерода, 8 атомов водорода и 6 атомов кислорода – C6H8O6). Если взять эти 20 атомов витамина С и смешать, соединяя их вместе в другом порядке, то получится совершенно другая молекула, которая не только выглядит по-другому, но и действует иначе.
Молекула витамина С выглядит так
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются вместе в цепи, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой была вылита некоторая ее часть, даже после того, как колба будет возвращена в вертикальное положение.
Факты о молекулах
Чтобы всегда быть в курсе последних научных открытий, подписывайтесь на наш новостной канал в Telegram
Химические связи
Молекулы и соединения удерживаются вместе силами, называемыми химическими связями. Существует четыре типа химических связей, которые удерживают большинство соединений вместе: ковалентные связи, ионные связи, водородные и металлические, однако в качестве основных выделяют ковалентные и ионные, так как они связаны с электронами. Как известно, электроны вращаются вокруг атомов в оболочках. Эти оболочки хотят быть «полными» электронов. Когда они не заполнены, то будут пытаться соединиться с другими атомами, чтобы получить нужное количество электронов и заполнить их оболочки.
Ковалентные связи делят электроны между атомами. Это происходит, когда получается, что атомы делятся своими электронами, чтобы заполнить свои внешние оболочки. В свою очередь ионные связи образуются, когда один электрон передается другому. Это происходит, когда один атом отдает электрон другому, чтобы сформировать баланс и, следовательно, молекулу или соединение.
Еще больше увлекательных статей о том, как ученые дробят реальность на атомы, читайте на нашем канале в Яндекс.Дзен. Там выходят статьи, которых нет на сайте!
Знания о свойствах и строении молекул легли в основу современной науки и нашего понимания Вселенной
Немаловажным также является тот факт, что молекулы всегда находятся в движении. В твердых телах и жидкостях они находятся очень близко друг к другу, а их движение можно сравнить с быстрой вибрацией. В жидкостях молекулы могут свободно перемещаться между собой, как бы скользя. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, а потому молекулы движутся даже более свободно, чем в жидкости. Для конкретного соединения в данном состоянии (твердом, жидком или газообразном) скорость молекулярного движения возрастает с увеличением абсолютной температуры.
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.
Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
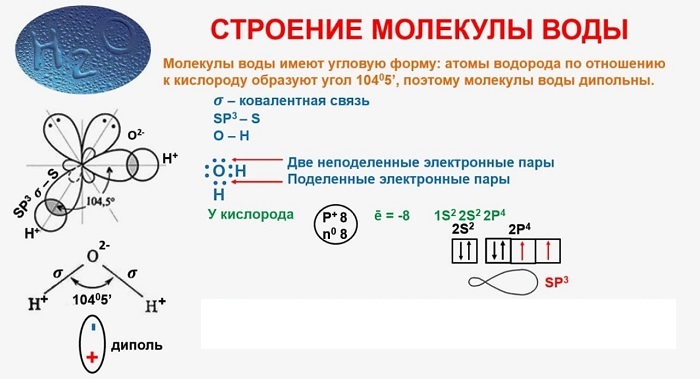
В качестве примера рассмотрим строение наименьшей частицы воды.
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
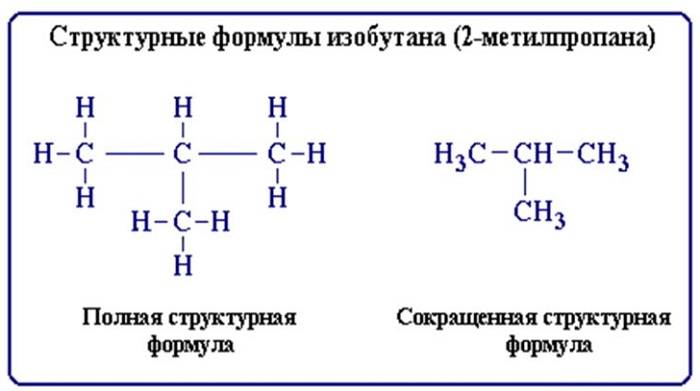
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.
В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Атом и молекула – что это и отличия
Мельчайшие частицы – атом и молекула, об этом знают многие люди, но не все могут рассказать подробно, что же это такое. Также сложно, не имея специальных знаний, объяснить, в чем состоят отличия между этими структурами. Из различных исторических источников известно, что про эти структурные единицы знали еще древнегреческие ученые. Так философ Демокрит одним из первых высказал предположение о том, что все известная людям материя состоит из крошечных по своим размерам, неделимых человеческому глазу частиц. Их он назвал атомами. Современные ученые подтвердили эту теорию и установили опытным путем, что вещества состоят из атомов и молекул. Для того чтобы установить разницу межу этими структурными единицами, необходимо сначала дать им определение, а затем сравнить, чтобы определить, в чем состоят различия.
Определение понятий
На первых этапах изучения считалось, что атом и молекула – элементы неделимые. Более глубокие исследования и всесторонние изучения позволили опровергнуть это мнение. Сегодня этими терминами обозначают самостоятельные элементы, которые образуют все, что окружает человека.
Атомом называют мельчайшую структурную единицу, составляющую любое вещество.
Молекулой принято считать элементарную частицу, из которых состоят все окружающие людей вещества, материи и компоненты.
Сравнение
После приведенных определений можно приступить к сравнению элементарных структурных единиц вещества. Атом является наименьшей ее составляющей. Он имеет собственную массу и размер. Основная задача – определение, какими свойствами будет обладать то или иное химическое вещество.
Нужно учитывать, что атом не является конечным элементом. Он в свою очередь делится на ядро и электроны, которые совершают движение по орбите, расположенной вокруг ядра. Подобное строение и определяет, какими свойствами будет обладать то или иное вещество. Особенностью атома является то, что его невозможно увидеть вне компонента, в свободном состоянии. Все атомы имеют тесные связи между собой, которые и образуют молекулу. Происходит это благодаря электрическим зарядам частиц, из которых состоят атомы.
Молекула — это единица, составляющая вещество. В состав молекул входят атомы. Разное их количество определяет свойства. Атомы внутри молекулы имеют межатомные связи. Каждая молекула состоит из атомных ядер и внутренних электронов. Они совершают движение по своим орбитам. В состав входят также внешние валентные электроны. В разных молекулах находится разное количество атомов. Это свойство и определяет разнообразие химических веществ и компонентов. Молекула имеет сложную архитектурную постройку. Так у каждого атома свое место внутри молекулы. Количеством атомов в ней определяются свойства – химические реакции и превращения. Имеющиеся свойства влияет порядок и конфигурация соединения всех атомов. Атомная постройка, которая образует молекулу, может быть жесткой. Также бывают и исключения. Особенность мельчайшей единицы – постоянное движение. Атомы никогда не останавливаются, они продолжают колебание на положенном ему месте в молекуле, чтобы удержать равновесие.
Выводы
Атомы и молекулы – структурные единицы, образующие любое вещество. Атомы образуют молекулу. В составе атома присутствуют еще более мелкие элементы — ядро и электроны, которые движутся по своим орбитам вокруг ядра. Молекулы состоят из атомов (одного или нескольких).
Атом имеет электрический заряд (положительный или отрицательный) а молекула по этому показателю полностью нейтральная. Только молекула в веществе обладает способностью к самостоятельному существованию.
Что такое молекула?
Определение:
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.
Впечатление художника о простых и сложных органических (углеродосодержащих) молекулах, обнаруженных в космосе.
Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (H2O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
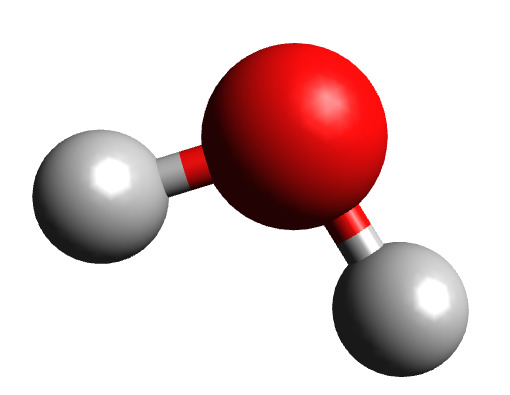
Схема молекулы воды, которая состоит из двух атомов водорода и одного атома кислорода.
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.
Сканирующий туннельный микроскоп
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.