Что находится внутри батарейки
Что внутри батарейки и как она работает?
Автор Вячеслав Питель · 13:56 05.02.2019
Здравствуйте, уважаемые читатели сайта Uspei.com. В детстве, глядя на молнии, я часто задавалась вопросом, а можно ли поймать их в какую-нибудь изолированную банку и потом питать ей электроприборы? И не замечала, что нечто похожее всегда уже было под рукой – батарейка. Она тоже каким-то образом питала технику, и даже будучи такой маленькой, делала это часами.
Что же такое батарейка – контейнер для электричества или мини электростанция, которая его производит? Как она работает, почему самые плохие из них вздуваются или протекают, и зачем когда-то давно приходилось кусать батарейки?
Кто изобрел батарейку?
На основе этого Алессандро собрал “вольтов столб”, где находились диски из цинка и меди, соединенные проволокой, а также ткань, пропитанная кислотой. Цинковые пластины растворялись, медные выделяли пузырьки газа, а по проволоке протекал электрический ток. Так был создан прообраз современной батарейки, которая работала на взаимодействии двух металлов в электролите.
Что внутри батарейки?
Как только мы жмем кнопку “включить” создается цепь и электроны через гвоздь устремляются в положительную часть батарейки, на своем пути они проходят через электроприбор и заставляют его работать. Спустя время в катоде образовываются побочные элементы, которые больше не дают электронам перемещаться и батарейка садится.
Чем дешевые батарейки отличаются от дорогих?
Самые простые батарейки, которые стоят копейки, внутри выглядят примерно также, но работают на других материалах. Называются солевые и выпускаются в тех же форматах “три А”, “два А” “С” и “D”.
Иногда этому способствует брак при производстве или несоблюдение очень узкого температурного режима. Начинаются неправильные химические реакции, выделение газа и вздутие батарейки. Хорошие алкалиновые источники таких недостатков лишены, да и корпус у них прочнее.
Почему раньше грызли батарейки?
Как я уже говорила, батарейка садится, когда в катоде накапливаются побочные элементы, они оседают слоем на внутренней части оболочки. Так вот когда грызли довольно податливый корпус этот слой чуть чуть разрушался и батарейка временно оживала.
Но сейчас повторять такое ни в коем случае не советую. Особой пользы не получите, а химии поесть можете. или технику испортите. Лучше вместо этого взять нормальную алкалиновую батарейку с хорошей емкостью. Во второй части расскажу про аккумуляторы и связанные с ними мифы. Например, как правильно их заряжать и что будет, если делать это дольше, чем нужно.
Батарейка и всё о ней

Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены.
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
Как работает батарейка
Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Как устроена батарейка
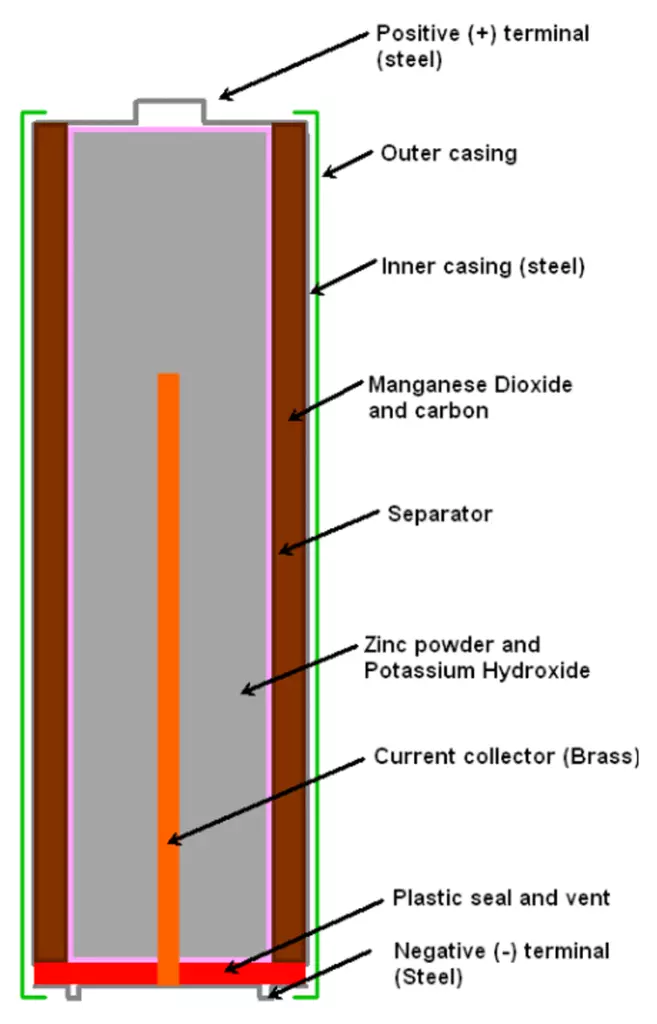
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
Щелочная батарейка. /Роджер Кларк
Это может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи — например, к лампочке, — цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки — что это такое?
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
Принцип работы и устройство батарейки
Батарейки являются незаменимыми источниками электроэнергии. Благодаря ним человек не зависит от проводов и становится более мобильным. В этой статье будет рассказано о том, из чего состоит элемент питания и в чем заключается принцип работы батареек.
Из чего состоит
Батарейка состоит из картонного, пластмассового или металлического корпуса. В портативных источниках напряжение внешняя оболочка, как правило, не участвует в электрохимической реакции.
Внутри батареи находится положительный стержень и электролит, который также принимает участие в передаче электрического тока. Конструкция элемента питания может быть различной, но практически у всех типов источников тока присутствуют перечисленные детали.
При необходимости, можно достать такие элементы, аккуратно разобрав батарейку и достав содержимое из её корпуса для изучения.
Устройство батарейки
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.
Цилиндрической
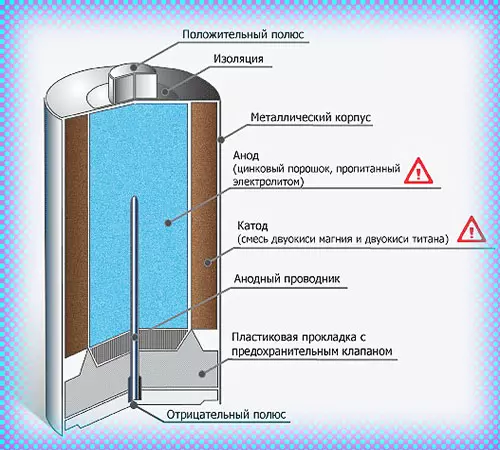
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.
Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
Особенности химического состава
В зависимости от веществ, которые используют внутри батареи, такие изделия могут быть солевыми, щелочными или литиевыми. Каждая группа имеет свои особенности химического состава.
Солевой
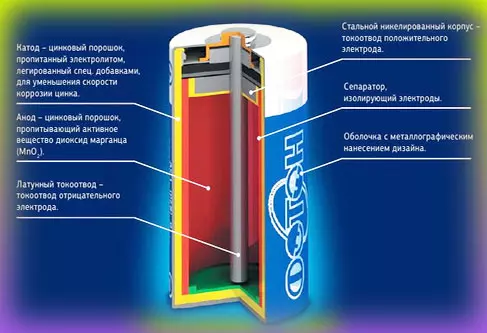
В качестве катода в солевой батарее используется цинк, а анод представляет собой стержень, изготовленный из графита и MnO2. Электролит в элементе этого типа – это хлорид аммония или калия. Для придания необходимой консистенции в него также добавляют специальный загуститель.
Элементы питания этого типа, в которых в качестве анода используются серебро, обладают значительно большим сроком годности. Называются такие элементы серебряно-цинковыми и стоят значительно дороже простых солевых батареек.
Щелочной
Строение алкалиновой батарейки практически не отличается от солевой. Разница заключается только в том, что в щелочном элементе серединный стержень устанавливается на отрицательный вывод, а не на положительный.
Химический состав изделия этого типа следующий:
Основное преимущество марганцево-щелочных элементов перед солевыми батареями заключается в большей ёмкости.
Литиевой
Литиевые неперезаряжаемые элементы имеют следующий химический состав:
Литиевые элементы питания работает в различных устройствах значительно дольше щелочных и солевых изделий, но и стоимость их на порядок выше.
Откуда берётся ток
В отличие от аккумуляторов, батарея сделана таким образом, что её невозможно перезарядить. Тем не менее, этот источник тока имеет на контактах необходимый ток для питания различных устройств. Физика такого явления очень проста:
При подключении потребителя механизм этот будет поддерживаться до тех пор, пока металл практически полностью не расходуется.
Принцип работы батарейки
Принцип работы батареи довольно прост для понимания. Схема образования электричества выглядит следующим образом:
Отрицательные ионы, которые поступают на соответствующий вывод, потекут к положительному полюсу при подключении какой-либо нагрузки, например, лампочки или моторчика.
В общем, устройство батарейки представляет собой очень простую схему, которую, при желании, можно повторить самостоятельно в домашних условиях, используя при этом вполне доступные химикаты и металлические изделия.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полезным, полным и точным.
Как работает батарейка: строение и состав

Что такое батарейка
Обыкновенная батарейка представляет собой некий источник электрического тока в котором несколько электрохимических элементов объединены между собой в пакет. Стоит обратить внимание, что батарея — это именно несколько объединенных между собой гальванических элементов. Электричество в батарейке вырабатывается вследствие протекающей химической реакции. Изобретателем батареек принято считать ученого Алессандро Вольта, который создал в 1800 г. «Вольтов столб» — первый в мире электрохимический источник тока, ставший прародителем современных батарей.
Устройство батарейки
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Принцип работы батарейки
На аноде проходит реакция окисления цинка. Вначале образуется гидроксид цинка
Zn + 2OH − → Zn(OH)2 + 2e −
На катоде проходит реакция восстановления оксида марганца IV в оксид марганца III
Общая картина следующая
Zn + 2KOH + 2MnO2 + 2e − → 2e − + ZnO + 2KOH + Mn2O3
Из первой формулы видно, что на аноде имеется избыток электронов. Но ведь анод это «+»? Дело в том, что в физике принято считать за направление тока движение положительных зарядов, т.е. от плюса (анода) к минусу (катоду). Но электрический ток это упорядоченное движение электронов, которые имеют отрицательный заряд. Поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления, катодом же считается электрод, где происходит реакция восстановления.
Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Важно! Поскольку химические изменения в процессе разряда батарейки необратимы — они не подлежат восстановлению заряда.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются потенциально опасными для здоровья человека и окружающей среды.
Литиевые
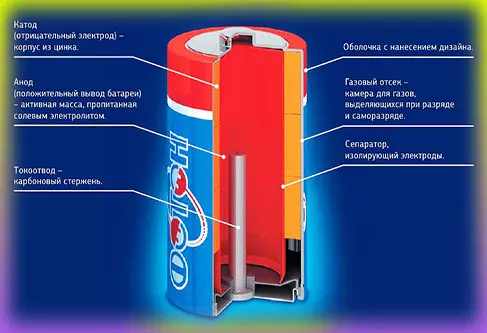
Данные элементы питания постепенно вытесняют все аналоги в своей области применения. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.
Из чего состоит батарейка, как она устроена
Батарейки широко используются в повседневной жизни. Они позволяют сделать её немножечко проще. Например, не нужно тратить много усилий, чтобы включить телевизор при помощи пульта, воспользоваться калькулятором. Благодаря им вы всегда знаете время или можете воспользоваться беспроводной компьютерной мышкой. Однако не каждый знает, какие бывают виды батареек, а главное – что у них внутри.
Как устроены разные типы батареек, что у них внутри
Самые первые прототипы батарейки появились более 2 тыс. лет назад в Месопотамии. Да, это не шутка. Состоял такой элемент питания из глиняной вазы и медного стержня, который заливали специальным составом, напоминающим битум. Также этот состав можно было заменить винным уксусом. В итоге можно было получить напряжение около 0,5-1 В. Назвали такое приспособление «Багдадской батарейкой» (из-за места, где её нашли). Сегодня этот артефакт хранится в Национальном музее Ирака.
Однако это были самые первые элементы питания, устройство которых можно назвать примитивным. Сегодня же их производство и состав кардинально изменились, если сравнивать с «предками».
Устройство современных накопительных элементов отличается простотой. Различия между каждым типом минимальны. В основе любой конструкции есть положительный полюс (анод) и отрицательный (катод). Также в состав входит электролит. Именно от него зависят основные характеристики и параметры элемента питания:
Кроме основных элементов в любой батарейке есть вкладыш, который выступает в роли прокладки, диафрагма, футляр и стержень из угля.
В целом, сама «начинка» может быть литиевая, щелочная и солевая. Последний вариант, можно сказать, давно себя изжил. Дело в том, что солевые батарейки имеют больше минусов, чем плюсов (если сравнивать с другими элементами питания). Но как выглядит электролит?
Внутри корпуса находятся несколько химических веществ. В солевых батарейках это цинк, диоксид магния, гидроксид калия, а также пассивный уголь.
Справка. Когда батарейки не используются, они могут восстанавливать заряд или, другими словами, выравнивать локальные неоднородности, которые вызываются разрядом элемента. Данный процесс позволяет незначительно продлить срок службы изделия.
Кроме вышеперечисленных элементов в состав батарейки могут входить и другие:
В алкалиновых батарейках в роли электролита выступает щёлочь. Благодаря её свойствам данное изделие работает стабильно на протяжении всего срока эксплуатации, медленнее разряжается, работает даже при минусовой температуре и отличается более длительным сроком службы.
Неопытные пользователи могут подумать, что проходимые химические реакции отличаются своей сложностью. На самом деле, это не так — здесь всё довольно просто. Химическая реакция перемещает отрицательно заряженные частицы (электроны), что в итоге и создаёт электрический ток.
В состав литиевых элементов питания входит (как уже можно понять из названия) литий. Он выступает в роли катода и имеет наивысший отрицательный потенциал. Стоит отметить, что данный химический элемент — органический, благодаря чему батарейка получила улучшенные характеристики.
Если рассматривать по типам, то у каждой батарейки могут быть свои элементы. Например, у «таблетки» в составе имеется оксид ртути и порошок цинка. Крона отличается более сложным составом:
Также в состав такого изделия входит корпус, но о нём расскажем отдельно.
Из чего сделан корпус батареек
Любая батарейка обладает прочным корпусом, который защищает элемент и выполняет ряд важных функций. В него помещают различные составляющие будущей батарейки: диоксид марганца, загустители, сульфат бария, катализатор, цинк и т. д.
Однако не все знают, что его изготавливают из различных металлов. Для многих он просто металлический. На самом деле, нет — всё намного сложнее.
Прежде всего, его могут изготавливать из цинка. Чаще им оснащают солевые элементы питания. В последнее время встречается корпус, изготовленный из железа или особой нержавеющей стали. Такой корпус отличается повышенной прочностью и уровнем защиты.
Состоит он из верхней и нижней пластины, на которых помечено, где «минус», а где «плюс». Также в состав корпуса входит боковая пластина. Она и является основной его частью. По сути, само производство начинается с того, что на станке нарезаются такие пластины. После чего они скручиваются в трубочку, которая и именуется корпусом.
Справка. Корпус может быть изготовлен не в виде трубочки, а в форме квадрата. Элементы питания такого строения обладают самым большим напряжением – до 9 Вольт.
Несмотря на высокое напряжение, данный тип батареек не пользуется популярностью и не особо востребован среди отечественных потребителей. Причины кроются на поверхности, причём в прямом смысле этого слова. Во-первых, такое изделие отличается толстой оболочкой, которая защищает химические элементы от внешних неблагоприятных воздействий и падений. Во-вторых, лишь малая часть приборов заточены под такую форму батарейки, т. е. попросту элементы питания в них не поместятся и не подойдут в разъём.