Что находится в субарахноидальном пространстве спинного мозга
Субарахноидальное пространство
Субарахноидальное (подпаутинное) пространство (лат. cavum subarachnoidale ) — полость между мягкой и паутинной мозговыми оболочками головного и спинного мозга, заполненная спинномозговой жидкостью (ликвором).
В субарахноидальном пространстве находится 120—140 мл ликвора, оттекающего из желудочковой системы головного мозга через отверстия Мажанди и Лушка в четвёртом желудочке. Наибольшее его количество содержится в цистернах субарахноидального пространства, располагающихся над крупными щелями и бороздами головного мозга. Реабсорбция ликвора из субарахноидального пространства происходит с помощью выростов паутинной оболочки — пахионовых грануляций, проникающих в просвет синусов твёрдой мозговой оболочки, а также в кровеносные и лимфатические капилляры в области выхода корешков черепных и спинномозговых нервов из полости черепа и позвоночного канала.
В субарахноидальном пространстве проходят кровеносные сосуды; в нижней части позвоночного канала субарахноидальное пространство содержит свободно плавающие корешки спинномозговых нервов («конский хвост»).
Подпаутинные цистерны
Подпаутинные цистерны — участки расширения субарахноидального пространства в области расхождения паутинной и мягкой мозговых оболочек, располагающиеся преимущественно на основании головного мозга. В числе наиболее крупных подпаутинных цистерн — мозжечково-мозговая цистерна, цистерна латеральной борозды, базальная цистерна.
Источники
Полезное
Смотреть что такое «Субарахноидальное пространство» в других словарях:
субарахноидальное пространство — (cavum subarachnoidale) см. Подпаутинное пространство … Большой медицинский словарь
СУБАРАХНОИДАЛЬНОЕ ПРОСТРАНСТВО — (от лат. sub под и греч. aráchnē паук, паутина, éidos вид), полость между паутинной и мягкой оболочками головного и спинного мозга, заполненная спинномозговой жидкостью. См. также Головной мозг, Спинной мозг … Ветеринарный энциклопедический словарь
Пространство Субарахноидальное, Пространство Подпаутинное (Subarachnoid Space) — пространство между паутинной и мягкой моз говыми оболочками головного и спинного мозга, в котором находится спинномозговая жидкость и проходят крупные кровеносные сосуды. Над крупными щелями и бороздами подпаутинное пространство широкое, образует … Медицинские термины
ПРОСТРАНСТВО СУБАРАХНОИДАЛЬНОЕ, ПРОСТРАНСТВО ПОДПАУТИННОЕ — (subarachnoid space) пространство между паутинной и мягкой моз говыми оболочками головного и спинного мозга, в котором находится спинномозговая жидкость и проходят крупные кровеносные сосуды. Над крупными щелями и бороздами подпаутинное… … Толковый словарь по медицине
Субарахноидальное кровоизлияние — Субарахноидальное кровоизлияние … Википедия
Кровоизлияние субарахноидальное — Кровоизлияние в субарахноидальное пространство чаще возникает при разрыве аневризмы артерий основания мозга. Проявляется резкой головной болью, распространяющейся на шею, иногда в межлопаточную область. Общемозговые и менингиальные симптомы. По… … Энциклопедический словарь по психологии и педагогике
подпаутинное пространство — (cavum subarachnoidale, PNA, BNA; cavum leptomeningicum, JNA; син. субарахноидальное пространство) пространство между паутинной и мягкой оболочками головного и спинного мозга, заполненное цереброспинальной жидкостью … Большой медицинский словарь
Мозговы́е оболо́чки — (meninges) соединительнотканные структуры, покрывающие головной и спинной мозг. Различают твердую оболочку (dura mater, pachymeninx), паутинную (arachnoidea) и сосудистую, или мягкую (vasculosa, pia mater). Паутинную и мягкую оболочки объединяют… … Медицинская энциклопедия
Эпидуральная анестезия — Эпидуральный катетер в месте введения. Операционное поле обработано йодом. Видны метки глубины на катетере Эпидуральная анестезия, она же «перидуральная» один из методов регионарной анестезии, при котором лекарственные препараты вводятся в… … Википедия
ЦЕРЕБРО-СПИНАЛЬНАЯ ЖИДКОСТЬ — (liquor eerebro spinalis) находится в субарахнои дальном пространстве головного и спинного мозга и заполняет собой центральный канал, желудочки головного мозга и их соединения (рис. 1). Впервые спинномозговая жидкость открыта Котуньо (Cotugno,… … Большая медицинская энциклопедия
Клиническая анатомия позвоночника и спинного мозга
Для успешного и безопасного проведения спинальной и эпидуральной анестезии необходимо хорошо ориентироваться в анатомии позвоночника и спинного мозга.
Позвоночный канал проходит от большого затылочного отверстия до крестцовой щели, но при этом субарахноидальное пространство обычно заканчивается на уровне второго крестцового позвонка ( рис.1.1 ).
 |  |
| |||||
| Рис.1.1. | Рис 1.2. |
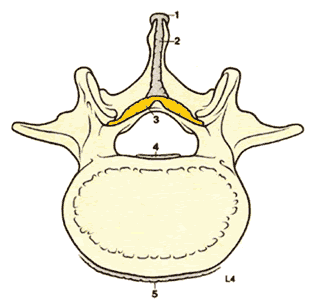
Прилегающие друг к другу тела позвонков разделены межпозвонковыми дисками. Хотя все позвонки имеют общую структуру ( рис 1.3 ), они различаются по форме и размерам в зависимости от их расположения и функции. Шейные позвонки, имеющие наименьшую весовую нагрузку и максимальную подвижность, относительно малы по сравнению с большими массивными позвонками крестцового отдела ( рис 1.4 ).
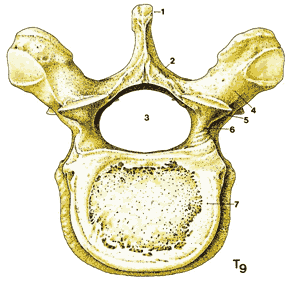 | 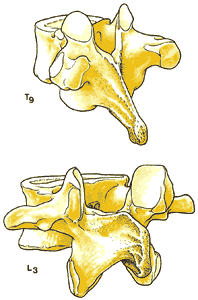 |
| Рис. 1.3. Типичный позвонок грудного отдела 1. Остистый отросток 2. Дужка позвонка 3. Отверстие позвонка (позвоночный канал). 4. Поперечный отросток 5. Верхний суставной отросток 6. Ножка позвонка 7. Тело позвонка | Рис.1.4. Наклонные виды грудного и поясничного позвонков. |
Особенности отдельных позвонков оказывают влияние на технику, в первую очередь, эпидуральной пункции. Остистые отростки отходят под различными углами на разных уровнях позвоночника. В шейном и поясничном отделах они располагаются почти горизонтально по отношению к пластине, что облегчает срединный доступ при перпендикулярном расположении иглы к оси позвоночника. На средне-грудном уровне (Тh5-9 ) остистые отростки отходят под достаточно острыми углами ( рис 1.2 ), что делает предпочтительным парамедиальный доступ. Отростки верхних грудных (Тh1-4 ) и нижних грудных (Тh10-12 ) позвонков ориентированы промежуточно по сравнению с двумя вышеуказанными особенностями. На этих уровнях ни один из доступов не имеет преимуществ перед другим.
Крестец сформирован путем срастания 5 крестцовых позвонков, внутри которых спинальный канал продолжается дальше вниз до конца крестцовой щели ( рис.1.5a и б ). Иногда пластинки у крестцовых позвонков могут отсутствовать на уровне S4 и даже S5, обуславливая формирование ненормально большой крестцовой щели. Ниже крестца находится копчик.
 | 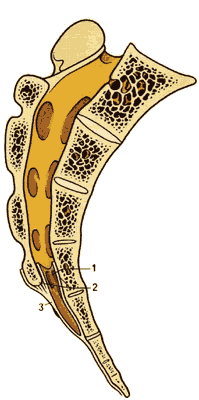 |
| Рис. 5а. Вид сзади. | Рис. 5б. Сагиттальный срез крестца и копчика 1. S4 2.Крестцовая щель 3.Крестцово-копчиковая связка |
 | 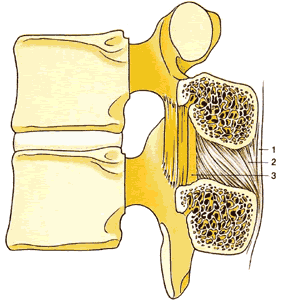 |
| Рис.1.6. Поперечный срез поясничного позвонка, демонстрирующий присоединение спинных связок. 1. Надостистая связка 2. Межостистая связка 3. Желтая связка 4. Задняя продольная связка 5. Передняя продольная связка | Рис.1.7. Сагиттальный срез через второй и третий поясничные позвонки, демонстрирующий связки, присоединенные к смежным дугам и остистым отросткам 1. Надостистая связка 2. Межостистая связка 3. Желтая связка |
Желтая связка состоит из двух листков, сращенных по средней линии под острым углом. В связи с этим она как бы натянута в виде «тента». В шейном и грудном отделах желтая связка может быть не сращена по средней линии, что вызывает проблемы при идентификации эпидурального пространства по тесту потери сопротивления. Желтая связка тоньше по средней линии (2-3 мм) и толще по краям (5-6 мм). В целом, она имеет наибольшую толщину и плотность на поясничном
(5-6 мм) и грудном уровнях (3-6 мм), и наименьшую в шейном отделе (1,5-3 мм). Вместе с дужками позвонков желтая связка формирует заднюю стенку позвоночного канала. ( рис. 1.8 )
При проведении иглы срединным доступом она должна пройти сквозь надостистые и межостистые связки, а затем сквозь желтую связку. При парамедиальном доступе игла минует надостистую и межостистую связки, сразу достигая желтой связки. Желтая связка плотнее других, поэтому возрастание сопротивления при прохождении ее иглой, с последующей его потерей используют для идентификации эпидурального пространства.
Оболочки спинного мозга.
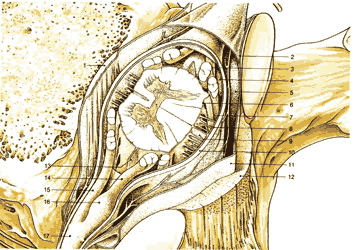 | Рис.1.9. Поперечный срез позвоночного канала в грудном отделе, демонстрирующий спинные связки и содержимое дурального мешка. 1. Задняя продольная связка 2. Надкостница 3. Нервный корешок 4. Cубарахноидальное пространство 5. Эпидуральное пространство 6. Мягкая мозговая оболочка 7. Паутинная оболочка 8. Субдуральное пространство 9. Субдуральная перегородка 10. Твердая мозговая оболочка (внутренний слой) 11. Твердая мозговая оболочка (внешний слой) 12. Желтая связка 13. Зубчатая связка 14. Дорсальный корешок нерва 15. Вентральный корешок нерва 16. Ганглии дорсального корешка 17. Спинномозговой нерв |
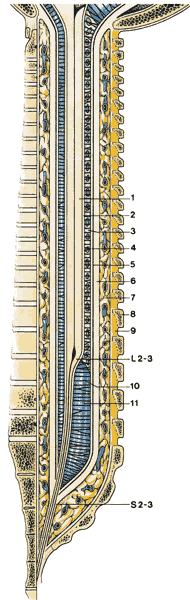 | Рис.1.10. Схематичная диаграмма, показывающая уровни, на которых заканчивается эпидуральное пространство, субарахноидальное пространство и спинной мозг. 1.Спинной мозг 2.Мягкая мозговая оболочка 3.Субарахноидальная перегородка 4.Паутинная оболочка 5.Субдуральное пространство 6.Твердая мозговая оболочка 7.Эпидуральное пространство 8.Позвонок 9.Желтая связка 10.Трабекула 11.Субарахноидальное пространство |
Между мягкой мозговой и паутинной оболочками проходят многочисленные тонкие трабекулы. Кроме того, там находятся два волокнистых тяжа, которые поддерживают спинной мозг в центральном положении внутри позвоночного канала, а также зубчатая связка и субарахноидальная перегородка. ( рис.1.11 ).
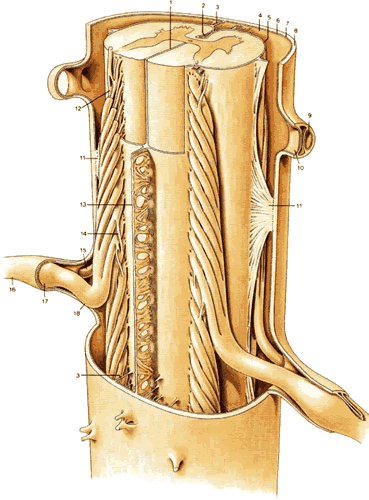 | Рис.1.11 1.Задняя медиальная перегородка 2.Передняя медиальная щель 3.Трабекула 4.Субарахноидальное пространство 5.Мягкая мозговая оболочка 6.Паутинная оболочка 7.Субдуральное пространство 8.Твердая мозговая оболочка 9.Пространство для вентрального корешка нерва 10.Пространство для дорсального корешка нерва 11.Зубчатая связка 12.Корешки 13.Субарахноидальная перегородка 14.Нервные волокна, взаимосвязывающие нервные корешки смежных сегментов 15.Вентральный корешок нерва 16.Спинномозговой нерв Т10 17.Ганглии дорсального корешка 18.Дорсальный корешок нерва |
Зубчатая связка, которая обнаружена на обеих (передней и задней) сторонах спинного мозга, является продолжением мягкой мозговой оболочкой на передние и задние нервные корешки. Достигая паутинной оболочки, она имеет треугольную проекцию ( рис.1.11 ). Субарахноидальная перегородка соединяется с мягкой мозговой и паутинной оболочками в медиальной плоскости сзади ( рис.1.11 ). Имея ячеистую структуру, она не является окончательно сформированной перегородкой, но может стать частичным барьером для свободного распространения введенных жидкостей, в особенности в грудном отделе.
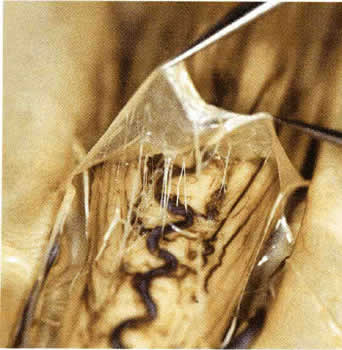
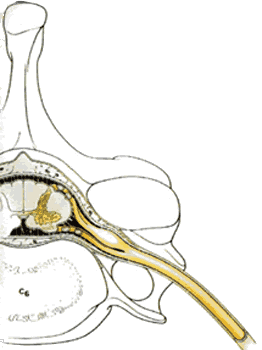
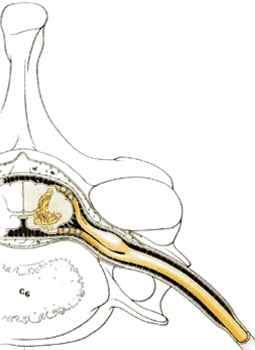
Все три оболочки спинного мозга также распространяются в стороны, окружая сначала нервные корешки, а затем и смешанные спинномозговые нервы. Таким образом, мягкая мозговая, паутинная и твердая мозговая оболочки формируют эндонервий, перинервий и эпинервий. Субарахноидальное пространство также распространяется в стороны вдоль нервных корешков смешанных нервов на небольшое расстояние ( рис.1.14 ). Эти дуральные манжеты обычно заканчиваются в межпозвонковых отверстиях, но иногда они распространяются на сантиметр или более, вдоль спинномозговых нервов ( рис.1.16 ).
 |  |
| Рис. 1.14. | Рис. 1.16. |
Твердая мозговая оболочка (ТМО) представляет собой листок соединительной ткани, состоящей из коллагеновых волокон, ориентированных как поперечно, так и продольно, а также некоторого количества эластических волокон, ориентированных в продольном направлении. ( рис. 1.12 ) На протяжении длительного времени считали, что волокна ТМО имеют преимущественно продольную ориентацию. В связи с этим рекомендовали при пункции субарахноидального пространства ориентировать срез спинальной иглы с режущим кончиком вертикально, чтобы он не пересекал волокна, а как бы их раздвигал. Позднее при помощи электронной микроскопии выявили достаточно беспорядочное расположение волокон ТМО – продольное, поперечное и частично циркулярное. Толщина ТМО вариабельна (от 0,5 до 2 мм) и может отличаться на разных уровнях у одного и того же пациента. Чем толще ТМО, тем выше ее способность к ретракции (стягиванию) дефекта.
Мягкая мозговая оболочка. Мягкая мозговая оболочка вплотную окутывает спинной мозг и его кровеносные сосуды и является продолжением церебральной мягкой мозговой оболочки ( рис.1.15 ). Она состоит из двух слоев. Внутренний слой находится в непосредственном контакте с глиальными клетками и не может быть снят со спинного мозга. Кровеносные сосуды, которые проходят вдоль корешков спинных нервов и спинного мозга находятся четко снаружи и покрыты мягкой мозговой оболочкой. Микроскопически это покрытие распространяется до начала капилляров.
| |
| Рис. 1.15. Фотография спинного мозга, покрытого мягкой мозговой оболочкой. |
Все три оболочки спинного мозга также распространяются и латерально, чтобы окутать сначала нервные корешки, а затем и смешанные спинномозговые нервы. Таким образом, мягкая мозговая, паутинная и твердая мозговая оболочки формируют эндонервий, перинервий и эпинервий. Субарахноидальное пространство также распространяется латерально вдоль нервных корешков смешанных нервов на короткое расстояние ( рис.1.14 ). Эти дуральные манжеты обычно заканчиваются в межпозвонковых отверстиях, но иногда они распространяются на сантиметр, или более, вдоль спинномозговых нервов ( рис.1.16 ).
Наилучшей проницаемостью характеризуются препараты с промежуточной способностью растворяться в жирах – лидокаин, бупивакаин.
Объяснением этому является тот факт, что диффузия из эпидурального в субарахноидальное пространство осуществляется непосредственно сквозь клетки паутинной оболочки, поскольку межклеточные связи настолько плотны, что исключают возможность проникновения молекул между клетками. В процессе диффузии препарат должен проникнуть в клетку через двойную липидную мембрану, а затем, еще раз преодолев мембрану, попасть в субарахноидальное пространство. Паутинная оболочка состоит из 6-8 слоев клеток. Таким образом, в процессе диффузии вышеуказанный процесс повторяется 12-16 раз. Препараты с высокой жирорастворимостью термодинамически более стабильны в двойном липидном слое, чем в водном внутри- или внеклеточном пространстве, в связи с этим, им «труднее» покинуть мембрану клетки и переместиться во внеклеточное пространство. Таким образом, замедляется их диффузия сквозь паутинную оболочку. Препараты с плохой растворимостью в жирах имеют противоположную проблему – они стабильны в водной среде, но с трудом проникают в липидную мембрану, что тоже замедляет их диффузию.
Препараты, с промежуточной способностью растворяться в жирах, в наименьшей степени подвержены вышеуказанным водно-липидным взаимодействиям.
Эпидуральное пространство (ЭП)
ЭП является частью спинномозгового канала между его наружной стенкой и твердой мозговой оболочкой, простирается от большого затылочного отверстия до крестцово-копчиковой связки. Твердая оболочка прикрепляется к большому затылочному отверстию, а также к первому и второму шейным позвонкам, в связи с этим растворы, введенные в ЭП, не могут подняться выше этого уровня. ЭП расположено кпереди от пластины, с боков ограничено ножками, а спереди телом позвонка.
ЭП содержит: а) жировую клетчатку, б) спинно-мозговые нервы, выходящие из спинно-мозгового канала через межпозвонковые отверстия, в) кровеносные сосуды, питающие позвонки и спинной мозг. Сосуды ЭП в основном представлены эпидуральными венами, формирующими мощные венозные сплетения с преимущественно продольным расположением сосудов в боковых частях ЭП и множеством анастомотических веточек. ЭП имеет минимальное наполнение в шейном и грудном отделах позвоночника, максимальное – в поясничном отделе, где эпидуральные вены имеют максимальный диаметр.
В обычных условиях давление в ЭП имеет отрицательное значение. Наиболее низким оно является в шейном и грудном отделе. Увеличение давления в грудной клетке при кашле, пробе Вальсальвы приводит к повышению давления в ЭП. Введение жидкости в ЭП повышает давление в нем, величина этого повышения зависит от скорости и объема введенного раствора. Параллельно увеличивается давление и в субарахноидальном пространстве.
Давление в ЭП становится положительным в поздних сроках беременности за счет повышения внутрибрюшного давления и расширения эпидуральных вен. Уменьшение объема ЭП способствует более широкому распространению местного анестетика.
Непреложным является факт, что препарат, введенный в ЭП, попадает в СМЖ и спинной мозг.
В настоящее время экспериментально подтвержден лишь один механизм проникновения лекарственных препаратов из ЭП в СМЖ / СМ – диффузия через оболочки спинного мозга (см. выше).
Новые данные по анатомии эпидурального пространства.
При отсутствии дегенеративных заболеваний позвоночника, межпозвонковые отверстия обычно открыты, независимо от возраста, что позволяет введенным растворам свободно покидать ЭП.
Воспалительные заболевания и ранее перенесенные операции искажают нормальную анатомию эпидурального пространства.
С внутренней стороны к твердой мозговой оболочке очень близко прилежит паутинная оболочка, которая, тем не менее, с ней не соединяется. Пространство, образуемое этими оболочками, называют субдуральным. Термин «субдуральная анестезия» является некорректным и не идентичным термину «субарахноидальная анестезия». Случайное введение анестетика между паутинной и твердой мозговой оболочкой может явиться причиной неадекватной спинальной анестезии.
Начинается от большого затылочного отверстия (где переходит в интракраниальное субарахноидальное пространство) и продолжается приблизительно до уровня второго крестцового сегмента, ограничивается паутинной и мягкой мозговой оболочками. Оно включает в себя спинной мозг, спинно-мозговые корешки и спинно-мозговую жидкость.
Сирингомиелия (клиника, диагностика, тактика лечения).
Сирингомиелия (клиника, диагностика, тактика лечения).
Сирингомиелия – патологическое состояние, которое характеризуется образованием ликворных полостей в спинном мозге в результате расширения центрального канала. Термин «сирингомиелия» (греческ. Syrinx – трубка ) предложил Ollivier в 1824г. Распространенность сирингомиелии в среднем составляет 7-9 на 100 000 населения. Заболевание чаще встречается у мужчин (соотношение мужчины/женщины составляет 2:1). Дебют клинических проявлений сирингомиелии чаще отмечается в молодом возрасте. Средний возраст начала болезни составляет 30 лет. При этом развитие полостей в спинном мозге обычно опережает клинические проявления.
Сирингомиелия — синдром, характерный для различных патологических состояний, приводящих к сдавлению субарахноидального пространства на уровне кранио-вертебрального перехода и спинного мозга. Классификация сирингомиелии, построенная по этиологическому принципу, включает в себя:
— сирингомиелию вследствие аномалий развития задней черепной ямки (аномалия Киари, базиллярная импрессия, арахноидальные кисты в области большой затылочной цистерны) (рис1.);
— посттравматическую сирингомиелию (рис.2);
— сирингомиелию, сопутствующую опухолям спинного мозга (обычно отмечается при интрамедуллярных опухолях, при экстрамедуллярных имеются только единичные описания) (рис.3);
— сирингомиелию вследствие перенесенного спинального менингита и арахноидита;
-идиопатическую сирингомиелию, не связанную с выше перечисленной патологией.
В последние годы в эту классификацию включены стеноз позвоночного канала дискогенной природы на шейном уровне и крупные очаги демиелинизации в спинном мозге при рассеянном склерозе. Наиболее частыми причинами сирингомиелии являются аномалии Киари первого и второго типа. По обобщенным данным 84% всех случаев сирингомиелии связаны с данной патологией. При этом абсолютное большинство среди взрослых составляют пациенты с сирингомиелией на фоне аномалии Киари первого типа, второй тип встречается почти исключительно в детском возрасте.
Патогенез.
Патогенез сирингомиелии до настоящего времени остается предметом дискуссии. Ведущей патогенетической концепцией, начиная с середины прошлого века, стала теория W.J.Gardner 1950г.. Основой данной теории является предположение о том, что затруднение оттока ликвора из большой затылочной цистерны в спинальное субарахноидальное пространство приводит к гидродинамическим ударам систолической ликворной волны из 4 желудочка в стенки центрального канала спинного мозга. Ликворная волна, направленная в каудальном направлении, приводит к постепенному
расширению центрального канала и образованию сирингомиелической полости. Теория W.J.Gardner впервые продемонстрировала патогенетическую связь между аномалией Киари, как причиной затруднения оттока ликвора из 4-го желудочка и сирингомиелией. Позднее эта теория нашла подтверждение в экспериментальной работе В.Williams 1969г., который путем мониторирования давления в желудочках мозга и подоболочечном пространстве спинного мозга показал, что существует диссоциация ликворного давления в черепе и позвоночном канале при блоке
субарахноидального пространства на уровне большой затылочной цистерны. Это приводит к засасыванию ликвора в центральный канал спинного мозга через его устье в области 4-го желудочка. Концепция В.Williams позволяла объяснить факт редкого сочетания сирингомиелии при аномалии Киари 1- го типа с окклюзионной гидроцефалией на уровне 4 – го желудочка. Эти состояния редко связаны между собой вследствие того, что основной причиной сирингомиелии согласно В.Williams является не высокое внутрижелудочковое давление ликвора в области устья центрального канала, способное вызвать дилатацию желудочков, а разница между внутрижелудочковым давлением и давлением в спинальном субарахноидальном пространстве. При этом пассаж ликвора через отверстие Мажанди у больных с аномалией Киари 1-го типа грубо не нарушен, а расстройство ликвороциркуляции ограничено, главным образом, нарушением сообщения большой затылочной цистерны со спинальным субарахноидальным пространством. Возникновение сирингомиелии после травм позвоночника и спинного мозга, при стенозировании шейного отдела позвоночника и интрамедуллярных опухолях показывает, что причиной сирингомиелии может являться не только нарушение проходимости субарахноидального пространства на уровне краниовертебрального перехода, но также и на уровне шейного отдела позвоночника, и в более редких случаях на грудном уровне. Предложенная теория позволила сформулировать концепцию «сообщающейся сирингомиелии», что подчеркивало связь сирингомиелической полости с полостью 4-го желудочка.
Необходимо отметить, что в течение последних десятилетий концепция «сообщающейся сирингомиелии» подверглась серьезной критике. Это связано с широким внедрением в клиническую практику МРТ – исследований позвоночника, спинного мозга и краниовертебрального перехода. В ходе этих исследований у пациентов с сирингомиелией во многих случаях не обнаруживается связи между полостью 4-го желудочка и
сирингомиелической кистой. В ряде случаев отсутствие сообщения подтверждено также морфологически. Эти находки позволили сформулировать концепцию «несообщающейся сирингомиелии». Однако, общепринятой и согласованной патофизиологической модели «несообщающейся сирингомиелии» до настоящего момента не предложено.
Современные МРТ – исследования ликвороциркуляции в области краниовертебрального перехода – фазоконтрастная миелография с использованием высокопольных магнитов у больных с аномалией Киари и сирингомиелией подтверждают значимость нарушения ликвороциркуляции на уровне вклинения миндаликов мозжечка даже у пациентов, не имеющих МР–признаков сообщения между полостью 4 –го желудочка и сирингомиелической кистой.
Т.Мilhorat 2000г. предложил классификацию сирингомиелии, основанную на данных МРТ и морфологических исследований. Он выделил 3 типа поражения: сообщающаяся центральноканальная сирингомиелия, несообщающаяся центральноканальная сирингомиелия, несообщающаяся экстраканальная сирингомиелия. Согласно данной классификации сообщающаяся сирингомиелия составляет 10 – 15% всех наблюдений. Она как правило сочетается с аномалией Киари 2-го типа, гидроцефалией, аномалией Денди – Уокера. Несообщающаяся сирингомиелия составляет 75% всех наблюдений и сочетается с аномалией Киари 1-го типа и базиллярной импрессией, а также различными причинами нарушения проходимости субарахноидальных пространств на уровне позвоночного канала (травмы и дегенеративные стенозы шейного отдела позвоночника, опухоли и т.д.). Несообщающаяся экстраканальная сирингомиелия (около 10% наблюдений) является последствием травм и нарушений кровообращения в спинном мозге с первичным формированием кисты в зоне повреждения мозгового вещества и постепенным ее распространением по длиннику спинного мозга.
Классификация Т.Мilhorat удобна тем, что объединяет все виды кистозной трансформации спинного мозга, включая так называемую гидромиелию (несообщающаяся экстраканальная форма), однако, патогенез и морфология кист, включенных в эту классификацию различны.
В опытах на животных доказано, что в центральном канале существует восходящий ток ликвора. Его нарушение может привести к расширению центрального канала спинного мозга не только выше, но и ниже места препятствия, что хорошо объясняет наличие сирингомиелических полостей ниже уровня патологических процессов, обтурирующих его. Современные МР – исследования также демонстрируют колебательное движение ликвора в полости центрального канала. В систолу ликвороток в нем направлен каудально, а в диастолу – краниально. Однако, причины попадания жидкости в просвет центрального канала ниже его устья в полости 4 желудочка при отсутствии сообщения между сирингомиелической кистой и желудочком до конца не ясны. Существует концепция, предполагающая возможность обмена жидкостью между полостью центрального канала и субарахноидальным пространством спинного мозга через вещество спинного мозга, в частности через зону входа задних корешков, но экспериментального подтверждения она пока не имеет.
До настоящего времени не решен вопрос о возможности спонтанного вскрытия и дренирования сирингомиелических кист в субарахноидальное пространство спинного мозга. В литературе имеются отдельные клинические описания, основанные на данных МР – исследований кист в динамике, демонстрирующие спонтанное уменьшение диаметра кист. Эти описания носят единичный характер и морфологических подтверждений длительно функционирующих спонтанных шунтов не приводится.
Ни одна из современных теорий в отдельности не может полностью объяснить все клинические и патофизиологические аспекты сирингомиелии, поэтому патогенетические аспекты формирования кист требуют дальнейшего изучения.
Патоморфология.
В норме полость центрального канала у детей в течение первой декады жизни сохранена. Начиная со второй декады, она начинает постепенно облитерироваться. Окклюзия центрального канала начинается с нижних отделов спинного мозга и постепенно распространяется краниально.
Имеется оригинальное предположение о том, что процесс облитерации центрального канала характерен только для человека и связан с прямохождением. В процессе жизни центральный канал может облитерироваться полностью или сохраниться в виде небольшой полости. Сохранившаяся полость располагается преимущественно в верхне-грудном и шейном отделах спинного мозга. Таким образом можно объяснить тот факт, что сирингомиелическая полость, представляющая собой расширение необлитерированной части центрального канала, располагается в большинстве случаев в шейном или шейно-грудном отделах спинного мозга. Сирингомиелическая полость может также распространяться на продолговатый мозг (сирингобульбия). В просвете сирингомиелической полости могут обнаруживаться поперечные пергородки, которые придают ей фенестрированный характер. Перегородки, как правило, представлены тонкими мембранами и делят кисту на отдельные камеры с ровными стенками и приблизительно одинаковым поперечным размером. Эндоскопические исследования показывают, что перегородки имеют дефекты, через которые жидкость в кисте свободно перемещается между камерами. Полость с неравномерным просветом и утолщенными перегородками может иметь вид «бус». В стенках полости часто отмечается разрастание глиальной ткани. По современным представлениям, глиоз, выявляемый при морфологическом исследовании стенок сирингомиелической полости, является следствием повышенного давления жидкости в кисте. Разрастание глиальной ткани рассматривается не как фактор, предрасполагающий к развитию полости, а только как ее последствие.
В последнее время в рамках сирингомиелии рассматриваются также кисты в спинном мозге, возникающие как последствие травмы, ишемии или гематомиелии (экстраканальная форма по Т.Мilhorat). Эти кисты, как правило, имеют эксцентричное расположение. До настоящего момента не решен вопрос о том, следует ли включать в их число все участки кистозной трансформации мозга на месте очага некроза или только те кисты, которые имеют тенденцию к постепенному росту с вовлечением участков ранее неповрежденной мозговой ткани.
Клиника.
В большинстве случаев клинические проявления сирингомиелии носят медленно прогрессирующий характер. У 2/3 неоперированных больных естественное течение заболевания постепенно приводит к развитию грубой инвалидизации. Скорость прогрессирования симптомов различна. От момента первых клинических проявлений до развития грубой инвалидизации может пройти от нескольких лет до 3-х десятилетий.
При идиопатической сирингомиелии у 60% больных наблюдается хроническое, медленно прогрессирующее течение, у 25% пациентов эпизоды прогрессирования сменяются периодами стационарного состояния, а у 15% болезнь может стабилизироваться и не прогрессировать в течение длительного времени, при этом больные, как правило, длительно сохраняют трудоспособность.
Неврологическая симптоматика складывается из чувствительных, двигательных, вегетативно-трофических расстройств и болевого синдрома. На начальной стадии заболевания болевой синдром может являться ведущим в клинической картине. В дебюте отмечаются боли тянущего и ноющего характера в шейно-плечевой области и верхних конечностях, реже в спине и в ногах. Возникновение боли обусловлено поражением задних рогов спинного мозга. Достаточно часто боли носят преимущественно односторонний характер, что говорит об ассиметричном расположении кисты и различном влиянии на задние рога правой и левой половины
спинного мозга. В более поздних стадиях заболевания болевой синдром может быть связан со вторичными дегенеративными изменениями суставов позвоночника и конечностей.
Нарушения чувствительности представлены чаще в виде «воротника», «куртки», «полукуртки». Они носят сегментарный — диссоциированный характер — доминируют расстройства болевой и температурной при относительной сохранности глубокой чувствительности. Характерны безболевые ожоги и другие повреждения мягких тканей, которые наблюдаются у 15% больных и отмечаются преимущественно на руках. Расстройства болевой и температурной чувствительности, как правило, возникают в местах, где ранее отмечались боли. Это связано с постепенным разрушением серого вещества задних рогов, примыкающего к области центрального канала. Повреждение спинального ядра тройничного нерва может приводить к выпадению болевой и температурной чувствительности в наружных сегментах лица. Нарушения глубокой чувствительности возникают в поздней стадии заболевания при больших поперечных размерах сирингомиелической кисты. Они относятся к проводниковым нарушениям и связаны с растяжением и компрессией задних столбов. Высокая толерантность задних столбов спинного мозга к компрессии со стороны сирингомиелических кист связана с высокой степенью миелинизации проводников глубокой чувствительности.
Двигательные расстройства имеют место у 60-85% больных. К ранним двигательным нарушениям относятся атрофии мышц вследствие повреждения передних рогов. Поскольку образование полостей начинается в шейно-грудном отделе спинного мозга, первые амиотрофии обнаруживаются в мелких мышцах кисти. Процесс может быть двусторонним с самого начала или развивается последовательно в каждой руке. В дальнейшем отмечается похудание мышц предплечья, плеча, плечевого пояса, верхних межреберных промежутков.
Распространение полостей в продолговатый мозг может приводить к повреждению n. ambiguus с развитием пареза мягкого неба, глотки, голосовых связок. Значительно реже наблюдаются двигательные нарушения со стороны других черепных нервов. Описаны параличи мимических и жевательных мышц, наружной прямой мышцы глаза. Типична асимметричная атрофия языка. Часто наблюдается нистагм, как горизонтальный, так и вертикальный. Разрушение симпатических центров в спинном мозге сопровождается появлением синдрома Горнера с одной или с обеих сторон. В случае проводникового сдавления пирамидных путей в боковых столбах возникает нижний спастический парапарез. Функции тазовых органов нарушаются редко.
Очень характерны трофические нарушения. Гипертрофия тканей может наблюдаться на половине тела, одной конечности или даже в языке. В 20% случаев отмечаются нейроостеоартропатии (суставы Шарко). Наиболее часто поражаются плечевой и локтевой суставы, реже – суставы кисти, височно
нижнечелюстной, грудино-ключичный и ключично-акромиальный. Типично отсутствие боли при грубейших костно-суставных изменениях. Пораженный сустав часто увеличен в размерах, движения в нем сопровождается громкой крепитацией.
Трофические изменения кожи включают цианоз, гиперкератоз, гипергидроз, утолщение подкожного жирового слоя, особенно на руках; распухшие пальцы принимают вид «банановой грозди».
Как упоминалось, утрата болевой чувствительности обусловливает исключительную подверженность повторным травмам; заживление при этом происходит медленно. Может наблюдаться гнойное воспаление мягких тканей дистальных фаланг, некрозы костей.
Наиболее отчетливый симптомокомплекс наблюдается при сирингомиелии на фоне краниовертебральных аномалий и в идиопатических случаях. При развитии кист на фоне стеноза шейного отдела позвоночного канала или интрамедуллярных опухолей клинические проявления сирингомиелии
Отдельно необходимо остановиться на экстраканальной сирингомиелии, возникающей вследствие гематомиелии, ишемии или посттравматического некроза мозговой ткани. При этом ядро клинической картины формируется в момент первичного поражения спинного мозга – травмы или инсульта.
Говорить о клинической значимости сирингомиелии можно только в тех случаях, когда клинические проявления поражения спинного мозга начинают прогрессировать через несколько месяцев или лет после первичного поражения, а при нейровизуализации выявляется интрамедуллярная киста, распространяющаяся за пределы первичного очага поражения. Учитывая эксцентричное расположение подобных кист типичные клинические проявления сирингомиелии (сегментарно-диссоциированные расстройства чувствительности) при этом практически не встречаются.
Нейровизуализация.
Основным методом инструментальной диагностики сирингомиелии является МРТ, при которой доступны оценке размеры, локализация, протяженность и внутренняя структура полости в спинном мозге, состояние субарахноидальных пространств спинного мозга, а также возможные патоморфологические изменения, послужившие причиной развития
сирингомиелии (мозжечковая эктопия, базиллярная импрессия, опухоль спинного мозга и т.д.). МРТ – исследование должно включать в себя сканирование в режимах Т1 и Т2 с обязательным изучением сагиттальных и коронарных срезов спинного мозга. МР – сигнал от содержимого сирингомиелических кист изоинтенсивен по отношению к ликвору.
Исследование должно начинаться с уровня максимально выраженных клинических проявлений. При обнаружении сирингомиелической кисты, верхний или нижний полюс которой не определяются, исследование необходимо расширить с захватом других отделов позвоночника до полной визуализации границ полости. При выявлении сирингомиелии необходимо
также проведение сканирования кранио-вертебрального перехода для выявления возможных аномалий строения этой области и дополнительное введение контраста при подозрении на интрамедуллярную опухоль. Стенки сирингомиелической полости никогда не накапливают контрастного вещества, МР – сигнал от содержимого полости после введения контрастного вещества также не меняется. По форме контуров кисты в сагиттальной плоскости в области ее полюсов можно косвенно судить о давлении в полости. Кисты с округлым контуром полюса имеют высокое давление, с заостренным контуром — низкое.
Компьютерная томография также позволяет визуализировать сирингомиелическую кисту. Она предоставляет информацию на аксиальных срезах, где кистозная трансформация мозга определяется в виде симптома “бычьего глаза». Более информативным является исследование на уровне шейного отдела спинного мозга, однако, сегментарную протяженность кисты по данным КТ – исследования оценить трудно. Сагиттальная реконструкция структур позвоночного канала основывается на аксиальных срезах, а визуализация кисты на грудном уровне затруднительна. Значительно лучше оценивается сегментарная протяженность кист в сагиттальной проекции при проведении МРТ.
Лечение.
Тактика лечения сирингомиелии определяется причинами ее развития и характером течения. При отсутствии прогрессирования симптоматики в идиопатических вариантах и на фоне краниовертебральных аномалий возможно динамическое наблюдение. В случае прогрессирующего течения —
оперативное лечение. При сирингомиелии на фоне стеноза позвоночного канала или опухоли спинного мозга лечебная тактика определяется не сирингомиелическим синдромом, а состоянием патологического процесса, вызывающего сирингомиелию.
Развитие техники хирургических вмешательств при сирингомиелии отражает эволюцию представлений о ее патогенезе. Первые попытки лечения
сирингомиелии были предприняты Abbe и Coley в 1892 году. Они вскрыли и опорожненили сирингомиелическую кисту, образование которой расценивали как дегенеративный процесс спинного мозга. В. 1926 году Puusepp oпубликовал 2 случая вскрытия сирингомиелической полости с последующим улучшением клинического состояния больных. После этого сирингостомические операции начали постепенно внедряться в практику, однако, стойкого клинического эффекта они в большинстве наблюдений не давали т.к. проводились без учета возможных этиологических механизмов развития сирингомиелии.
Патогенетические механизмы, описанные W.J. Gardner и B. Williams явились теоретической базой для возникновения современных методов хирургического лечения сирингомиелии. В настоящее время лечение сирингомиелии имеет два направления: 1)устранение причины сирингомиелии, 2)дренирование сирингомиелической кисты.
В зависимости от этиологии заболевания устранение причин сирингомиелии может заключаться в удалении опухолей спинного мозга, устранении стеноза позвоночного канала, а также в различных модификациях операций при аномалиях краниоспинального перехода. Устранение причин сирингомиелии создает условия для прекращения роста кист. После тотального удаления интрамедуллярных опухолей в большинстве наблюдений отмечается спадение кист.
Наиболее сложной проблемой является выбор метода операции при сирингомиелии, возникающей на фоне аномалий краниовертебрального перехода. W. J. Gardner, в соответствии со своей теорией, предложил операцию, которая была призвана ликвидировать сдавление структур заднего мозга в большом затылочном отверстии, как причинный фактор формирования сирингомиелической кисты. Она заключалась в широкой резекции чешуи затылочной кости и дужки первого шейного позвонка, рассечении спаек и сращений в области отверстия Мажанди, ревизии устья центрального канала и тампонирования его фрагментом мышечной ткани.
Операция завершалась пластикой твердой мозговой оболочки с целью формирования большой затылочной цистерны.
Концепция B. Williams послужила основанием изменения оперативной методики. Для устранения диссоциации краниоспинального давления автор рекомендовал следующие элементы оперативной техники :
1. Экономную резекцию чешуи затылочной кости для предотвращения дальнейшего опускания мозжечка в костный дефект;
2. Резекция миндаликов мозжечка для профилактики вторичной окклюзии ликворных путей;
3. Закрытие входа в центральный канал фрагментом мышцы, которая фиксировалась силиконовым шариком над входом в центральный канал и швом к задней поверхности продолговатого мозга для предотвращения его смещения.
Ранние публикации о результатах операций W.J.Gardner и B. Williams были оптимистичны, однако, в последующем отмечен высокий уровень послеоперационной смертности – 10%, что привело практически к полному отказу от их использования.
В последние десятилетия практика закрытия устья центрального канала была подвергнута серьезной критике. Анализ результатов показал, что закрытие входа в центральный канал не дает преимуществ по сравнению с операциями без этих процедур. Появившаяся в последние годы концепция
«несообщающейся сирингомиелии», подтвержденная данными МР – исследований, полностью отвергает патогенетическую целесообразность тампонирования устья центрального канала у большинства пациентов.
В настоящее время не существует стандартного объема вмешательства на структурах краниовертебрального перехода и задней черепной ямки при сирингомиелии на фоне краниовертебральных аномалий. В наиболее радикальном варианте современные операции включают резекцию задней полудуги атланта (и, если необходимо, второго шейного позвонка), резекцию чешуи затылочной кости с последующим вскрытием ТМО,
рассечением спаек в области отверстия Мажанди и субпиальной резекцией миндаликов мозжечка или без нее. Вмешательство заканчивается пластикой ТМО для формирования большой затылочной цистерны. Однако, значительная часть хирургов считает, что операции подобного объема нецелесообразны. Вмешательство достаточно ограничить дуротомией и пластикой ТМО, но не проводить вскрытия арахноидальной оболочки и манипуляций в области отверстия Мажанди. Данная позиция обосновывается тем, что при аномалии Киари 1-го типа (большинство пациентов с аномалиями краниовертебрального перехода у взрослых) гидроцефалия встречается крайне редко, а значит ликвороток через отверстие Мажанди сохранен, не смотря на опущение миндаликов мозжечка и их спаянность с продолговатым мозгом. Основным препятствием ликворотоку, создающим диссоциацию краниоспинального давления является отсутствие достаточной по объему большой затылочной цистерны и ее связи с ликвороносными пространствами спинного мозга. Поэтому основной целью операции является костно-дуральная декомпрессия краниовертебрального перехода, после которой на фоне снижения давления в этой области цистерна постепенно фомируется за счет растяжения ранее сжатой арахноидальной оболочки. Еще одним аргументом для отказа от вскрытия арахноидальной оболочки, по мнению сторонников сокрашения объема операции, является неизбежность повторного образования спаек вокруг отверстия Мажанди после их однократного рассечения.
В еще более упрощенном варианте исполнения операция при аномалии Киари 1-го типа может быть ограничена костной декомпрессией, рассечением уплотненной атланто-окципитальной мембраны, которая у этих больных часто представлена в виде плотной перетяжки, охватывающей дуральный мешок, и расслаиванием ТМО. Рассечение или удаление наружного листка ТМО, по мнению авторов, дает возможность оболочкам постепенно растянуться самостоятельно под давлением ликвора. После расслаивания ТМО возможно также подшивание оболочки к мышцам без
ее рассечения. В этом случае снижение давления в области краниоспинального перехода происходит на фоне растяжения ТМО за счет специальных швов, наложенных экстрадурально. Таким образом, экстрадуральные операции также подразумевают формирование большой затылочной цистерны, но только за счет растягивания ТМО.
В настоящее время предложено около 20 методик оперативных вмешательств, направленных на улучшение ликвороциркуляции в области краниовертебрального перехода. Имеется большое количество авторских методик, включающих дуротомию и пластику ТМО и не включающих полного рассечения твердой мозговой оболочки. Рандомизированного многоцентрового исследования для сравнения эффективности краниовертебральной декомпрессии с дуротомией и без нее не проведено, что не позволяет судить об эффективности операций с позиции независимой экспертизы. Описание преимуществ и недостатков различных методик, приводимые в литературе, основываются на мнении отдельных авторов, демонстрирующих собственные серии наблюдений. Сторонники вмешательств без рассечения ТМО указывают на более низкую частоту осложнений, легкое течение послеоперационного периода и быструю послеоперационную реабилитацию. Сторонники использования дуротомии и последующей пластики ТМО указывают на более высокую эффективность вмешательства, особенно в отдаленном послеоперационном периоде.
В целом, рассматривая эволюцию хирургических вмешательств при краниовертебральных аномалиях в сочетании с сирингомиелией, можно констатировать, что, не смотря на отсутствие единого стандарта операций, техника вмешательств в последние годы эволюционирует от максимально агрессивных к более щадящим методикам, позволяющим ускорить послеоперационную реабилитацию пациентов.
Отдельно необходимо отметить особенности тактики лечения небольшой группы больных с аномалией Киари в комплексе с сирингомиелией и гидроцефалией (редкие случаи при аномалии 1-го типа и частые при
аномалии 2-го типа, встречаемой преимущественно у детей). В качестве первого этапа операции у этих пациентов целесообразно использовать вентрикуло-перитонеальное шунтирование, при котором возможен регресс сирингомиелического синдрома и спадение сирингомиелической кисты без вмешательства на кранио-вертебральном переходе. Операция на кранио
вертебральном переходе у этих больных может быть проведена вторым этапом при неэффективности шунтирования.
Еще одна группа пациентов, требующая особого подхода к лечению – случаи сочетания базиллярной импрессии, аномалии Киари и сирингомиелии. У этих пациентов уменьшение размеров задней черепной ямки и каудальная дислокация мозжечка с блоком большой затылочной цистерны могут быть связаны с высоким стоянием зуба второго шейного позвонка. В качестве оперативного лечения первым этапом предлагается передняя декомпрессия краниовертебрального перехода — трансоральная резекция зуба, которая может быть выполнена без вмешательства на структурах задней черепной ямки. При отсутствии клинического эффекта от передней декомпрессии операция может быть дополнена стандартной костно-дуральной декомпрессией из заднего доступа. В подобных случаях декмпрессивное вмешательство из заднего доступа должна дополняться фиксирующей операцией.
После операций на краниовертебральном переходе в случаях нормализации ликвородинамики и устранении диссоциации краниоспинального давления клинические проявления сирингомиелии могут стабилизироваться или уменьшаться даже без значимых нейровизуализационных изменений размеров сирингомиелической кисты. Основной целью операции является
профилактика дальнейшего роста кист и прекращение прогрессирования сирингомиелического синдрома.
Со времени признания теории W.J. Gardner отмечено снижение частоты сирингошунтирующих операций, так как наиболее частой причиной сирингомиелии является аномалия Киари, а основой оперативной техники
при этой патологии стали операции на кранио-вертебральном переходе. С развитием микрохирургической техники и применением современных ареактивных шунтирующих систем ряд авторов вновь возвращается к их выполнению. В настоящее время эти операции выполняются, как правило, при идиопатической сирингомиелии или при отсутствии эффекта после операций на уровне кранио-вертебрального перехода. Наиболее распространена техника сирингосубарахноидального шунтирования. Доступ заключается в ляминэктомии (гемиламинэктомии) одного позвонка на нижнем уровне самого широкого участка кисты. Миелотомия длиной 5 мм производится либо в DRERZ-зоне, либо в зоне наиболее истонченного участка спинного мозга. Силиконовый катетер, используемый при люмбо перитонеальном шунтировании, вводится в сирингомиелическую кисту в оральном направлении на 2- 3 см. и подшивается к арахноидальной оболочке в месте миелотомии для предупреждения его смещения. Дистальный конец катетера устанавливается в субарахноидальном пространстве на протяжении 2-3 см., арахноидальная оболочка ушивается. Для предотвращения ликворного рефлюкса (заполнения сирингомиелической кисты из субарахноидального пространства через шунт) предложены сирингоплевральное и сирингоперитонеальное шунтирование, которые также могут быть выполнены с помощью люмбоперитонеального катетера.
К осложнениям, возникающим после сирингошунтирующих операций относят: локальное спадение стенок сирингомиелической полости с последующим развитием спаечного процесса, врастание глиальной ткани внутрь, расположенного в сирингомиелической полости, отрезка шунта, а также неконтролируемое снижение ликворного давления с развитием симптомов ликворной гипотензии при шунтировании в плевральную и брюшную полость.
В результате хирургического лечения симптомы сирингомиелии при аномалиях краниовертебрального перехода и в идиопатических случаях поддаются различной степени регресса у 30-45 % больных, стабилизация
процесса с остановкой прогрессирующего ухудшения отмечается у 45%. Операция не оказывает влияния на характер течения заболевания у 10-20 % пациентов. Летальность при этом виде патологии в настоящее время не превышает 1-2%.
При наличии положительной динамики уменьшение двигательных расстройств происходит у 25 % больных, регресс расстройств поверхностной чувствительности — у 30 % больных, парестезий — у 25 % больных. Рецидивы заболевания и дальнейшее его прогрессирование после временного улучшения или стабилизации наблюдаются у 20-40% больных. Это может быть связано с прогрессированием рубцово-спаечного процесса в области краниовертебрального перехода, дальнейшей каудальной дислокацией мозжечка в костный дефект, развитием спаечного процесса в месте сирингошунтирующей операции, смещением шунта и т.д. Плохими клиническими прогностическими факторами при хирургическом лечении сирингомиелии считают выраженные мышечные атрофии, грубые диссоциированные чувствительные расстройства на большей части поверхности тела, выраженный сколиоз, длительный анамнез заболевания.
Хирургическое лечение сирингомиелии требует детальной оценки морфологических изменений, приводящих к развитию полостей в спинном мозге, и клинических проявлений заболевания. Лучшие результаты хирургического лечения наблюдаются при операциях, выполняемых в ранние сроки после дебюта клинической картины заболевания т.к. при этом можно ожидать более отчетливый регресс неврологической симптоматики.