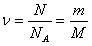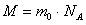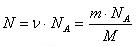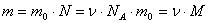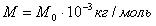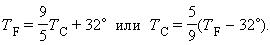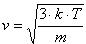Что находится между молекулами
Аллотропия. Взаимодействие между молекулами
Содержание
Мы уже знаем, что молекула и атомы – наименьшие частицы, составляющие то или иного вещества. Однако, иметь знания о составляющих вещество молекулах недостаточно, чтобы описать его свойства. Например, пар и лед состоят из одинаковых молекул воды, но свойства у них отличаются.
Вспомните конструктор «Лего». Мы высыпаем из коробки просто кучу деталей, которые можно собрать и построить дом или автомобиль, в зависимости от того, каким образом одни и те же детали будут нами соединены.
Аналогично обстоит дело и с веществом. Чтобы его описать, необходимо не только знать атомный и молекулярный состав, но и способы соединения частиц, а также их взаимодействия.
Свойство разных простых веществ состоять из одинаковых частиц называется аллотропией, а сами вещества – аллотропными модификациями.
Самым большим количеством аллотропных модификаций обладает углерод (рисунок 14). Его атом получил свое название от вещества, состоящего из атомов угля.
Из таких же самых атомов состоят сажа, графит и алмаз. Просто атомы в них по-другому расположены и по-другому взаимодействуют. Поэтому, их свойства сильно отличаются: из твердого алмаза делают режущие инструменты, а из мягкого графита – стержни для карандашей.

Взаимное притяжение молекул
Если же все молекулы находятся в беспрерывном движении, почему твердые и жидкие тела не распадаются? Значит, молекулы как-то взаимодействуют между собой, взаимно притягиваются друг к другу.
Но, если вы сломаете карандаш, он же не склеится обратно? Из этого можно сделать просто вывод, что притяжение между молекулами действует только на очень коротком расстоянии. Притяжение между молекулами разных тел неодинаково, что объясняется различной прочностью.
Рассмотрим следующий опыт: если у двух цилиндров идеально ровно срезать поверхности и прижать их друг к другу, вам удастся разорвать их только при большой нагрузке (рисунок 16).

Заметим, что притяжение между молекулами становится заметным, когда расстояние между ними не превышает размеров самих молекул.
Если мы попытаемся таким же образом соединить осколки стекла, то из-за неровностей у нас ничего не выйдет – расстояние между молекулами окажется слишком велико.
Но если нагреть куски стекла, то стекло станет возможно починить. На том же принципе происходит соединение кусков металла при сварке или пайке.
Но почему тогда между молекулами существуют промежутки? По логике вещей, они должны намертво слипнуться. Но этого не происходит, поскольку между молекулами (атомами) в то же время существуют силы отталкивания.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание (рисунок 17).
Рассмотрим примеры, подтверждающие существование отталкивания между молекулами. Если вы несильно скомкаете лист бумаги, постепенно он начнет расправляться, так как при сжатии молекулы оказались настолько близко друг к другу, что начало проявляться отталкивание. Другие явление связаны со смачиванием твердого тела жидкостью. Взгляните на рисунок 18.

На пружине с помощью нитей закреплена стеклянная пластина, ее подносят к емкости с водой так, чтобы она легла на поверхность жидкости.
Когда мы пытаемся оторвать платину от поверхности воды, пружина заметно растягивается. Это доказывает существование притяжения между молекулами.
К тому же, мы можем заметить, что стеклянная пластина теперь покрыта тонким слоем воды – это значит, что разрыв произошел там, где молекулы воды соприкасаются друг с другом, а не с поверхностью стекла.
Благодаря эффекту смачивания мы можем вытирать мокрые предметы, но с другой стороны, вода может и не смачивать тела (парафин/воск/жир) – это означает, что молекулы жидкости притягиваются друг к другу с большей силой, чем к молекулам твердого тела.
Урок 4. Взаимодействие молекул
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».
Межмолекулярное взаимодействие
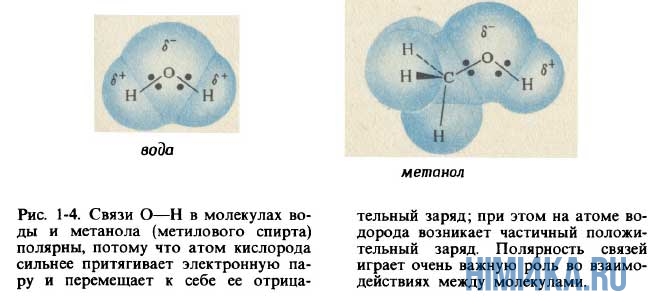
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.
Температура плавления и кипения
Ковалентная полярная химическая связь
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
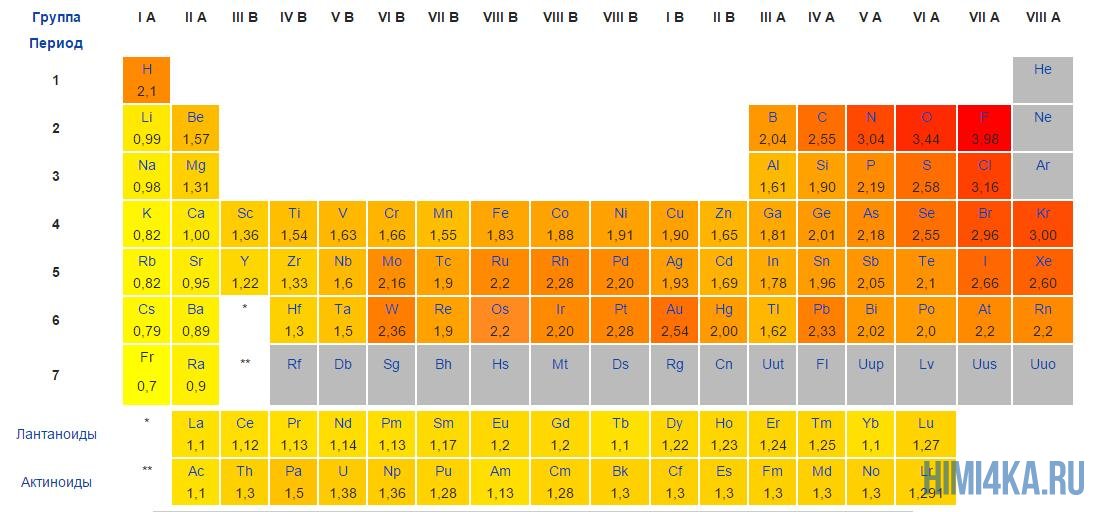
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
Образование водородной связи
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Межмолекулярное строение твердых тел, жидкостей и газов. Агрегатные состояния
Содержание
Чтобы подробнее рассмотреть свойства веществ, нам необходимо разобраться в их молекулярном строении.
Рассмотрим пример. После дождя появилась лужа. Если ударит мороз, и лужа замерзнет, то по ней уже можно будет проехаться. В жару вода из лужи быстро испарится, превратившись в пар. Но разве в этих случаях лужа будет состоять из другого вещества?
Нет, она все так же состоит из одних и тех же молекул. Лед, пар и вода – это одно и то же вещество, но молекулы в нем могут по-разному располагаться и взаимодействовать.
В таких случаях говорят, что вещество способно пребывать в разных состояниях или переходить из одного в другое (рисунок 19).

Агрегатные состояние – это состояния одного вещества, при которых его свойства значительно различаются. Оно определяется расположением молекул вещества и характером их движения. Различают 3 основных агрегатных состояния: твердое, жидкое и газообразное.
Но у веществ существуют и другие состояния. При очень больших температурах молекулы склонны распадаться на составляющие их атомы, ионы и электроны, о которых пойдёт речь позже. Из этих частиц состоит плазма – одно из состояний вещества.
Мы можем ее наблюдать в виде пламени костра или свечи. Вещества, из которых состоит Солнце, тоже пребывают в плазменном состоянии, плазма в атмосфере вызывает полярное сияние. На свойствах плазмы базируется принцип работы плазменных телевизоров.
Бывают неустойчивые состояния веществ: переохлажденные или перегретые жидкости. Они достигаются охлаждением жидкости ниже температуры кристаллизации либо нагревом ее выше температуры испарения при определенных условиях. При этом, незначительное внешнее воздействие на такую жидкость вызывает ее резкий переход в твердое либо газообразное состояние.
Но сейчас мы рассмотрим подробнее основные агрегатные состояния.
Твердое
Твердым можно назвать любой предмет, сохраняющий свою форму, если его специально не разрушать. Другими словами – это такое агрегатное состояние вещества, при котором оно сохраняет свой объем и форму.
Молекулы/атомы в таком веществе находятся на определенных позициях, они могут колебаться на своих местах, но их положение по отношению к другим молекулам/атомам практически не меняется (рисунок 20).
В твердых кристаллических веществах атомы образуют кристаллическую решетку (лед, соль, металлы и др.) (рисунок 21).


В твердых телах притяжение между молекулами (атомами) намного больше, чем у жидкостей. Поэтому в обычных условиях твердые тела сохраняют свою форму и объем.
В твердых аморфных веществах атомы расположены беспорядочно, не имеют кристаллической структуры, но и не находятся в постоянном движении (смола, янтарь). Обычно характеризуются невысокой температурой плавления, из-за чего могут легко переходить в другое агрегатное состояние и обладать текучестью.
Жидкое
К жидкостям относят тела, изменить форму которых очень легко. Например, налить воду из графина в стакан (рисунок 22). Чего нельзя сказать про их объем.
Наполним шприц водой, закроем пальцем отверстие и попробуем сжать воду. У нас ничего не получится. Жидкость – практически несжимаема. Это такое агрегатное состояние, в котором тело способно сохранять свой объем, но не сохраняет форму.

Молекулы жидкости находятся довольно близко (расстояние между каждыми двумя молекулами меньше размеров молекул) и их взаимодействие ощутимое. Молекулярное строение жидкости представлено на рисунке 23.

Также на свойстве жидкости легко изменять свою форму основано изготовление предметов из расплавленного стекла (рисунок 24).

Молекулы жидкости не расходятся на большие расстояния и жидкость в обычных условиях сохраняет свой объем, но не сохраняет форму.
В состоянии невесомости жидкость имеет форму шара, потому что внешние силы уравновешены и форма определяется только силами молекулярного взаимодействия. У последних нет единого направления, поэтому форма жидкости симметрична в любых направлениях.
Газообразное
Большинство газов бесцветны и прозрачны, а потому невидимы. Его присутствие мы можем почувствовать при дуновении ветра, сквозняка в комнате или же на примере простых опытов (рисунок 25).

Опустим в воду воронку, предварительно соединив ее резиновой трубкой со стеклянной трубочкой. Из трубочки начнут выходить пузырьки воздуха, которые до этого были в воронке и во всей системе в целом. Подобные простые опыты подтверждают наличие воздуха вокруг нас.
Молекулы газа находятся на больших расстояниях друг от друга и в постоянном хаотичном движении. Поэтому часто взаимодействие между молекулами газа не учитывается, и большое пространство между частицами позволяет сильно сжимать газы. Молекулярное строение газа представлено на рисунке 26.

Газы не имеют собственной формы и постоянного объема. Они принимают форму сосуда и полностью заполняют предоставленный им объем.
Как сказал.
Жизнь — как вождение велосипеда. Чтобы сохранить равновесие, ты должен двигаться
Вопросы к экзамену
Для всех групп технического профиля

Я учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 14. Лекция 14-1. Основы молекулярно-кинетической теории.
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения, силы взаимодействия между частицами, образующими тела и характеры теплового движения этих частиц.
Многочисленные исследования, проведенные этими учеными позволили сформулироватьосновные положения молекулярно-кинетической теории – МКТ.
МКТ объясняет строение и свойства тел на основе закономерностей движения и взаимодействия молекул, из которых состоят тела.
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
Эти положения подтверждаются опытным путем.
Опытное обоснование 1 положения.
Все тела состоят из мельчайших частиц. Во-первых, об этом говорит возможность деления вещества (все тела можно разделить на части).
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение.
Оно было открыто английским ботаником Р. Броуном (1827 г.). В 1827 году англ. ботаник Броун, изучая внутреннее строение растений с помощью микроскопа обнаружил, что частички твердого вещества в жидкой среде совершают непрерывное хаотическое движение.
Тепловое движение взвешенных в жидкости (или газе) частиц получило название броуновского движения.
Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую. Теория броуновского движения была создана А. Эйнштейном (1905 г.). Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена (1908–1911 гг.).
Непрерывное движение молекул любого вещества (твердого, жидкого, газообразного) подтверждается многочисленными опытами по диффузии.
Диффузией называют явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого. Т.е. это самопроизвольное перемешивание веществ.
Если пахучее вещество (духи) внести в помещение, то через некоторое время запах этого вещества распространится по всему помещению. Это свидетельствует о том, что молекулы одного вещества без воздействия внешних сил проникают в другое. Диффузия наблюдается и в жидкостях, и в твердых телах.
При изучении строения вещества было установлено, что между молекулами одновременно действуют силы притяжения и отталкивания, называемые молекулярными силами. Это силы электромагнитной природы.
Малая сжимаемость весьма плотных газов и особенно жидкостей и твердых тел означает, что между молекулами существуют силы отталкивания.
Эти силы действуют одновременно. Если бы этого не было, то тела не были бы устойчивыми: либо разлетелись бы на частицы, либо слипались.
Межмолекулярное взаимодействие – это взаимодействие электрически нейтральных молекул и атомов.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Epвзаимодействия между молекулами от расстояния между их центрами качественно изображены на рисунке. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
Между электронами одной молекулы и ядрами другой действуют силы притяжения, которые условно принято считать отрицательными (нижняя часть графика). Одновременно между электронами молекул и их ядрами действуют силы отталкивания, которые условно считают положительными (верхняя часть графика). На расстоянии равном размеру молекул результирующая сила равна нулю, т.е. силы притяжения уравновешивают силы отталкивания. Это наиболее устойчивое расположение молекул. При увеличении расстояния притяжение превосходит силу отталкивания, при уменьшении расстояния между молекулами – наоборот.
Атомы и молекулы взаимодействуют и значит обладают потенциальной энергией.
Атомы и молекулы находятся в постоянном движении, и значит, обладают кинетической энергией.
Масса и размеры молекул
Большинство веществ состоит из молекул, поэтому для объяснения свойств макроскопических объектов, объяснения и предсказания явлений важно знать основные характеристики молекул.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Атомом называют наименьшую частицу данного химического элемента.
Размеры молекул очень малы.
О том что размеры молекул малы можно судить и из опыта. В 1 л (м 3 ) чистой воды разведем 1 м 3 зеленых чернил, тете разбавим чернила в 1 000 000 раз. Увидим, что раствор имеет зеленую окраску и вместе с тем однороден. Это говорит о том, что даже при разбавлении в 1 000 000 раз в воде находится большое количество молекул красящего вещества. Этот опыт показывает, как малы размеры молекул.
В молекулярной физике принято характеризовать массы атомов и молекул не их абсолютными значениями (в кг), а относительными безразмерными величинами относительной атомной массой и относительной молекулярной массой.
По международному соглашению в качестве единичной атомной массы m0 принимается 1/12 массы изотопа углерода 12 С (m0С):
Относительную молекулярную массу можно определить, если абсолютное значение массы молекулы (mмол в кг) разделить на единичную атомную массу.
Относительная молекулярная (атомарная) масса вещества (из таблицы Менделеева)
Относительное число атомов или молекул, содержащихся в веществе характеризуется физической величиной, называемой количеством вещества.
Количество вещества ע – это отношение числа молекул (атомов) N в донном макроскопическом теле к числу молекул в 0,012 кг углерода NA
Количество вещества выражают в молях
Один моль – это количество вещества, в котором столько же молекул (атомов), сколько атомов содержится в 0,012 кг углерода.
Масса одного моля вещества называется молярной массой.
Число молекул в данной массе вещества:
Масса вещества (любого количества вещества):
Определение молярной массы:
Видеоресурс: Масса молекул. Количество вещества.
Понятие температуры – одно из важнейших в молекулярной физике.
Беспорядочное хаотическое движение молекул называется тепловым движением.
Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться небольшой. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно диаметру молекулы. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
Понятие температуры тесно связано с понятием теплового равновесия. Тела, находящиеся в контакте друг с другом, могут обмениваться энергией. Энергия, передаваемая одним телом другому при тепловом контакте, называется количеством теплоты.
Рассмотрим пример. Если положить нагретый металл на лед, то лед начнет плавится, а металл – охлаждаться до тех пор, пока температуры тел не станут одинаковыми. При контакте между двумя телами разной температуры происходит теплообмен, в результате которого энергия металла уменьшается, а энергия льда увеличивается.
Энергия при теплообмене всегда передается от тела с более высокой температурой к телу с более низкой температурой. В конце концов, наступает состояние системы тел, при котором теплообмен между телами системы будет отсутствовать. Такое состояние называют тепловым равновесием.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными.
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. Возможность введения понятия температуры следует из опыта и носит название нулевого закона термодинамики.
Тела, находящиеся в тепловом равновесии, имеют одинаковые температуры.
Для измерения температур чаще всего используют свойство жидкости изменять объем при нагревании (и охлаждении).
Прибор, с помощью которого измеряется температура, называется термометр.
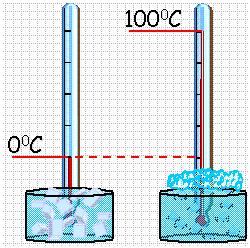
Для создания термометра необходимо выбрать термометрическое вещество (например, ртуть, спирт) и термометрическую величину, характеризующую свойство вещества (например, длина ртутного или спиртового столбика). В различных конструкциях термометров используются разнообразные физические свойства вещества (например, изменение линейных размеров твердых тел или изменение электрического сопротивления проводников при нагревании). Термометры должны быть откалиброваны. Для этого их приводят в тепловой контакт с телами, температуры которых считаются заданными. Чаще всего используют простые природные системы, в которых температура остается неизменной, несмотря на теплообмен с окружающей средой – это смесь льда и воды и смесь воды и пара при кипении при нормальном атмосферном давлении.
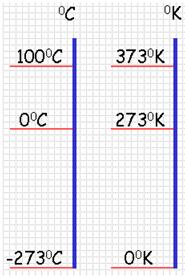
Обыкновенный жидкостный термометр состоит из небольшого стеклянного резервуара, к которому присоединена стеклянная трубка с узким внутренним каналом. Резервуар и часть трубки наполнены ртутью. Температуру среды, в которую погружен термометр определяют по положению верхнего уровня ртути в трубке. Деления на шкале условились наносить следующим образом. Цифру 0 ставят в том месте шкалы, где устанавливается уровень столбика жидкости, когда термометр опущен в тающий снег (лед), цифру 100 – в том месте, где устанавливается уровень столбика жидкости, когда термометр погружен в пары воды, кипящей при нормальном давлении (10 5 Па). Расстояние между этими отметками делят на 100 равных частей, называемых градусами. Такой способ деления шкалы введен Цельсием. Градус по шкале Цельсия обозначают ºС.
По температурной шкале Цельсия точке плавления льда приписывается температура 0 °С, а точке кипения воды – 100 °С. Изменение длины столба жидкости в капиллярах термометра на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С.
В ряде стран (США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды равной 212 °F. Следовательно,
Электрический термометр – термосопротивление – в нем используется зависимость сопротивления металла от температуры.
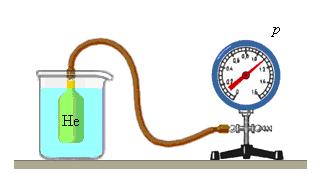
Особое место в физике занимают газовые термометр, в которых термометрическим веществом является разреженный газ (гелий, воздух) в сосуде неизменного объема (V = const), а термометрической величиной – давление газа p. Опыт показывает, что давление газа (при V = const) растет с ростом температуры, измеренной по шкале Цельсия.
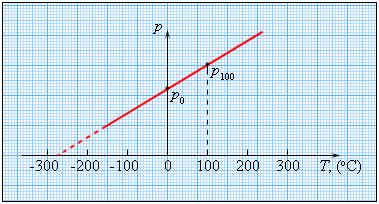
Чтобы проградуировать газовый термометр постоянного объема, можно измерить давление при двух значениях температуры (например, 0 °C и 100 °C), нанести точки p0 и p100 на график, а затем провести между ними прямую линию. Используя полученный таким образом калибровочный график, можно определять температуры, соответствующие другим значениям давления.
Газовые термометры громоздки и неудобны для практического применения: они используются в качестве прецизионного стандарта для калибровки других термометров.
Показания термометров, заполненных различными термометрическими телами, обычно несколько различаются. Чтобы точное определение температуры не зависело от вещества, заполняющего термометр, вводится термодинамическая шкала температур.
Чтобы её ввести, рассмотрим, как зависит давление газа от температуры, когда его масса и объём остаются постоянными.
Термодинамическая шкала температур. Абсолютный нуль.
Возьмем закрытый сосуд с газом, и будем нагревать его, первоначально поместив в тающий лед. Температуру газа t определим с помощью термометра, а давление p манометром. С увеличением температуры газа его давление будет возрастать. Такую зависимость нашел французский физик Шарль. График зависимости p от t, построенный на основании такого опыта, имеет вид прямой линии.
Если продолжить график в область низких давлений, можно определить некоторую «гипотетическую» температуру, при которой давление газа стало бы равным нулю. Опыт показывает, что эта температура равна –273,15 °С и не зависит от свойств газа. Невозможно на опыте получить путем охлаждения газ в состоянии с нулевым давлением, так как при очень низких температурах все газы переходят в жидкие или твердые состояния. Давление идеального газа определяется ударами хаотически движущихся молекул о стенки сосуда. Значит, уменьшение давления при охлаждении газа объясняется уменьшением средней энергии поступательного движения молекул газа Е; давление газа будет равно нулю, когда станет равна нулю энергия поступательного движения молекул.
Английский физик У. Кельвин (Томсон) выдвинул идею о том, что полученное значение абсолютного нуля соответствует прекращению поступательного движения молекул всех веществ. Температуры ниже абсолютного нуля в природе быть не может. Это предельная температура при которой давление идеального газа равно нулю.
Температуру, при которой должно прекратиться поступательное движение молекул, называют абсолютным нулем (или нулем Кельвина).
Кельвин в 1848 г. предложил использовать точку нулевого давления газа для построения новой температурной шкалы – термодинамической шкалы температур (шкала Кельвина). За начало отсчета по этой шкале принята температура абсолютного нуля.
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К.
Размер градуса кельвина определяют так, чтобы он совпадал с градусом Цельсия, т.е 1К соответствует 1ºС.
Температура, отсчитанная по термодинамической шкале температур, обозначается Т. Её называют абсолютной температурой или термодинамической температурой.
Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку. В шкале Кельвина в качестве такой точки используется температура тройной точки воды (0,01 °С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар. По шкале Кельвина температура тройной точки принимается равной 273,16 К.
Чаще пользуются приближенной формулой Т = 273 + t и t = Т – 273
Абсолютная температура не может быть отрицательной.
Температура газа – мера средней кинетической энергии движения молекул.
В опытах Шарлем была найдена зависимость p от t. Эта же зависимость будет и между р и Т: т.е. между р и Т прямопропорциональная зависимость.
С одной стороны, давление газа прямопропорционально его температуре, с другой стороны, мы уже знаем, что давление газа прямопропорционально средней кинетической энергии поступательного движения молекул Е (p = 2/3*E*n ). Значит, Е прямопропорциональна Т.
Немецкий ученый Больцман предложил ввести коэффициент пропорциональности (3/2)k в зависимость Е от Т
Из этой формулы следует, что среднее значение кинетической энергии поступательного движения молекул не зависит от природы газа, а определяется только его температурой.
Так как Е = m*v 2 /2, то m*v 2 /2 = (3/2)kТ
откуда средняя квадратичная скорость молекул газа
Постоянная величина k называется постоянная Больцмана.
Давление газа не зависит от его природы, а определяется только концентрацией молекул n и температурой газа Т.
Соотношение p = 2/3*E*n устанавливает связь между микроскопическими (значения определяются с помощью расчетов) и макроскопическими (значения можно определить по показаниям приборов) параметрами газа, поэтому его принято называть основным уравнением молекулярно – кинетической теории газов.