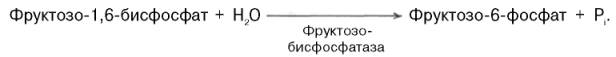Что наблюдается при генетическом дефекте ферментов глюконеогенеза
ГЛЮКОНЕОГЕНЕЗ
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.
У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе).
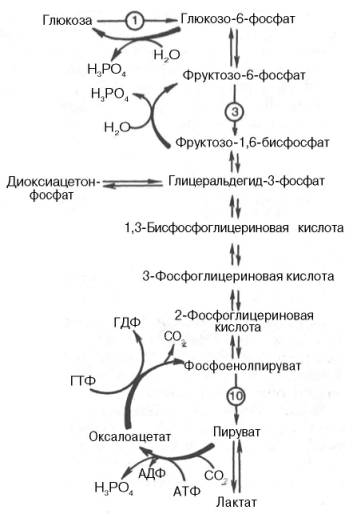
Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глю-конеогенеза на 3 этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
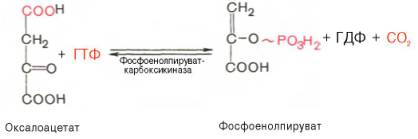
Образование фосфоенолпирувата из пирувата. Синтез фосфоенолпирувата осуществляется в несколько этапов. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:
Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):
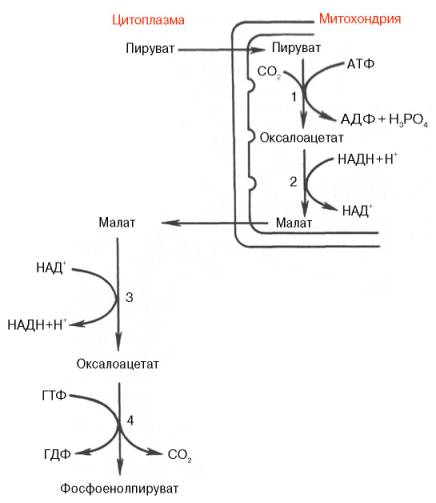
Установлено, что в процессе образования фосфоенолпирувата участвуют ферменты цитозоля и митохондрий.
Первый этап синтеза протекает в митохондриях (рис. 10.6). Пируват-карбоксилаза, которая катализирует эту реакцию, является аллостери-ческим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата. Последний здесь же, в митохондриях, восстанавливается в малат:
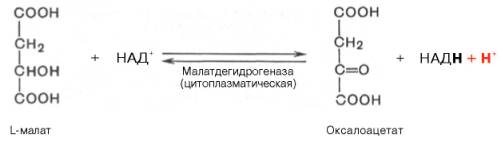
Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН/НАД + относительно велико, в связи с чем внутримитохондриальный оксалоацетат легко восстанавливается в малат, который легко выходит из митохондрии через митохондриальную мембрану. В цитозоле отношение НАДН/НАД + очень мало, и малат вновь окисляется при участии цитоплазматической НАД-зависимой малатдегидрогеназы:
Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитозоле клетки.
Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфо-енолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:
Рис. 10.7. Гликолиз и глюконеогенез. Красными стрелками указаны «обходные» пути глюконеогенеза при биосинтезе глюкозы из пирувата и лактата; цифры в кружках обозначают соответствующую стадию гликолиза.
Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:
На рис. 10.7 представлены «обходные» реакции глюконеогенеза при биосинтезе глюкозы из пирувата и лактата.
Регуляция глюконеогенеза. Важным моментом в регуляции глюконеоге-неза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидроге-назного комплекса (см. далее). Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу.
Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибиру-ется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы.
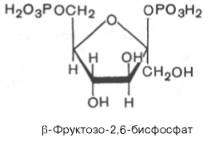
В 1980 г. группой бельгийских исследователей (Г. Херс и др.) в ткани печени был открыт фруктозо-2,6-бисфосфат, который является мощным регулятором активности двух перечисленных ферментов:
Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. Повышение в клетке уровня фруктозо-2,6-бис-фосфата способствует усилению гликолиза и уменьшению скорости глю-конеогенеза. При снижении концентрации фруктозо-2,6-бисфосфата отмечается обратная картина.
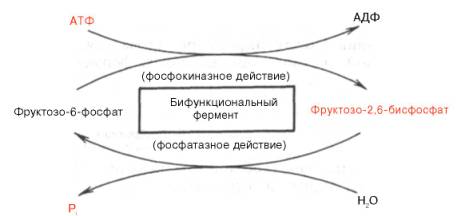
Установлено, что биосинтез фруктозо-2,6-бисфосфата происходит из фруктозо-6-фосфата при участии АТФ, а распадается он на фруктозо-6-фосфат и неорганический фосфат. Биосинтез и распад фруктозо-2,6-бис-фосфата катализируется одним и тем же ферментом, т.е. данный фермент бифункционален, он обладает и фосфокиназной, и фосфатазной активностью:
Показано также, что бифункциональный фермент в свою очередь регулируется путем цАМФ-зависимого фосфорилирования. Фосфорилирова-ние приводит к увеличению фосфатазной активности и снижению фосфо-киназной активности бифункционального фермента. Этот механизм объясняет быстрое воздействие гормонов, в частности глюкагона, на уровень фруктозо-2,6-бисфосфата в клетке (см. главу 16).
Активность бифункционального фермента регулируется также некоторыми метаболитами, среди которых наибольшее значение имеет гли-церол-3-фосфат. Действие глицерол-3-фосфата на фермент по своей направленности аналогично эффекту, который наблюдается при его фосфори-лировании с помощью цАМФ-зависимых протеинкиназ.
В настоящее время фруктозо-2,6-бисфосфат, помимо печени, обнаружен и в других органах и тканях животных, а также у растений и микроорганизмов.
Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно не участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пиру-ваткиназа существует в 2 формах – L и М. Форма L (от англ. liver – печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингиби-руется избытком АТФ и некоторыми аминокислотами, в частности ала-нином. М-форма (от англ. muscle – мышцы) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией происходит инги-бирование L-формы пируваткиназы. Как следствие ингибирования замедляется гликолиз и создаются условия, благоприятствующие глюконеоге-незу.
Наконец, интересно отметить, что между гликолизом, интенсивно протекающим в мышечной ткани при ее активной деятельности, и глюко-неогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани. Взаимосвязь между процессами гликолиза в мышечной ткани и глюконеогенезом в печени может быть представлена в виде схемы:
Что наблюдается при генетическом дефекте ферментов глюконеогенеза
Недостаточность углеводного обмена в печени, нарушение ее глюкостатической функции может носить первичный наследственный и вторичный приобретенный характер. Причем приобретенные формы печеночной недостаточности в поддержании углеводного гомеостаза могут возникать как следствие прямого цитотоксического действия на паренхиму печени патогенных факторов бактериально-токсической, иммунноаллергической, онкогенной природы экзогенного или эндогенного происхождения. В ряде случаев расстройства углеводного обмена в печени возникают в результате нарушений оксигенации паренхимы печени или развития холестаза [1–5].
Следует отметить важное значение нарушений гормонального баланса, в частности изменений соотношения в организме инсулина и контринсулярных гормонов в расстройствах процессов гликолиза, гликогенолиза, гликогенеза, гликонеогенеза, окисления субстратов в цикле Кребса и других реакциях.
Характер и механизмы нарушений углеводного обмена в печени при наследственных формах патологии
Наследственные нарушения метаболизма углеводов в печени именуют гликогенозами (болезни накопления) и агликогенозами (отсутствие гликогена в печени).
Следует отметить, что гликогенозы могут быть не только печеночного происхождения, но и мышечного, а также носить смешанный и даже генерализованный характер.
Первая идентификация гликогенозов и их классификация была предложена супругами Cori (1957). В последующем было установлено XI различных энзиматических дефектов метаболизма углеводов, приводящих к качественным и количественным нарушениям содержания гликогена в органах и тканях. Наиболее часто встречающимися гликогенозами являются гепаторенальный гликогеноз Iа типа (болезнь Гирке), описанный впервые von Girke в 1929 г. [2, 5].
Заболевание выявляется в раннем детском возрасте, характеризуется резким снижением содержания глюкозы в крови (иногда до 0,55–1,1 ммоль/л) и сопровождается развитием судорог, рвоты, коллапса.
Основной генетический дефект, лежащий в основе данного заболевания – это недостаточность фермента глюкозо-6-фосфатазы, наследуемая аутосомно-рецессивно. При этом в ткани печени накапливается глюкозо-6-фосфат, активирующий Д-форму гликогенсинтетазы. Последнее приводит к прогрессирующему возрастанию содержания гликогена в печени. Одновременно выявляется избыточное отложение гликогена в канальцах почек.
Снижение содержания глюкозы в крови подавляет продукцию инсулина, что приводит к активации липолиза, развитию гиперлипидемии, нарушению утилизации субстратов в цикле Кребса. Одновременно возникает накопление промежуточных продуктов распада углеводов и жиров: молочной, пировиноградной кислоты, жирных и кетокислот, а также холестерина, триглециридов, мочевой кислоты.
Достаточно быстро формируется метаболический ацидоз. Формирование гепаторенального гликогеноза нередко приводит к развитию таких осложнений, как подагра, уролитиаз.
Касаясь нарушений клеточного состава периферической крови при гликогенозе Iа типа, следует отметить развитие анемии и лейкопении, при этом в лейкоцитах резко увеличивается содержание гликогена.
Прогноз заболевания неблагоприятен вплоть до развития летальных исходов (в 50 % наблюдений) в раннем детском возрасте. Однако в других случаях возможно относительно благоприятное течение патологии и рождение здоровых детей в потомстве.
Гликогеноз Ib типа
Гликогеноз Ib типа характеризуется наследственной недостаточностью транслоказы глюкозо-6-фосфатазы в эндоплазматическом ретикулюме гепатоцитов, в то время как активность фермента глюкозо-6-фосфатазы достаточно велика.
Гликогеноз III типа
Гликогеноз III типа (болезнь Форбса) связан с недостаточностью фермента амило-1-6-глюкозидазы, является наиболее частой формой гликогеноза, характеризуется выраженной гепатомегалией гипокликемией, умеренным ацидозом и кетонурией. У детей отмечается умеренная задержка роста. Тем не менее течение этой формы патологии более благоприятное, чем при болезни Гирке.
Гликогеноз IV типа
Гликогеноз IV типа (болезнь Андерсена) – крайне редкое аутосомно-рецессивное заболевание связано с наследственным дефектом ветвящего фермента гликогена не только в печени, но в лейкоцитах, фибробластах и мышцах. Содержание гликогена в печени при указанной патологии чаще нормальное, однако структура его аномальна, сходна с амилопектином, включает редкие длинные наружные ветви.
Гипогликемический синдром не выражен, однако прогноз заболевания неблагоприятен в связи с ранним развитием цирроза печени.
Гликогеноз VIа типа
Гликогеноз VIа типа (болезнь Хёрса) – редкая форма аутосомно-рецессивного наследования нарушения активности фосфорилазы печени и лейкоцитов. Заболевание характеризуется развитием гипогликемии и умеренного ацидоза. Прогноз болезни благоприятен в связи с восполнением дефекта фермента фосфорилазы за счет активации реакций глюконеогенеза.
Этиология и патогенез агликогеноза
Агликогеноз – заболевание с аутосомно-рецессивной недостаточностью УДФ-глюкозо-гликогентрансферазы (гликогенсинтетазы) характеризуется отсутствием запасов гликогена в печени, развитием гипогликемии, особенно натощак, в связи с чем возникает необходимость частого приема пищи. В ряде случаев формируется жировая инфильтрация печени, возрастает уровень кетоновых тел в крови. Одновременно снижается содержание аминокислот в крови, участвующих в глюконеогенезе.
Характер и механизмы нарушений углеводного обмена в печени при приобретенных формах патологии
Как указывалось выше, печень играет ведущую роль в поддержании постоянства содержания глюкозы в крови за счет динамического равновесия процессов гликогенеза, глюконеогенеза, гликолиза и гликогенолиза. При повреждении паренхимы печени прежде всего нарушается глюкостатическая функция. Это обусловлено тем фактом, что гликогенез является энергозависимым процессом. Удлинение цепи гликогена на одну молекулу глюкозы требует расхода одной молекулы АТФ и УДФ. В то же время развитие деструктивно-воспалительных процессов гепатоцитов, нарушение оксигенации и трофики печени при различных формах патологии инфекционной и неинфекционной природы, нарушения гормонального баланса, кислотно-основного состояния сопровождаются развитием типовой реакции митохондрий – набуханием [5–8].
При набухании митохондрий нарушается пространственная ориентация дыхательных ферментативных ансамблей на внутренней мембране митохондрий, разобщаются процессы окислительного фосфорилирования и дыхания, возникает дефицит АТФ и, соответственно, подавление всех энергозависимых реакций, в том числе и гликогенеза. В этих случаях нагрузка глюкозой приводит к появлению длительной диабетоидной гипергликемической кривой, а вне нагрузки глюкозой или при редком приеме пищи в связи с истощением запасов гликогена возможна гипогликемия.
Пораженная печень теряет способность трансформировать в гликоген и другие субстраты в реакциях гликонеогенеза, что приводит к избыточному накоплению в крови, тканях и паренхиме печени молочной, пировиноградной, жирных кислот, кетокислот, аминокислот. Последнее в свою очередь является одним из патогенетических факторов развития метаболического ацидоза. Для печеночной недостаточности характерно также нарушение окисления глюкозы в пентозном цикле и соответственно развитие дефицита рибозофосфатов, а также НАДФН2, что приводит к недостаточности антиоксидантных систем и активации свободнорадикальной деструкции гепатоцитов. Нарушения трансформации пировиноградной кислоты в гликоген и окисления ее в цикле трикарбоновых кислот при печеночной недостаточности сопровождается активацией альтернативных механизмов ее метаболизма с образованием токсических соединений – ацетона и бутиленгликоля.
Нарушения углеводного обмена в печени при гормональном дисбалансе
Основными гормональными регуляторами углеводного обмена в печени являются инсулин и контринсулярные гормоны (глюкогон, адреналин, норадреналин, тираксин, трийодтиранин, соматотропный гормон и адренокортикотопный гормоны).
В то же время следует отметить, что гепатоциты занимают промежуточное положение между клетками высокоинсулинзависимых органов и тканей (жировой, соединительной, мышечной, кроветворной и др.) и инсулиннезависимых (центральной нервной системы, надпочечников, гонад, глаза) [2, 3, 5].
Как известно, плазматическая мембрана гепатоцита, в отличие от мио- и липоцита, свободно проницаема для глюкозы без участия инсулина. В то же время в условиях нормы под влиянием инсулина возникает активация гексокиназы (глюкокиназы) в гепатоцитах, миоцитах и липоцитах, а также усиливается синтез жирных кислот из глюкозы, активируются пентозные и гликолитические пути метаболизма глюкозы, повышается активность ферментов цикла Кребса. Активация указанных реакций обеспечивает усиление синтеза АТФ. Дефицит инсулина, как известно, может носить наследственный и приобретенный характер, быть абсолютным или относительным, иметь панкреатическое или внепанкреатическое происхождение. В настоящее время очевидна возможность развития сахарного диабета I и II типов как самостоятельных нозологических форм патологии наследственного генеза, а также формирование вторичного сахарного диабета симптоматического характера при различных эндокринопатиях, сопровождающихся гиперпродукцией контринсулярных гормонов, а также при воспалительно-деструктивных процессах в поджелудочной железе неаутоиммунного характера (при несбалансированном питании, недостаточности незаменимых аминокислот, витаминов, микроэлементов и т.д.) [6, 9, 10].
В условиях дефицита инсулина, абсолютного или относительного преобладания контринсулярных гормонов при различных эндокринопатиях подавляются процессы гликогенеза, снижается активность ферментов пентозного цикла окисления глюкозы, а также окисление субстратов в цикле Кребса. Гликонеогенез активируется лишь под влиянием гормонов АКТГ и глюкокортикоидов при стрессорных ситуациях, болезни и синдроме Иценко – Кушинга, стероидной терапии. Между тем усиление продукции контринсулярных гормонов (глюкагона, катехоламинов, тираксина, трийодтиранина) приводит к активации ферментов фосфорилазы и глюкозо-6-фосфатазы в гепатоцитах и соответственно к усилению мобилизации гликогена из депо.
Таким образом, при нарушених гормонального баланса, в частности при различных формах сахарного диабета (первичного и вторичного), возникает несостоятельность глюкостатической функции печени. При этом глюкоза не утилизируется в инсулинзависимых органах и тканях, а также в печени, несмотря на то, что проницаемость мембран гепатоцитов при вышеуказанных гормональных нарушениях для глюкозы не меняется. Однако в условиях дефицита инсулина блокируются все последующие метаболические пути ее превращения. Последнее приводит к развитию гипергликемии, глюкозурии, лактат- и/или кетоацидоза жировой инфильтрации печени и к тяжелым морфофункциональными изменениям со стороны различных органов и систем.