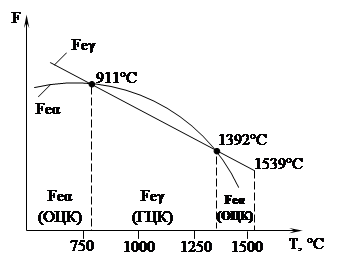Что мы понимаем под атомно кристаллическим строением металла
Атомно-кристаллическая структура металлов



Под атомно-кристаллической структурой понимают взаимное расположение атомов, существующее в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях.
В кристаллах существует не только ближний, но и дальний порядок размещения атомов, т. е. упорядоченное расположение частиц в кристалле сохраняется на больших участках кристаллов.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл (твердое кристаллическое тело).
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки. 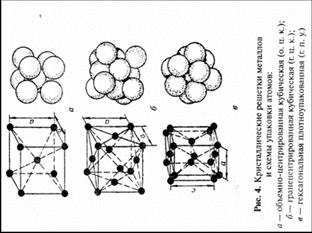
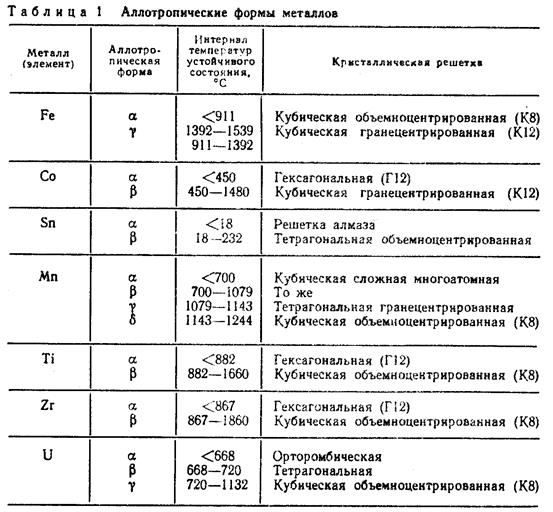
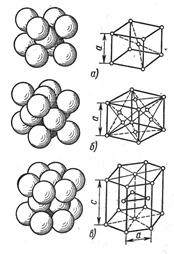
Подавляющее число технически важных металлов образуют одну из следующих решеток: кубическую объемно-центрированную, кубическую гранецентрированную и гексагональную (рис. 4).
В кубической объемно-центрированной решетке атомы расположены в узлах ячейки и один атом — в центре объема куба (рис. 4, а). Кубическую объемно-центрированную решетку имеют металлы: ое-железо, хром, ниобий, вольфрам, ванадий и др.
В кубической гранецентрированной решетке атомы расположены в углах куба и в центре каждой грани (рис. 4, б). Этот тип решетки имеют металлы: железо, никель, медь, золото и др.
В гексагональной решетке (рис. 4, в) атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Эту упаковку атомов имеют металлы: магний, цинк и др.
Некоторые металлы имеют тетрагональную решетку.
Размеры кристаллической решетки характеризуются величинами периодов, под которыми понимают расстояние между ближайшими параллельными атомными плоскостями, образующими элементарную ячейку (рис. 4). Период решетки измеряется в ангстремах (А) (1А=1—8 см).
Период решетки металлов находится в пределах от 1 до 7 А.
Атомно-кристаллическое строение металлов



Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
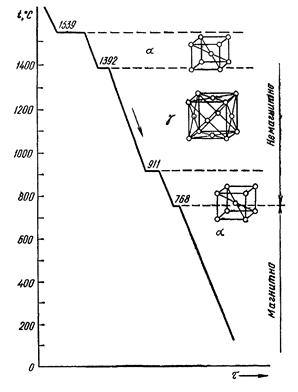
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
|
Рис. 17. График полиморфных превращений железа
Вопросы для повторения раздела.
1. Назовите основные типы кристаллических решеток.
2. Чему равны базис и координационное число для решеток ОЦК, ГЦК и ГПУ?
Что мы понимаем под атомно кристаллическим строением металла
Под атомно-кристаллической структурой понимают взаимное расположение атомов (ионов), существующее в реальном кристалле.
В твердом состоянии металл представляет собой постройку, состоящую из положительно заряженных ионов, омываемых «газом» из свободных коллективизированных электронов. Связь в металле осуществляется электростатическими силами. Между ионами и коллективизированными электронами проводимости возникают электростатические силы притяжения, которые стягивают ионы. Такая связь называется металлической.
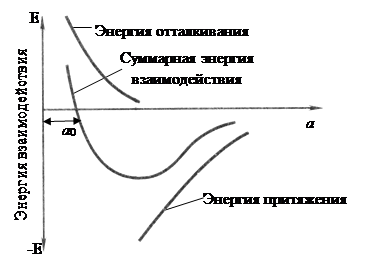
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, при котором энергия взаимодействия минимальна. Как видно из рис. 4, этому положению соответствует равновесное расстояние 


Рис. 4. Схема энергии взаимодействия двух атомов в зависимости от межатомного расстояния
Рис. 5. Схема кристаллической решетки
Поэтому в металле атомы располагаются закономерно, образуя правильную кристаллическую решетку, что соответствует минимальной энергии взаимодействия атомов.
Кристаллическая решетка (рис. 5) состоит из воображаемых линий и плоскостей, проходящих через точки расположения ионов в пространстве. Жирными линиями выведен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл.
Этот наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, получил название элементарной кристаллической ячейки.
Для однозначной ее характеристики необходимо знать следующие величины: три ребра (а, b и с) и три угла между осями а, Р и у (см. рис. 5).
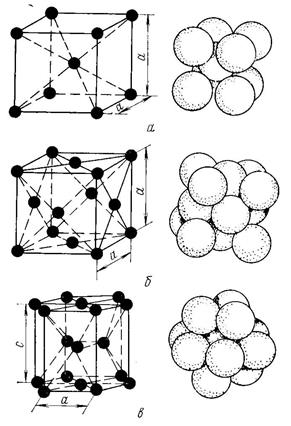
Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную (рис. 6).
Как видно из рис. 6, а, в кубической объемно центрированной решетке (ОЦК) атомы расположены в вершинах куба и один атом в центре объема куба. Кубическую объемно центрированную решетку имеют металлы: 
В кубической гранецентрированной решетке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани (рис. 6, б). Решетку такого типа имеют металлы: 
В гексагональной решетке (рис. 6, в) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: 
Расстояния 

Периоды решетки для большинства металлов находятся в пределах 
На одну элементарную ячейку объемно центрированной решетки приходятся два атома: один в центре куба и другой вносят атомы, располагающиеся в вершинах куба (каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам и на данную ячейку приходится лишь 1/8 массы этого атома, а на всю ячейку 1/8 X 8 = 1 атом).
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один (по такому же
Рис. 7. Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от данного атома А в разных кристаллических решетках (С. С. Штейнберг): а
расчету, как и для объемно центрированной кубической решетки) вносят атомы в вершинах куба, а три суммарно 
На элементарную ячейку гексагональной плотноупакованной решетки приходятся шесть атомов
Плотность кристаллической решетки — объема, занятого атомами, которые условно можно рассматривать как жесткие шары (см. рис. 6, а), характеризуется координационным числом, под которым понимают число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки атомов.
В элементарной ячейке объемно центрированной кубической решетки наименьшее расстояние между атомами соответствует 

Для гранецентрированной кубической решетки координационное число равно 






Рис. 8. Индексы кристаллографических плоскостей (а-в) и направлений (г) в ОЦК решетке
от 1,633 (например, для цинка и кадмия), то координационное число гексагональной решетки соответствует 6.
Гранецентрированная кубическая и гексагональная плотно-упакованная 
При уменьшении координационного числа в гексагональной решетке с 12 до 6 коэффициент компактности составляет около 50 %, а при координационном числе 4 — всего около 25 %.
Половину наименьшего расстояния между атомами в их кристаллической решетке называют атомным радиусом. Атомный радиус возрастает при уменьшении координационного числа, так как при этом увеличивается пространство между атомами. Поэтому атомные радиусы разных металлов обычно приводятся к
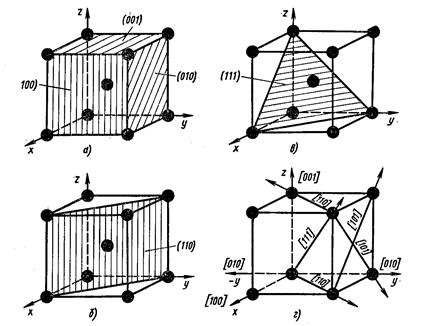
Кристаллографические обозначения атомных плоскостей. Для определения положения атомных плоскостей (проходящих через атомы) в кристаллических пространственных решетках пользуются индексами 
Приведем примеры обозначения плоскостей. Установим первоначально индексы для плоскости куба. Каждая плоскость
куба (рис. 8, а) пересекает только одну ось, при этом отсекаемые отрезки будут равны 


В кубической решетке кроме плоскостей куба (рис. 8, а) различают плоскость октаэдра (111) (рис. 8, в) и плоскость ромбического додекаэдра (110) (рис. 8, б).
Следует иметь в виду, что индексы характеризуют не одну какую-либо плоскость, а целую группу параллельных плоскостей, и тогда их заключают в фигурные скобки.
Индексы направлений. Для определения индексов направлений расположения рядов атомов в кристаллической решетке необходимо из семейства параллельных плоскостей выбрать направление плоскостей, проходящих через начало координат. Далее, приняв за единицу длину ребра элементарной ячейки (или период решетки), определяют координаты любой точки этого направления. Полученные значения координат точки приводят к отношению трех наименьших чисел. Зги числа, заключенные в квадратные скобки 





Анизотропия свойств металлов. Нетрудно видеть, что плотность расположения атомов по различным плоскостям (так называемая ретикулярная плотность) неодинакова. Так, плоскости (100) в ОЦК решетке принадлежит лишь один атом 


Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решетки свойства (химические, физические, механические) каждого монокристалла зависят от направления вырезки образца по отношению к направлениям в решетке. Подобная неодинаковость свойств монокристалла в разных
кристаллографических направлениях называется анизотропией.
Кристалл — тело анизотропное в отличие от аморфных тел (стекло, пластмассы и др.), свойства которых не зависят от направления.
Технические металлы являются поликристаллами, т. е. состоят из большого числа анизотропных кристаллитов. В большинстве случаев кристаллиты статистически неупорядоченно ориентированы по отношению друг к другу; поэтому во всех направлениях свойства более или менее одинаковы, т. е. поликристаллическое тело является псевдоизотропным. Такая мнимая изотропность металла не будет наблюдаться, если кристаллиты имеют одинаковую преимущественную ориентацию в каких-то направлениях. Эта ориентированность, или текстура, создается в известной степени, но не полностью (например, в результате значительной холодной деформации); в этом случае поликристаллический металл приобретает анизотропию свойств.












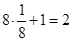 ;
;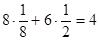 ;
;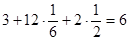 .
.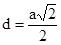 , К12.
, К12.