Что можно сделать с серной кислотой
[Закрыто] Серная кислота, что с ней можно сделать?
Чтобы отправить ответ, вы должны войти или зарегистрироваться
Сообщений [ 21 ] Просмотров: 1 306 [Закрыто]
1 Тема от Хозяин 11.10.2017 20:16:40 (4 года 1 месяц назад)
Тема: Серная кислота, что с ней можно сделать?
Есть литра три-4 у товарища, что с ней делают или ничего не делают?
2 Ответ от v222os22 11.10.2017 20:23:28 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
Посадить за неё можно.
3 Ответ от Yus 11.10.2017 20:23:36 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
кто валенки катает им может пригодиться
4 Ответ от vitalnew 11.10.2017 20:30:48 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
В связи с чем? Электролит, например, это разбавленная серная кислота.
5 Ответ от demonlugovoe 11.10.2017 20:36:28 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
В связи с чем? Электролит, например, это разбавленная серная кислота.
6 Ответ от Хозяин 11.10.2017 20:47:30 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
кто валенки катает им может пригодиться
пропитать? И что изменится
7 Ответ от фрэнсис 11.10.2017 20:50:19 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
много чего делают, вы сделать что то хотите или интересует продажа?
8 Ответ от Yus 11.10.2017 20:54:12 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
кто валенки катает им может пригодиться
пропитать? И что изменится
в технологии изготовления используется.
главное воду в нее не добавить
иначе товарищ убежать не успеет
Отредактировано (11.10.2017 20:57:06, 4 года 1 месяц назад)
9 Ответ от Хозяин 11.10.2017 20:58:55 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
много чего делают, вы сделать что то хотите или интересует продажа?
а сколько она стоит?
10 Ответ от Konstantin23 11.10.2017 21:07:28 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
Туалет на улице можно залить
11 Ответ от NichtName 11.10.2017 21:48:06 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
просто продавать не советую, под уголовку попасть реально. мало-ли где реактив будет использован..
12 Ответ от v222os22 11.10.2017 21:55:24 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
просто продавать не советую, под уголовку попасть реально. мало-ли где реактив будет использован..
13 Ответ от фрэнсис 11.10.2017 21:55:50 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
Хозяин, а какая конкретно у вас?
Re: Серная кислота, что с ней можно сделать?
15 Ответ от vitalnew 11.10.2017 22:55:58 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
В связи с чем? Электролит, например, это разбавленная серная кислота.
Соляная это тоже сильный электролит, но в автомобильных кислотных аккумуляторах используется серная кислота.
16 Ответ от Хозяин 11.10.2017 23:33:00 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
Хозяин, а какая конкретно у вас?
это у товарища, просил узнать, есть какая ценность у нее или нет. Ответов много, спасибо
17 Ответ от vital_xbc 11.10.2017 23:38:49 (4 года 1 месяц назад)
Re: Серная кислота, что с ней можно сделать?
Концентрированная серная кислота входит в список прекурсоров, соответственно ее сбыт, покупка, хранение карается как сбыт, покупка, хранение наркотических веществ. Причем 4л это уже на хороший срок потянет! 

Список прекурсоров, оборот которых
в Российской Федерации ограничен и в отношении
которых устанавливаются меры контроля в соответствии
с законодательством Российской Федерации и международными
договорами Российской Федерации (список IV)
(в ред. Постановления Правительства РФ от 02.07.2015 N 665)
Таблица I
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых устанавливаются
особые меры контроля
Ангидрид уксусной кислоты
10 процентов или более
15 процентов или более
10 процентов или более
10 процентов или более
40 процентов или более
Норпсевдоэфедрин, исключая d-норпсевдоэфедрин (катин)
10 процентов или более
10 процентов или более
10 процентов или более
10 процентов или более
10 процентов или более
10 процентов или более
10 процентов или более
10 процентов или более
Включая соли перечисленных веществ, если существование таких солей возможно.
Таблица II
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых устанавливаются
общие меры контроля
15 процентов или более
15 процентов или более
15 процентов или более
Бутиролактон и его изомеры, за исключением изомеров,
включенных в качестве самостоятельных; позиций в перечень
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
15 процентов или более
Включая соли перечисленных веществ, если существование таких солей возможно.
Таблица III
прекурсоров, оборот которых в Российской Федерации
ограничен и в отношении которых допускается
исключение некоторых мер контроля
40 процентов или более
60 процентов или более
15 процентов или более
40 процентов или более
40 процентов или более
3 процента или более
3 процента или более
Диэтиловый эфир (этиловый эфир, серный эфир)
45 процентов или более
40 процентов или более
80 процентов или более
40 процентов или более
45 процентов или более
45 процентов или более
15 процентов или более
45 процентов или более
40 процентов или более
70 процентов или более
80 процентов или более
Включая соли перечисленных в таблице веществ, если существование таких солей возможно, исключая соли серной, соляной и уксусной кислот.
Отредактировано vital_xbc (11.10.2017 23:43:18, 4 года 1 месяц назад)
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота и последствия отравления ее парами. Справка
Серная кислота – сильная двухосновная кислота, в стандартных условиях представляет собой маслянистую жидкость без цвета и запаха. Неочищенная серная кислота имеет желтоватый или буро-желтый цвет. В технике серной кислотой называют ее смеси как с водой, так и с серным ангидридом.
Основные физические свойства: температура плавления – 10,38 °C; температура кипения – 279,6 °C; плотность вещества – 1,8356 граммов на кубический сантиметр.
Смешивается с водой во всех соотношениях г/100 мл. Концентрированная серная кислота является сильным окислителем. Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода (H), с выделением Н2, окислительные свойства для нее нехарактерны.
Серную кислоту применяют: в производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных кислот и солей; в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ; в нефтяной, металлообрабатывающей, текстильной, кожевенной отраслях промышленности; в пищевой промышленности (зарегистрирована в качестве пищевой добавки E513 (эмульгатор); в промышленном органическом синтезе.
Самый крупный потребитель серной кислоты – производство минеральных удобрений (в частности, фосфорных). Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
При отравлении парами серной кислоты возникает раздражение и ожог глаз, слизистых оболочек носоглотки, гортани, носовые кровотечения, боль в горле, охриплость голоса из-за спазма голосовой щели. При этом особенно опасны отеки гортани и легких.
При попадании серной кислоты на кожу возникают химические ожоги, глубина и тяжесть которых определяются концентрацией кислоты и площадью ожога.
При поступлении серной кислоты внутрь немедленно после приема появляются резкие боли в области рта и всего пищеварительного тракта, сильная рвота с примесью сначала алой крови, а затем бурыми массами. Одновременно с рвотой начинается сильный кашель. Развивается резкий отек гортани и голосовых связок, вызывающий резкие затруднения дыхания. Кожа лица принимает темно-синий цвет, зрачки расширяются. Отмечается падение и ослабление сердечной деятельности.
Смертельная доза серной кислоты при поступлении внутрь – 5 миллиграммов.
При отравлении парами серной кислоты первая помощь состоит в обеспечении пострадавшему свежего воздуха. Необходимо промыть рот и зев раствором соды (20 грамм питьевой соды на 1 литр воды).
При попадании паров или капель серной кислоты на кожу пораженное место обильно промывают водой.
При поступлении серной кислоты внутрь необходимо осторожное промывание желудка, затем больной должен принимать жженую магнезию или известковую воду через 5 минут по 1 столовой ложке. Полезно обильное питье воды со льдом или молока, сырой яичный белок, жиры и масла, слизистые отвары.
Материал подготовлен на основе информации открытых источников
Все что необходимо знать о серной кислоте(H2SO4)
Характеристика

Основное свойство H2SO4 – гигроскопичность, поэтому её часто используют для поглощения влаги из воздуха. В течение этого процесса также происходит выделение тепла. Температура кипения зависит от степени насыщенности. При 98%-ой концентрации, достигается максимум, который составляет 330 °C, при этом возникает распад на H2O и SO3. Температура плавления – 10,38 °C, плотность – 1,84 г/см3.
Состояние жидкости влияет на то, как она изменяет другие элементы при взаимодействии с ними. Все металлы, стоящие в электрохимическом ряду активности, включая серебро, поддаются окислению при 100%-ой концентрации. Разбавленная H2SO4 окисляет все металлы, находящиеся в электрохимическом ряду активности левее водорода, однако платина и золото не состоят в этом списке.
Наблюдаются изменения при взаимодействии с органическими соединениями и неметаллами, итогом которого становится преобразование некоторых из них в уголь. H2SO4 способна растворять SO3, образуя олеум.
Классификация
H2SO4 выше 40% называется концентрированной. Она известна как сильный окислитель и при контакте с серебром или палладием растворяет их. Во время нагревания демонстрирует окислительно-восстановительные качества. Концентрация разбавленных растворов не превышает 40%. Они отличаются меньшей активностью и способны взаимодействовать с медью и латунью.
Чтобы преобразовать концентрированную смесь в разбавленную, более тяжёлую жидкость нужно смешать с H2O. Важно добавлять именно кислоту в воду, соблюдая осторожность. Если сделать наоборот, образуется кипение и токсикологические брызги.
Технологии получения

Традиционными методами, используемыми в промышленности, выступают контактный и нитрозный.
Контактный метод
Нитрозный метод
Нитрозная технология бывает двух видов: камерная и башенная. Преимущества данного подхода состоят в том, что он не требует больших денежных затрат или сложного технологичного оборудования, а также гарантирует переработку диоксида серы.
Но имеются и минусы. В конечном итоге производитель получает 75%-ую концентрацию, которая заметно уступает по качеству тому, что выходит при контактном способе. В составе наблюдается содержание оксида азота, железа и иных примесей. Возврат оксидов азота осуществляется не полностью. Нитрозный способ вреден для экологии, поскольку допускает значительные выбросы токсинов в атмосферу. Тем не менее, этот подход всё равно остаётся довольно-таки популярным.
Исходный материал – сернистый газ. Его преобразование в H2SО4 осуществляется в процессе окислительной реакции с двуокисью серы и присоединения воды. Нитрозная техника не обходится без добавления окислов азота, поскольку двуокись серы не вступает в прямой контакт с кислородом. В течение данного процесса высшие окислы азота превращаются в окись азота NO. Позднее окись азота NO снов окисляется кислородом, преобразуясь в высшие окислы.
В каких отраслях находит применение
Это далеко не все области применения. Вещество выполняет функции эмульгатора при приготовлении пищевой продукции, помогает эффективно устранять отходы в воде. Считается действительно необходимым компонентом в индустрии, замену которой трудно найти. Говоря об этом продукте, Дмитрий Менделеев отмечал, как часто к его помощи прибегают в техническом производстве, и что без него невозможно и невыгодно заниматься приготовлением других веществ.
Соли серной кислоты и область их применения
История изучения
Начало исследований было заложено ещё в Древней Греции, когда учёные заинтересовались происхождением медного купороса и его особенностями. Купорос находил применение как в медицинской практике, так и в металлургии. Первые достижения датируются XIII веком. Согласно записям алхимиков того периода для этого прибегли к нагреванию алюмокалиевых квасцов. Изучив природу квасцов, в XV веке учёные смогли приступить к следующей стадии опытов. Чуть позже, во времена Средневековья в Европе, вещество было известно как «купоросное масло», однако название было изменено на привычную современным людям «кислоту».
Следом за Джошуа к производству приступил Джон Робак из Англии, несколько адаптировав технику. Вместо стеклянных резервуаров он взял освинцованные камеры крупного размера, поскольку они были дешевле. Нововведения Робака позволяли получить 65%-ный раствор. Приёмы англичанина сохраняли популярность в течение двухсот лет. 78%-ая концентрация появилась благодаря химикам из Англии и Франции Гловеру и Гей-Люссаку. В отличие от прошлого варианта этот оказался неподходящим для создания красителей.
Новые техники были разработаны в начале XIX века. На первых порах для этого брали азот, такой способ вскоре стал именоваться «нитрозным». Также для быстрого протекания реакции обращались к платине. Только в тридцатые годы XIX века Перегрином Филипсом был запатентован экономичный путь обработки оксида серы (VI) и концентрированного раствора. А в 1864 году был запущен выпуск природных фосфорных удобрений.
К концу 1800-х годов европейские страны наладили выпуск продукции в количестве до одного миллиона тонн, а лидирующие позиции в поставке заняли Англия и Германия. На их долю приходился 71% от общего объёма. В России корпорации подобного рода открылись после 1805 года в Москве.
Производство в России
Особенности транспортировки
При транзите следует соблюдать осторожность из-за резких ядовитых свойств продукта. Он взрывоопасен и относится к восьмому классу опасности, который включает ядовитые и коррозионные грузы. Допущение перевозчиком грубых ошибок при транспортировке, ставит под угрозу не только людей, но и экологию.
Перевозка происходит при соблюдении правил, гарантирующих безопасность населения. Требуется подобрать устойчивую ёмкость для транзита. Цистерны должны быть изготовлены из сплавов, которые не разрушатся под воздействием ядов. Для перевозки опасных токсинов подойдут сернокислотные химические резервуары. При необходимости поддерживать температуру, как с дымящейся жидкостью, подбираются цистерны-термосы. Для обычного груза подойдёт сернокислотная канистра.
Транспортировка допускается лишь на автомобилях со специальной маркировкой, предупреждающей об опасном грузе. Перевозить цистерны имеют право водители, получившие свидетельство АДР, подтверждающее их компетентность. Они не ограничены во времени при перевозке, поскольку обязаны соблюдать скоростной режим для исключения возможности попадания в аварию. Чтобы избежать ситуаций, создающих угрозу жизни населения, водитель должен ехать по специально-разработанному маршруту, исключающему места большого скопления людей и производственные объекты.
Вред для человеческого здоровья
Токсичная жидкость угрожает здоровью человека не только из-за риска попадания капель на кожные ткани, она может нанести вред внутренним органам поскольку в её состав входит не менее едкий сернистый газ. Ей характерна чрезвычайная агрессивность, а входящий в состав мышьяк усиливает признаки отравления. Безвредной дозой содержания H2SО4 в воздухе считается 0,3 мг на 1 кв. м.
Признаки отравления
Первая помощь и лечение
При контакте с серной кислотой важно в первую очередь вызвать скорую помощь. До того как приедут врачи, пострадавший может самостоятельно облегчить своё состояние. Если химический продукт попал внутрь, нужно промыть желудок тёплой водой, а затем выпить 100 г оливкового или подсолнечного масла маленькими глотками. Для большей пользы можно проглотить немного льда или выпить молока. Это поможет снизить содержание H2SО4.
Если жидкость попала на слизистую оболочку глаз, необходимо промыть их проточной водой. До прибытия скорой помощи в глаза следует закапать раствор новокаина и дикаина. При отравлении парами постращавшему требуется срочно выйти на свежий воздух и промыть слизистые оболочки водой. Чтобы уменьшить площадь повреждения тканей, обожжённый участок кожи нужно промыть проточной водой и приложить повязку с содой.
Если у больного наблюдается желудочное кровотечение, ему необходимо переливание крови и также введение плазмы. В ряде случаев при кровотечении может понадобиться хирургическое вмешательство.
Интересные факты о серной кислоте
Хотя сегодня принято изготавливать серную кислоту на специальных предприятиях, она всё же встречается в природе, причём в 100%-ом виде. Например, в Италии на острове Сицилия можно увидеть, как со дна Мёртвого моря просачивается H2SО4. Это место принято называть Озером смерти, живые существа стараются не подходить слишком близко к нему. Выделение серной кислоты со дна происходит из-за содержания в земной коре пирита.
Серная кислота может выделяться и при сильных извержениях вулкана. Такие явления достаточно опасны для людей и окружающей среды. Одними из последствий попадания H2SО4 в атмосферу могут стать климатические изменения. Серная кислота считается главной причиной, по которой выпадают кислотные дожди, а выделяется она из-за попадания в воздух диоксида серы.
Как уже было ранее замечено, серная кислота эффективно поглощает воду из воздуха. Это качество позволяет использовать её для осушения газов. Раньше было принято наливать жидкость в небольшие ёмкости и оставлять между стёклами. Это помогало предотвратить запотевание окон в комнате.
Серная кислота – полное руководство
Определение
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.
Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу, почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности, Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Серная кислота в лаборатории
В лаборатории серная кислота используется в качестве осушающего агента и в количественном анализе, где концентрация решение рассчитывается с использованием метода, известного как титрование. Всякий раз, когда к кислоте добавляют воду (остерегайтесь реакции с серной кислотой и всегда добавляйте кислоту в воду, а не наоборот), положительно заряженные ионы водорода высвобождаются из кислоты путем донорства протонов. Основания или щелочи, такие как гидроксид натрия, производят отрицательно заряженные гидроксид-ионы в присутствии воды из-за принятия протонов. В зависимости от количества кислоты или щелочи в растворе, можно рассчитать его концентрацию, сложив противоположные и выяснив, когда отрицательные и положительные заряды нейтрализуют друг друга и объединяются, образуя воду молекула, Например, когда серная кислота и гидроксид натрия (NaOH) смешиваются, они реагируют и образуют молекулы воды. Однако такой металл, как натрий, в присутствии серы и воды будет дополнительно производить сульфат натрия (Na2SO4) и воду.
Примером использования титрования может быть определение концентрации раствора серной кислоты. Титрование кислоты требует известной концентрации щелочного реагента (титранта) – в данном случае гидроксида натрия. Добавляя небольшие известные количества основания к кислоте и проверяя реакцию нейтрализации с помощью индикатора pH, можно определить, сколько молей NaOH требуется для реакции с H2SO4, и таким образом рассчитать концентрацию в молях на литр.
Серная кислота в автомобильной промышленности
Серная кислота является электролитом; электролит – это раствор, в котором присутствуют ионы. Свинцово-кислотные аккумуляторы в автомобилях состоят из наборов положительно заряженных пластин из оксида свинца, погруженных в электролит, и отрицательно заряженных пластин из чистого свинца, погруженных аналогичным образом. Этот электролит представляет собой разбавленную серную кислоту (примерно 33%). Вот почему серная кислота часто упоминается как аккумуляторная кислота,
Автомобильные аккумуляторы накапливают химическую энергию и преобразуют ее в электрическую энергию посредством реакций водорода, кислорода, свинца и серы друг с другом. Присутствие дистиллированной (чистой) воды в серной кислоте производит водород и сульфат. Отпущенные отрицательные электроны перемещаются от отрицательной к положительной пластине, в то время как сульфат-ионы замещают эту потерю в отрицательно заряженной пластине (электроде), впоследствии реагируя со свинцом с образованием сульфата свинца. Серная кислота идеально подходит для этой реакции, поскольку она является дипротоновой кислотой, способной высвобождать два своих протона одновременно.
Эта реакция также происходит в положительной пластине, где связи оксида свинца разрываются, и атомы кислорода растворяются в растворе серной кислоты, оставляя атомы свинца в пластине для связи с сульфатом. Присутствие кислорода и водорода в растворе приводит к образованию воды, понижающей концентрацию серной кислоты. Когда эта концентрация слишком низкая, батарею необходимо заменить или перезарядить.
Перезарядка является противоположностью вышеописанного процесса, возвращая аккумулятор в исходное состояние положительной пластины сульфата свинца, отрицательной пластины чистого свинца и исходной концентрации сернокислого электролита; Однако, ионы медленно теряются со временем Именно поэтому срок службы батареи, даже когда она перезаряжаемая, ограничен.
Что касается энергетики, серная кислота также является компонентом литий-серно-хлоридных (Li-SO2Cl2) и литий-серно-диоксидных батарей (Li-SO2). Литий-серные батареи в настоящее время вызывают большой интерес, поскольку теоретически они могут хранить значительно больше энергии, чем литий-ионные альтернативы; Тем не менее, много исследований еще предстоит сделать.
Серная кислота в пищевой промышленности
Серная кислота часто используется в пищевой промышленности для обезвоживания некоторых пищевых продуктов, таких как фрукты, или для остановки роста бактерий и других вредных микробов, которые ускоряют процесс распада. Используется в форме спрея для сохранения мяса или птицы. Серная кислота также является пищевой добавкой общего назначения, используемой в алкогольных напитках и сыре.
Для сушки фруктов высоко ценится способность серной кислоты удалять воду. В присутствии воды серная кислота вступает в реакцию с образованием H3O + (гидроний) и HSO4– (сероводород). Последующая реакция объединяет сероводород с водой для получения большего количества H3O + и SO42- или сульфата. В виде реакция гидратации серной кислоты не требует энергии – это термодинамически выгодно – и так как в нем много атомов водорода (протонов), которые она с радостью жертвует, серная кислота быстро снижает pH любой ткани, с которой она вступает в контакт. Однако, в процессах сушки фруктов концентрированная серная кислота не находится в прямом контакте с фруктами но вместо этого используется для сушки воздуха вокруг него, удаляя влагу и тем самым помогая и ускоряя процесс обезвоживания.
Серная кислота в организме человека
В организме человека только аминокислоты цистеин (необязательно) и метионин (обязательно) содержат серу. Это означает, что многие белки, содержащие их, способны производить небольшое количество серной кислоты при метаболизме. Когда эта нелетучая (метаболическая) серная кислота не расщепляется и не используется, она выводится через почки.
Сера является одним из самых распространенных минералов в организме человека. и легко доступны в пищевых источниках от чеснока до мяса. Большинство волос и кожа Лечение, диетические добавки и совместное лечение фармацевтическими препаратами содержат большое количество этого элемента.
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + CO2
Производство CO2 позволяет организму быстро регулировать pH посредством вентиляции легких, в то время как почки регулируют ионы водорода и бикарбоната посредством экскреция и реабсорбция в более неторопливом темпе.
Кислотные ожоги являются результатом обезвоживания тканей, Коррозионные характеристики сильного раствора серной кислоты обусловлены его способностью отдавать ионы водорода, вызывая мощную реакцию окисления. Кожа содержит большое количество воды, и взаимодействие H2SO4 с H20 приводит к образованию положительно заряженных ионов гидрония (H3O +) и отрицательно заряженного сероводорода (HSO4–), что соответствует реакции, описанной в разделе, описывающем дегидратацию плодов. Когда эта реакция происходит, она также генерирует тепло, которое увеличивает любой ущерб.
Приток серной кислоты в кожу связан с немедленной диссоциацией ее ионов водорода; рН пораженной ткани быстро падает. В этой сильно кислой среде окружающие клетки погибают, что приводит к некрозу коагуляции, образованию капилляров и образованию тромба и тромбов в капиллярах и более крупных размерах. кровь сосуды при ожогах второй и третьей степени.
Добавление воды к концентрированному сжиганию серной кислоты или даже раствора, превышающего 20%, не только добавляет дополнительный ингредиент, с которым может реагировать серная кислота, но и последующая реакция генерирует еще больше тепла и, таким образом, больше ущерба. Полоскание под проточной водой должно производиться только сразу после контакта смыть кислоту с кожи но это не лечение или терапия. Прежде чем проводить какое-либо лечение, кислоту необходимо нейтрализовать. Вот почему иногда рекомендуется мыть немедленно с мылом, поскольку большинство мыл являются щелочными. При сжигании серной кислоты время имеет большое значение. Старая информация об упаковке, изображенная ниже, говорит вам, чтобы вы использовали много мыла, а затем покрыли магнезией или пищевой содой. Все эти вещества являются щелочными. Для приема серной кислоты в этих инструкциях рекомендуется пить мел, мыло или даже настенную штукатурку, еще раз щелочи, которые будут принимать диссоциированные протоны. В обоих случаях несчастному человеку рекомендуется обратиться за медицинской помощью.
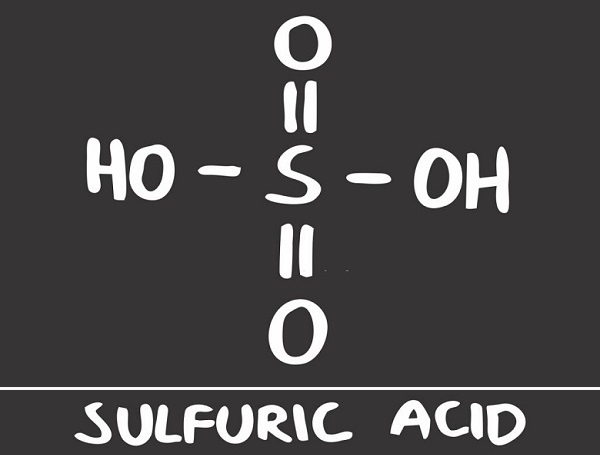
Структура серной кислоты
Структура серной кислоты состоит из одного атома серы, связанного с двумя атомами кислорода посредством двойных связей, и двух гидроксильные группы (ОН) присоединяется через одинарные связи. Это хорошо видно на изображении ниже.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.
Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Серная кислота и автопротолиз
Чистая H2SO4 или безводная H2SO4 является очень полярной жидкостью, что означает, что она содержит молекулы, в которых полярные связи – связи между двумя атомами, которые распределены неравномерно – имеют очень слегка отрицательный и положительный заряд на противоположных концах. Эти заряженные концы могут притягивать или отталкивать противоположно заряженные почти соприкасающиеся молекулы посредством очень слабых диполь-дипольные силы, Серная кислота полностью ионизируется в присутствии воды на ионы гидрония (H30 +) и ионы сероводорода (HSO4–). Однако, без воды серная кислота ионизирует сама с собойгде две молекулы серной кислоты автопротолизуются с образованием одного протонированного иона серной кислоты H3SO4 + и одного иона сероводорода (HSO4–), как видно из уравнения ниже:
2 H2SO4 ⇌ H3SO4 + + HSO4-
Этот высокий уровень ионизации делает серную кислоту превосходной растворитель для широкого спектра реакций и хорошо превосходит свойства растворителя воды.
Серная кислота в нашей среде
Серная кислота является составной частью кислотный дождь и образуется в результате атмосферного окисления газообразного диоксида серы в присутствии влаги. Поскольку диоксид серы образуется, когда ископаемое топливо сжигается либо на производственных предприятиях, для производства электроэнергии и отопления, либо на транспортных средствах, кислотные дожди – это прежде всего антропогенное явление. Сухое осаждение в форме кислых частиц означает, что кислоты могут оседать, а затем вымываться дождевыми осадками, принося кислую воду в пресноводные и морские экосистемы, а также в наземную среду. Это может нанести вред жизни растений и животных.
Результирующие потоки кислой воды, вызванные кислотными дождями, могут привести к дренажу кислых пород (ARD). ARD на самом деле является результатом образования разбавленной серной кислоты в результате минеральных реакций в породе, которые несут значительный ущерб окружающей среде. Регулирующие органы пытаются ограничить воздействие ОРЗ, не допуская попадания воды в промышленные отходы серы, добавляя щелочи в сточные воды и следя за тем, чтобы сточные воды очищались до того, как они попадут в природные источники воды. Кислая вода растворяет различные металлы, присутствующие в сульфидных рудах, и производит яркие, но очень токсичные потоки.