Что можно считать примером раствора воду воздух золото или карандаш
Что можно считать примером раствора воду воздух золото или карандаш
Тела, вещества, частицы
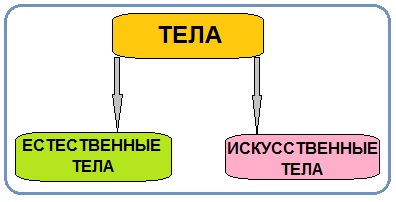
Тела можно разделить на две группы.
Тела, созданные самой природой, называются естественные тела.
Тела, созданные руками человека, называются искусственные тела.
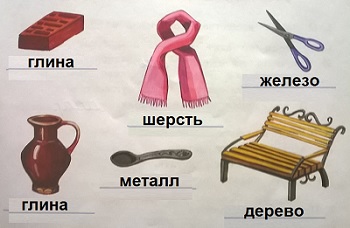
Запиши, из какого вещества сделано тело.
Какое тело имеет определённую форму?
Ответ: Твердые тела имеют постоянную форму.
Заполни таблицу
Алюминий, серебро, тетрадь, древесина, телевизор, чайник, вода, пила, шкаф, крахмал.
Вещества, а значит и тела состоят из частиц.
Каждое вещество состоит из особых частиц, которые по размерам и форме отличаются от частиц других веществ.
Учёные установили, что между частицами есть промежутки. В твёрдых веществах эти промежутки совсем маленькие, в жидких побольше, а в газах еще больше. В любом веществе все частицы движутся.
Частицы можно изобразить с помощью моделей, например шариков.
3 класс. Окружающий мир. Плешаков, Новицкая. Рабочая тетрадь. Часть 1. Страницы 36, 37, 38, 39
Ответы к страницам 36, 37, 38 и 39
Из чего состоит всё
1. Найдите лишнюю фотографию в каждом ряду и обведите её. Объясните (устно) свой выбор.
В верхнем ряду лишняя кружка, т.к. это предмет, созданный человеком, а всё остальное – объекты живой природы.
В нижнем ряду лишняя синичка, т.к. это объект живой природы, а всё остальное – предметы, созданные человеком.
3. С помощью текста и иллюстраций учебника заполни таблицу. Можешь дополнить её своими примерами.
Твёрдые тела, жидкости и газы
| Твёрдые тела | Жидкости | Газы |
| Камень, тарелка, карандаш, книга, дом, компьютер. | Вода, молоко, бензин, нефть, сок, масло. | Кислород, водород, углекислый газ. |
4. Узнай по описанию вещества и впиши их названия в клеточки.
Это вещество входит в состав любого живого организма, тело человека на 2/3 состоит из этого вещества. ( ВОДА )
Это вещество встречается в виде камня под землей, а также растворено в воде морей и океанов. Его можно встретить и в каждом доме на кухне. ( СОЛЬ )
Это вещество добавляют во многие продукты – конфеты, пирожные, торты. В природе оно содержится в растениях. ( САХАР )
Это вещество – наш помощник на кухне, потому что но хорошо горит. Но в случае утечки оно может распространиться по всей квартире, а это очень опасно. ( ПРИРОДНЫЙ ГАЗ )
Эти вещества созданы искусственно. Их используют для изготовления предметов домашней утвари, оконных рам, игрушек и многих других изделий. ( ПЛАСТМАССЫ )
6. Практическая работа (опыт) «Вода — растворитель».
Цель опыта: определить, какие вещества вода растворяет, а какие нет.
1. Предложите план (порядок) проведения опыта.
Налить в стакан воды; положить туда вещество; размешать; наблюдать, растворится ли оно или нет.
2. Рассмотрите рисунок. Выберите оборудование, которое вам понадобится для проведения опыта. Отметьте выбранные предметы галочкой.
3. Выполните действия по инструкции.
Воду из колбы разлейте в 4 лабораторных стакана. В стакан № 1 насыпьте сахар, в стакан № 2 — соль, в стакан № 3 — измельчённый мел (мел измельчите в ступке), в стакан № 4 — глину. Размешайте все вещества стеклянной палочкой.
Что наблюдаете? Опишите устно.
4. Зафиксируйте результаты опыта, поставив знак » в соответствующие графы таблицы.
Вода — растворитель
| Название вещества | Вода растворяет | Вода не растворяет |
| 1. Сахар | + | |
| 2. Соль | + | |
| 3. Мел | + | |
| 4. Глина | + |
5. Сделайте вывод. Проверьте себя по Приложению.
Соль и сахар хорошо растворились в воде, а мел и глина – не растворились.
Вода – растворитель

Всего получено оценок: 54.
Всего получено оценок: 54.
Вода окружает человека, является составной частью животных и растений, без воды невозможна жизнь на Земле. Вода не имеет запаха, цвета, вкуса. Вода легко испаряется, течёт, на морозе превращается в лёд. В воздухе присутствуют пары воды, это даёт возможность дышать всем существам. Ещё одно свойство воды — способность растворять многие вещества.
Что такое раствор
Раствором называют однородную смесь из нескольких веществ, где компоненты неотделимы друг от друга. Обычно растворы представляют собой жидкость.
На обеденном столе множество растворов. Это подсоленный суп, соус к макаронам, сладкий чай и кофе, минеральная вода. Основой большинства растворов является вода.
В природе также много растворов. Самый известный — солёные озёра, где вода растворяет ископаемую соль.
Одно из самых солёных озер — Мёртвое море, где в 1 литре воды содержится 310–350 грамм соли. В растворе присутствуют соли магния, кальция, натрия и калия.
Образование пещер
В горах, сложенных известняком, часто образуются пещеры. В известняке множество микротрещин, по которым с дневной поверхности просачивается вода. Вода — растворитель известняка, поэтому постепенно твёрдое вещество растворяется, на его месте образуется маленькая пустота. Пустота расширяется, формируется пещера.
При растворении известняка вода превращается в раствор, стекающий по стенкам пещеры и капающий с потолка. Из раствора откладывается известняк, очень медленно растут сталактиты, похожие на сосульки.

Почвенные растворы
Вода впитывается в почву, проникает в нижние горизонты. В воде растворяются минеральные вещества, органические соединения. Так образуются почвенные растворы, из которых корневая система растений усваивает питательные вещества. Если почвенные растворы содержат недостаточное количество питательных веществ, применяют различные удобрения.
Нерастворимые вещества
Некоторые вещества не растворяются в воде, их называют нерастворимыми. Это металлы, большинство горных пород, масла, нефть, бензин, воск и другие.
Вещества, более тяжёлые, чем вода, оседают на дно сосуда или водоёма. Дно реки или озера покрыто песком и окатанными камешками-галькой.
Нефть и нефтепродукты легче воды, поэтому при загрязнении реки растекаются по водной поверхности. При этом прекращается доступ воздуха в воду, что приводит к гибели водных организмов.
Что мы узнали?
Вода — природный растворитель. В докладе для урока по окружающем миру в 3 классе можно кратко описать описать это свойство воды на примере растворов природных (солёные озёра, почвенные растворы) и созданных человеком — жидкие блюда (супы, соусы) и напитки (чай, кофе).
Тест с ответами по окружающему миру “Тела, вещества, частицы” для 3 класса
1. Что такое тела:
а) сложные предметы, состоящие из одного или нескольких веществ +
б) газообразное вещество
в) невидимые частицы
2. Что относится к искусственным телам:
а) Луна
б) карандаш +
в) камень
3. Может ли вещества меняться при делении:
а) да
б) в редких случаях
в) нет +
4. Что относится к веществам:
а) крахмал +
б) Солнце
в) гвоздь
5. Какое тело имеет три состояния: мягкое, твердое и газообразное:
а) огонь
б) воздух
в) вода +
6. Какие бывают вещества:
а) узкие
б) твёрдые +
в) длинные
7. Как называются тела, которые создал человек:
а) естественные
б) твердые
в) искусственные +
8. Что относится к естественным телам:
а) комар +
б) кирпич
в) ложка
9. Как называются тела, созданные природой:
а) искусственные
б) мягкие
в) естественные +
10. Назови жидкое вещество:
а) мрамор
б) нефть +
в) природный газ
11. Какие вещества растворяются в воде:
а) сода, соль, сахар +
б) песок, мел, сода
в) соль, сахар, подсолнечное масло
12. Что из находящегося на кухне относится к веществам:
а) солонка
б) сода +
в) крупа
13. Определи, какое вещество может быть молочным, лимонным и яблочным:
а) кислота +
б) крахмал
в) соль
14. К твёрдым веществам относится:
а) бензин
б) вода
в) соль +
15. Отметь опасную жидкость для здоровья:
а) уксус +
б) кефир
в) молоко
16. Отметь вещество:
а) блюдце
б) сахар +
в) сахарница
17. Какие вещества входят в состав воздуха:
а) хлор, фтор
б) водород, медь
в) кислород, азот +
18. Отметь искусственное тело:
а) пчела
б) лампа +
в) муха
19. Какое вещество входит в состав воздуха:
а) йод
б) цинк
в) углекислый газ +
20. Отметь искусственное тело:
а) цветок
б) молоток +
в) птица
21. В какой строке указаны только газообразные вещества:
а) азот, кислород, углекислый газ +
б) кефир, ряженка, хлор, фтор
в) вода, крахмал, соль, перец
22. Отметь искусственное тело:
а) огурец
б) вилка +
в) картофель
23. В какой строчке указаны только вещества:
а) карандаш, чернила, пенал, сахар
б) парта, доска, стол, стул, лампа
в) алюминий, железо, медь +
24. Отметь естественное тело:
а) компьютер
б) цветок +
в) бутылка
25. Частицы питательных веществ всасываются в кровь:
а) в пищеводе
б) в толстой кишке
в) в тонкой кишке +
26. Отметь естественное тело:
а) сковорода
б) помидор +
в) тарелка
27. Какие вещества служат основным «строительным материалом» для тела человека:
а) белки +
б) углеводы
в) витамины
28. Отметь естественное тело:
а) меч
б) мяч
в) бабочка +
29. Какая наука изучает вещества:
а) химия +
б) экология
в) биология
30. Найди вещество:
а) чашка
б) сахар +
в) ложка
Растворы
Содержание:
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Растворы
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Численное выражение состава растворов
В природе и технике растворы имеют огромное значение. Растения усваивают вещества в виде растворов. Усвоение пищи связано с переводом питательных веществ в раствор. Все природные воды являются растворами. Растворами являются важнейшие физиологические жидкости — кровь, лимфа и др. Многие химические реакции протекают в растворах.
Растворы — это однородные (гомогенные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия.
Так, например, раствор серной кислоты состоит из растворителя — воды (первый компонент), растворенного вещества — кислоты (второй компонент) и продуктов их взаимодействия — гидратированных ионов: 




По агрегатному состоянию растворы бывают жидкие, твердые и газообразные. Примером жидких растворов могут быть растворы солей в воде; примером твердых — сплав никеля и меди (из которых делают разменную монету) или сплав серебра и золота; примером газообразных — смеси газов, воздух. Наибольшее значение имеют жидкие (водные) растворы.
Важной характеристикой любого раствора является его состав.
Существуют различные способы численного выражения состава растворов: массовая доля растворенного вещества, молярная концентрация и др.
Массовая доля растворенного вещества — это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т. е.
где 

Массовую долю растворенного вещества 
Молярная концентрация или молярность — это величина, равная отношению количества растворенного вещества к объему раствора, т. е.
где с(Х) — молярная концентрация частиц X, п(Х) — количество вещества частиц X, содержащихся в растворе, V — объем раствора. Основной единицей молярной концентрации является моль/л. Примеры записи молярной концентрации: с(НСl) = 0,1 моль/л, с(



Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется молярным.
Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль — сантимолярным, 0,001 моль — миллимолярным. Молярность раствора обычно обозначается буквой М. Например, 1MNaOH — молярный раствор гидроксида натрия, 1 л такого раствора содержит 1 моль вещества или 1 моль

Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо отвесить 4 г его, внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л (рис. 5.1, а), добавить дистиллированной воды до полного растворения вещества и затем раствор довести до метки [нижняя часть мениска должна касаться метки (рис. 5.1, б)].
Пользоваться молярной концентрацией удобно, так как известно число молей (количество вещества), содержащееся в определенном объеме раствора. Например, для нейтрализации 1 л 1М раствора NaOH необходимы в соответствии с уравнениями реакций:
a) 
следующие объемы растворов кислот: 1 л 1М НСl или 0,5 л 1М 


Растворимость веществ в воде
Растворимость — это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться твердые, жидкие и газообразные вещества.
По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) мало растворимые и 3) практически нерастворимые. Последние называют также нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов.
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. Если растворитель соприкасается с большим количеством вещества, то через некоторое время раствор становится насыщенным.
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Чтобы приготовить насыщенный раствор, надо в воду при данной температуре добавлять при перемешивании вещество до тех пор, пока не образуется осадок, т. е. избыток вещества останется нерастворенным. В этом случае наступит динамическое равновесие между раствором и избытком растворяемого вещества: сколько частиц вещества будет переходить в раствор, столько их будет выделяться (кристаллизоваться) из раствора. В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
В ненасыщенном растворе содержится меньше вещества, а в пересыщенном — больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы. Легкое сотрясение сосуда или введение в раствор кристалла соли вызывает выпадение в осадок избытка растворенного вещества. Пересыщенные растворы образуют сахароза, 



Часто малорастворимые и практически нерастворимые вещества объединяют одним названием — малорастворимые. Тогда говорят только о растворимых и малорастворимых веществах.
Количественно растворимость выражается концентрацией насыщенного раствора. Чаще всего ее выражают максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре. Это количество иногда называют коэффициентом растворимости или просто растворимостью вещества. Так, например, при 18°С в 100 г воды растворяется 51,7 г соли нитрата свинца (II) 
Говоря о растворимости вещества, следует указывать температуру при растворении. Чаще всего растворимость твердых веществ с увеличением температуры возрастает. Это наглядно изображается с помощью кривых растворимости (рис. 5.2). По оси абсцисс откладывают температуру, а по оси ординат — коэффициент растворимости. Однако растворимость некоторых веществ при увеличении температуры возрастает незначительно (например, NaСl, 



С помощью кривых растворимости легко рассчитать, сколько соли выпадет из раствора при его охлаждении. Например, если взять 100 г воды и приготовить при 45°С насыщенный раствор нитрата калия, а затем его охладить до 0°С, то, как следует из кривой растворимости (рис. 5.2), должно выпасть 60 г кристаллов соли. По кривым растворимости легко определяют коэффициент растворимости веществ при разных температурах.
Выделение вещества из раствора при понижении температуры называется кристаллизацией. Если в растворе содержались примеси, то при кристаллизации вещество всегда получается чистым, так как по отношению к примесям раствор остается ненасыщенным даже при понижении температуры и примеси не выпадают в осадок. На этом основан метод очистки веществ, называемый перекристаллизацией.
При растворении газов в воде выделяется теплота. Поэтому в соответствии с принципом Ле Шателье при повышении температуры растворимость газов уменьшается, а при понижении — увеличивается (рис. 5.3). Растворимость газов увеличивается при повышении давления. Так как объем газа, растворяющийся в данном объеме воды, не зависит от давления, то растворимость газа обычно выражают в мл, растворяющихся в 100 г растворителя (рис. 5.3).
Тепловые явления при растворения
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты — в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т. е. выделение теплоты, а при растворении нитрата аммония — сильное охлаждение раствора, т. е. поглощение теплоты. В первом случае осуществляется экзотермический процесс ( 



В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д. И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом»,— писал он в этой книге. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связен, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы (см. § 5.4); поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д. И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ. В химических формулах гидратов и кристаллогидратов формулу воды пишут отдельно (через точку), например 





Таким образом, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д. И. Менделеева Д. П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся контракцией — сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы — физико-химические системы.
Много внимания изучению растворов уделял М. В. Ломоносов. Он провел исследования по установлению зависимости растворимости веществ от температуры, изучал выделение и поглощение теплоты при растворении и открыл охлаждающие смеси. М. В. Ломоносов впервые установил, что растворы замерзают (кристаллизуются) при более низкой температуре, чем растворитель. Он же дал молекулярно-кинетическое объяснение растворению, близкое к современному, полагая, что частицы растворенного вещества равномерно распределяются среди частиц растворителя.
Около 40 лет научной работы посвятил изучению растворов Д. И. Менделеев. Его химическая теория растворов оказалась исключительно плодотворной. На ее основе возникли новые научные дисциплины — такие, как физико-химический анализ, химия комплексных соединений, электрохимия неводных растворов. Ныне эта теория общепризнана.
Большой вклад в развитие химической теории растворов сделали известные русские ученые Д. П. Коновалов, И. А. Каблуков, Н. С. Курнаков.
Электролиты и неэлектролиты
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать е помощью простого прибора (рис. 5.4). Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Так, хлорид натрия NaCl при растворении в воде полностью распадается на ионы натрия 



Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (









2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КА на катион 

Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Механизм диссоциации
Существенным является вопрос о механизме электролитической диссоциации. В самом деле, почему электролиты диссоциируют на ионы? Учение о химической связи атомов помогает ответить на этот вопрос.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов (см. § 3.3). При их растворении
диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом, как показано на рис. 5.5, образуются гидротированные ионы, т. е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентнруются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гид-ратированные ионы (рис. 5.6). Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью — соли, кислоты и основания. И диссоциировать на ноны они могут в полярных растворителях.
Гидратация ионов
Известный русский химик И. А. Каблуков показал, что электролитическую диссоциацию нельзя объяснить без химической теории растворов Д. И. Менделеева. Как известно, Д. И. Менделеев экспериментально обосновал образование химических соединении при взаимодействии растворенного вещества с растворителем. Действительно, при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы (см. рис. 5.6). Эти ионы связаны с молекулами воды, т. е. гидратированы. И. А. Каблуков полагал, что в водном растворе содержатся только гидратирован-ные ионы. В настоящее время это представление общепринято.
Итак, гидратация ионов (в общем случае сольватация — химическая связыюнов с молекулами неводного растворителя) — основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию).
Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода 



Следует помнить, что в растворах нет иона 


Механизм возникновения прочной ковалентной связи в ионе 
Молекула воды — донор, протон — акцептор.
Однако мнения химиков разделились. Одни полагают, что в растворе существуют только ионы гидроксония 







Но обычно для простоты написания указания в скобках опускают.
Диссоциация кислот, оснований и солеи в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, 







Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно). Например:
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами 



Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания, растворимые в воде, называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, RbOH, CsOH, FrOH и 




Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, 


Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными, или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы 

Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода 

Диссоциацию амфотерного гидроксида цннка 
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония 
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Например:
Степень дмссоциации
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа 
Степень диссоциации — это отношение числа распавшихся на ионы молекул п к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если 


Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т. е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые (см. ниже).
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Сильные и слабые электролиты
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде полностью диссоциируют на ионы.
2) многие минеральные кислоты, например 




3) основания щелочных и щелочноземельных металлов.
Диссоциация сильного электролита, например NaCl, обычно изображается уравнением
Как отмечалось выше, в кристалле хлорида натрия отсутствуют молекулы NaCl. При растворении кристаллическая структура разрушается, гидратированные ноны переходят в раствор. Молекулы в растворе также отсутствуют. Поэтому о недиссоциированных молекулах в растворах сильных электролитов можно говорить лишь условно. Их скорее можно представлять как ионные пары (
Однако для простоты его пишут как уравнение (а), под символом NaCl понимая ионную пару (квазимолекулу). Концентрация квазимолекул в растворе всегда очень мала, а концентрация ионов велика.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например 




3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также 

К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Реакции ионного обмена
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак 

Для закрепления этих положении рассмотрим два примера.
Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах,
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов, а уходящие из сферы реакции — в виде молекул:
Эго ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т. е. ионы, не участвующие в реакции (они подчеркнуты):
4. Запишем уравнение реакции в окончательном виде:
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов 


Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия. Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: 



Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Диссоциация воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы 

Концентрацию ионов обычно выражают в молях ионов в 1 л. Как видно из уравнения диссоциации воды, в ней величины [






Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре 

Постоянство произведения [














Из постоянства произведения [






Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов 






Из схемы видно, что чем меньше рН, тем больше концентрация ионов 

Приведем значения рН некоторых наиболее известных растворов и укажем соответствующую им реакцию среды: желудочный сок — рН 1,7 (сильнокислая реакция), торфяная вода — рН 4 (слабокислая), дождевая вода — рН 6 (слабокислая), водопроводная вода — рН 7,5 (слабощелочная), кровь — рН 7,4 (слабощелочная), слюна — рН 6,9 (слабокислая), слезы — рН 7 (нейтральная).
Исключительно велика роль рН в самых различных явлениях и процессах — и в природе, и в технике. Многие производственные процессы в химической, пищевой, текстильной и других отраслях промышленности протекают лишь при определенной реакции среды. Столь же необходима для нормального развития сельскохозяйственных культур и получения высоких урожаев и определенная реакция почвенного раствора. В зависимости от значения рН почвенного раствора почвы подразделяются на сильнокислые (рН 3—4), кислые (рН 4—5), слабокислые (рН 5—6), нейтральные (рН 6—7), слабощелочные (рН 7—8), щелочные (рН 8—9) и, наконец, сильнощелочные (рН 9—11).
Чаще всего растения страдают от повышенной кислотности, для устранения которой применяется известкование почв — внесение в них известняков — карбонатов кальция или магния. Если же почвы отличаются повышенной щелочностью (солонцеватые и солончаковые почвы), то для ее устранения производят гипсование — внесение размолотого гипса 
Необходимость в известковании или гипсовании почв устанавливается с учетом водородного показателя раствора (солевой вытяжки); в зависимости от величины рН устанавливается по таблицам и доза вносимых веществ.
Протолитическая теория кислот и оснований
Теория электролитической диссоциации объяснила многочисленные явления и процессы, протекающие в водных растворах электролитов. Так, например, в разных реакциях нейтрализации
одно и то же значение теплового эффекта (57,3 кДж/моль) объясняется образованием малодиссоцнированных молекул воды из 

При смешении растворов NaCI и
тепловой эффект не наблюдается. Это объясняется тем, что химического взаимодействия между ионами 



Электролитическая диссоциация явилась основой успешного развития теории растворов и изучения процессов, протекающих в них.
В этом заключается ее большое значение в химии. Однако эта теория не объясняет процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы 

Согласно этой теории
кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов.
Реакция отщепления протона изображается уравнением
Кислота и основание такого процесса называются сопряженными. Это кислотно-основная пара. Например, ион 


Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию. Поэтому в растворе всегда протекают два процесса:
и равновесие между ними изображают уравнением
Например, реакцию нейтрализации уксусной кислоты аммиаком можно представить так:
Здесь уксусная кислота является кислотой (отдает протоны 


Аналогично можно изобразить проявление основных свойств азотной кислоты, растворенной в жидком фтороводороде:
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Протолитическая теория рассматривает реакцию нейтрализации как переход протона кислоты к основанию.
Как видно, протолитическая теория расширила круг кислот и оснований по сравнению с представлениями теории электролитической диссоциации: ими могут быть и ионы. Одно и то же вещество в зависимости от того, с чем оно реагирует, может быть или кислотой, или основанием. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания. Протолитическая теория является современной и более общей теорией кислот и оснований.
Раствором называют жидкую или твердую гомогенную систему, состоящую из двух или большего числа исходных веществ (компонентов), относительное содержание которых в системе может изменяться в широких пределах.
Растворы и растворимость
Растворение веществ в воде
Вода – основная биологическая жидкость, инертный растворитель для многих органических и неорганических веществ. Вода необходима для всех живых организмов (рис. 49). Поваренная соль (NaCl) хорошо растворяется в воде (рис. 50).
Способность веществ переходить в раствор называется растворимостью. На растворимость веществ влияют различные факторы.
Растворимость многих твердых веществ увеличивается при повышении температуры. Для газообразных веществ растворимость повышается с увеличением давления и уменьшается с повышением температуры. Растворимость жидких веществ зависит от их химической природы. Спирт и серная кислота неограниченно растворяются в воде, бензин и растительное масло с ней даже не смешиваются.
Любая природная вода является раствором. Воды Каспийского моря содержат 13 г/л, Черного – 19 г/л, Мертвого – 260 г/л различных солей. Содержание солей в Мертвом море очень велико, поэтому в нем нет жизни. Морская вода является многокомпонентным раствором, так как в ней растворены различные вещества.
Раствор – это однородная система, образованная несколькими веществами, между которыми происходят физические и химические взаимодействия.
Компоненты – это вещества, которые образуют раствор. Один из компонентов раствора – растворитель, другой – растворенное вещество (рис. 51).
При растворении веществ образуются насыщенные, ненасыщенные и перенасыщенные растворы. Раствор, который содержит максимальное количество растворенного вещества при данной температуре, называется насыщенным. В ненасыщенном растворе растворенного вещества содержится меньше, чем в насыщенном при данной температуре. А в перенасыщенном растворе растворенного вещества содержится больше, чем в насыщенном при данной температуре. Количественной характеристикой растворимости является коэффициент растворимости.
Коэффициент растворимости (S) показывает, какая максимальная масса вещества
может раствориться в 100 г (1000 г) воды при данной температуре (рис. 52). Растворимость
в воде выражается в граммах вещества на 100 или 1000 г воды (г/100 г 
Лабораторный опыт № 5
«Изучение растворимости веществ».
Цель: исследовать растворимость различных веществ в воде.
Ход работы
1. В три химических стакана налейте с помощью цилиндра определенный объем дистиллированной воды.
2. Испытайте растворимость трех веществ: 
Вопросы и задания
1. Сравните свои наблюдения по растворимости с табличными данными в конце учебника.
2. Влияние какого фактора на растворимость вы исследовали на данном опыте?
Практическая работа №4
Влияние температуры на растворимость твердых веществ
Цель: уметь рассчитывать растворимость вещества на 100 г воды, используя технику выпаривания, сравнивать полученные результаты со справочными данными.
Ход работы
1. Взвесьте на технических весах 10 г 
2. Налейте 20 мл дистиллированной воды в стакан, насыпьте соль, измерьте температуру.
3. Поставьте на асбестированную сетку и нагрейте до полного растворения, измерьте температуру.
4. Привяжите на стеклянную палочку нить и подвесьте над стаканом и охладите до комнатной температуры. Следите, чтобы нить висела вертикально посередине стакана.
Решение задач на тему: растворимость веществ
Обычно мы пользуемся водными растворами. Плотность воды 1 г/мл, поэтому масса воды численно равна объему.
Определение масс растворенного вещества и растворителя для приготовления насыщенного раствора при определенной температуре
Сколько граммов нитрата калия и воды потребуется для приготовления 500 г насыщенного раствора при температуре 30°C, если растворимость при этой температуре равна 45 г?
Расчет масс растворяемого вещества и  для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя
Сколько граммов нитрата свинца 


Расчет массы растворителя, необходимого для растворения определенной массы вещества при определенной температуре
Сколько воды потребуется для растворения 500 г нитрата калия 


Определение растворимости вещества выпариванием
При какой температуре раствор становится насыщенным, если выпарено 50 г воды из 500 г насыщенного раствора нитрата натрия при температуре 40°С ( 

Массовая доля растворенного вещества
Для обозначения соотношения растворенного вещества и растворителя в растворе используется понятие «концентрация».
Концентрация — это величина, определяемая количеством или массой растворенного вещества в единице объема или массы раствора.
Рассмотрим массовую долю растворенного вещества, или процентную концентрацию. В зависимости от количества растворенного вещества растворы подразделяются на
разбавленные и концентрированные. Концентрация веществ выражается массовой долей растворенного вещества в растворе и молярной концентрацией. Вначале рассмотрим процентную концентрацию или массовую долю растворенного вещества в растворе.
В разбавленных растворах количество вещества меньше, чем в насыщенных растворах, а в концентрированных – больше. Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора. Она обозначается греческой буквой 
Если взять определенный объем раствора, то его массу можно выразить следующим образом:
где 
Тогда
Плотность раствора определяют с помощью ареометра (рис. 55, 56).
По этой формуле можно определить следующие величины:
Задача 1. Какова процентная концентрация раствора, если известно, что 20 г вещества содержится в 90 г раствора?
Задача 2. Определите процентную концентрацию раствора, полученного при растворении 45 г соли в 2200 мл воды 
Молярная концентрация вещества в растворе
Второй способ выражения концентрации – молярная концентрация.
Молярной концентрацией раствора (С) называется число молей растворенного вещества в одном литре раствора.
Преобразуя эту формулу, получим следующую формулу:
Молярная концентрация более точна, чем массовая доля растворенного вещества.
Растворы веществ с определенной молярной концентрацией готовят в специальной посуде (мерных колбах).
По формуле можно определить следующие величины:
Расчет молярной концентрации раствора
Задача 1. Рассчитать молярную концентрацию раствора гидроксида натрия, если 0,8 г вещества растворено в 100 мл раствора.
Задача 2. Определите молярную концентрацию, если 5,3 г карбоната натрия содержится в растворе объемом 0,5 л.
Расчет массы вещества, необходимой для приготовления раствора
Задача 3. Сколько граммов гидроксида калия потребуется для приготовления 250 мл раствора концентрацией 0,1 моль/л?
Практическая работа №5
Приготовление растворов с заданной процентной и молярной концентрацией
Опыт 1
Задание
Приготовить 150 г 5%-ного раствора сахара.
Ход работы
1. Вычислите, какая масса сахара потребуется для приготовления данного раствора.
2. Взвесьте эту массу на технических весах в предварительно взвешенном на технических весах стаканчике.
3. Рассчитайте объем воды для растворения взятой навески.
4. Отмерьте мерным цилиндром этот объем воды.
5. Вылейте воду в стакан, растворите в ней сахар, перемешивая раствор стеклянной палочкой.
Опыт 2
Задание
Приготовить 250 мл 0,25 молярного раствора поваренной соли.
Ход работы
1. Рассчитайте, какая масса поваренной соли потребуется для приготовления 250 мл 0,25 молярного раствора соли.
2. На предварительно взвешенном часовом стекле взвесьте рассчитанную в п. 1 массу соли на электронных весах.
3. Взятую взвешанную массу соли всыпьте через воронку в мерную колбу емкостью 250 мл и тщательно смойте дистиллированной водой с воронки оставшуюся на ней соль.
4. Долейте в колбу воду до метки, закройте пробкой и хорошо перемешайте.
5. Вылейте раствор в сухой цилиндр (узкий) и определите плотность.
Вопросы и задания
1. Какая концентрация более точная? Почему?
2. Как вы считаете, может ли плотность водного раствора быть меньше плотности воды?
Типовые задачи по теме «Концентрация растворов»
Массовые доли растворенного вещества
Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации
Сколько граммов соли и воды потребуется для приготовления 300 г 35%-ного раствора?
Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества
Какой объем 14,3%-ного раствора можно приготовить из 30 г сульфата натрия? 
Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора
Сколько вещества нужно растворить в 250 мл воды для приготовления раствора с концентрацией 12%?
Расчет объема раствора
Какой объем 0,3 молярного раствора гидроксида натрия можно приготовить из 3 г этого вещества?
Пересчет процентной концентрации раствора на молярную
Определите молярную концентрацию 40%-ного раствора серной кислоты плотностью 1,307 г/мл.
Расчет объема раствора процентной концентрации для приготовления раствора молярной концентрации
Рассчитать объем 20%-ного раствора соляной кислоты (r = 1,1 г/мл) необходимый для приготовления 0,5 литров раствора концентрацией 0,1 моль/л.
Расчётные задачи по уравнениям реакций с использованием концентрации раствора
Раствор – смесь, состоящая по крайней мере из двух компонентов – растворенное вещество, растворитель. Поэтому при решении задач по уравнению реакции необходимо рассчитать массу чистого вещества в растворе.
Задача 1
Рассчитать объем (н. у.) и количество вещества водорода по реакции взаимодействия цинка с 12%-ным раствором серной кислоты (r = 1,083 г/мл) объемом 50 мл.
Задача 2
Рассчитать объем раствора гидроксида натрия с концентрацией 0,25 моль/л, необходимого для нейтрализации 20%-ной (r = 1,12 г/мл) азотной кислоты объемом 25 мл. Сколько нитрата натрия образуется?
Способы изменения концентрации раствора
Существует несколько способов изменения концентрации раствора:
смешение двух растворов с известными концентрациями, разбавление или сгущение путем выпаривания и добавления растворенного вещества.
Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями
Какова концентрация раствора, полученного смешением 400 г 10%-ного и 300 г 25%-ного растворов?

m (3) = m (1) + m (2) =400 + 300 = 700 г

m (общ.) = m (1) + m (2) = 40 + 75 =115 г

Определение концентрации раствора после разбавления
В лабораториях растворы нужной концентрации готовят путем разбавления концентрированных растворов.
К 500 г 15%-ного раствора соли добавили 200 г воды. Опре делите процентную концентрацию полученного раствора.


Определение концентрации после увеличения массы растворенного вещества в растворе
Концентрацию раствора можно повысить двумя способами:
1) добавлением растворенного вещества;
2) испарением части растворителя
а) Определите концентрацию раствора после добавления 30 г вещества к 250 г 5%-ного раствора.


растворе:
б) Определите процентную концентрацию раствора после испарения 200 г воды из 700 г 15%-ного раствора.


Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.





























































 для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя


































































