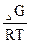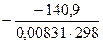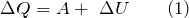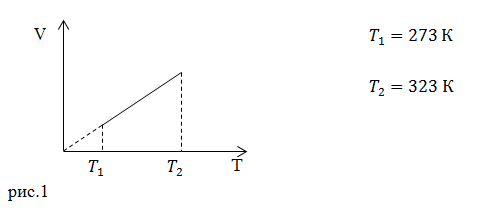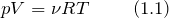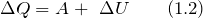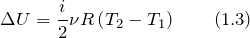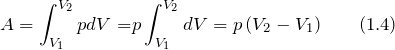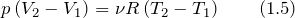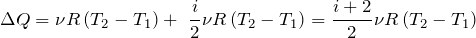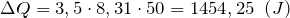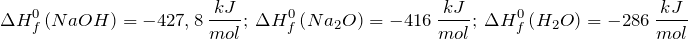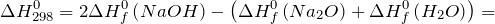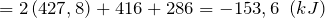Что изучает наука термодинамика в химии
Химическая термодинамика
Определение и общие понятия химической термодинамики
Термодинамика является макроскопической теорией.
Химическая термодинамики использует термодинамические методы для решения задач химии, например, исследования теории разных видов химических и фазовых равновесий и свойств веществ в растворах.
Основной физической величиной, которая подлежит рассмотрению в термодинамике, является энергия. Основным законом термодинамики является вариация закона сохранения энергии. Спецификой макроскопических систем, рассматриваемых в термодинамике, является то, нельзя провести непосредственное измерение энергии макроскопической системы. Разные методы в физике дают возможность определить изменение энергии отдельных частиц системы (атомов, молекул, ионов). Не существует способов прямого измерения энергии как единого целого. Изменение энергии макросистемы определяют как теплоту или работу. Существование внутренней энергии макросистемы (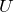
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя которые описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул.
На основе первого начала термодинамики составляют уравнения теплового баланса. Второе и третье начала термодинамики служат для анализа фазового и химического равновесия.
Задачи химической термодинамики
Исследование законов химического и физического равновесия дают возможность решать следующие основные задачи:
Основные законы химической термодинамики
Первый закон термодинамики, которой отображает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это одни из видов законов сохранения энергии. Формулировок первого начала термодинамики несколько, запишем один из них для закрытой системы:
где 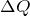
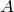
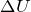
Энтальпией (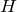
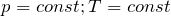
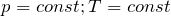
Закон Гесса для химических реакций говорит о том, что: величина теплового эффекта изобарных или изохорных процессов зависит только от начального и конечного состояний системы и не зависит от хода процесса.
Закон Гесса применяют для вычисления тепловых эффектов химических реакций.
Закон Гесса имеет полезные следствия:
Второй закон термодинамики говорит о направлении протекания процессов. Все самопроизвольные процессы происходят так, что система стремится к минимуму энергии, при этом энтропия системы увеличивается.
Примеры решения задач
| Задание | Каково затраченное количество теплоты в процессе, изображенном на рис.1? Процесс проводят с  1 молем азота. Масса газа в процессе не изменяется. 1 молем азота. Масса газа в процессе не изменяется. |
где 
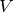
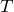
На рис. 1 изображен изобарический процесс. Для этого процесса запишем первое начало термодинамики в интегральном виде:
где изменение внутренней энергии газа можно найти как:
Работа при изобарном процессе в идеальном газе может быть найдена как:
Из уравнения (1.1) и того, что 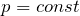
Используя (1.2),(1.3) и (1.5) получаем:
Для азота будем считать 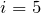
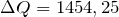 Дж
Дж| Задание | Вычислите изменение энтальпии (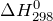 ) для химической реакции: ) для химической реакции: 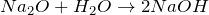 , используя стандартные теплоты образования веществ. Каков тип реакции? , используя стандартные теплоты образования веществ. Каков тип реакции? |
| Решение | Отметим, что 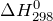 индекс 0 обозначает стандартное давление равное одной атмосфере; 298 – это температура индекс 0 обозначает стандартное давление равное одной атмосфере; 298 – это температура 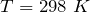 , которая считается стандартной температурой протекания химических реакций. , которая считается стандартной температурой протекания химических реакций. |
Из справочных материалов возьмем значения стандартных энтальпий образования веществ 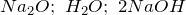
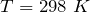
Используя следствие закона Гесса имеем:
Физическая химия: конспект лекций
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Оглавление
Приведённый ознакомительный фрагмент книги Физическая химия: конспект лекций предоставлен нашим книжным партнёром — компанией ЛитРес.
ЛЕКЦИЯ № 2. Химическая термодинамика
Химическая термодинамика — наука, изучающая условия устойчивости систем и законы.
Термодинамика — наука о макросистемах.
Она позволяет apriori определить принципиальную невозможность того или иного процесса. Физические и химические явления в термодинамике исследуются с помощью основных законов термодинамики. Состояние рассматриваемых объектов в термодинамике определяется непосредственно измеряемыми величинами, характеризующими вещества; механизм процесса и сама структура вещества не рассматриваются.
В химической термодинамике изучается применение законов термодинамики к химическим и физико-химическим явлениям.
В ней рассматриваются главным образом:
1) тепловые балансы процессов, включая тепловые эффекты физических и химических процессов;
2) фазовые равновесия для индивидуальных веществ и смесей;
3) химическое равновесие.
Тепловые балансы составляют на основе первого закона термодинамики. На основе второго и третьего законов проводят анализ фазового и химического равновесий.
Изучение законов, которые описывают химические и физические равновесия, имеет огромное значение в химической термодинамике. Значение их позволяет решать задачи для производственной и научно-исследовательской работы. Рассмотрим основные задачи:
1) определение условий, при которых данный процесс становится возможным;
2) нахождение пределов устойчивости изучаемых веществ в тех или иных условиях;
3) устранение побочных реакций;
4) выбор оптимального режима процесса (давления, концентрации реагентов и т. д.).
Основные понятия и определения
1. Системы и их классификация
Система — тело или несколько тел, находящихся во взаимодействии между собой (диффузия, теплообмен, химическая реакция) и отделенных от окружающей среды.
Состояние системы в термодинамике определяется с помощью набора переменных, называемых параметрами состояния и характеризующих термодинамическое состояние при равновесии. Всякое изменение, происходящее в системе и связанное с изменением хотя бы одного из параметров состояния, называется термодинамическим процессом.
Системы имеют определенные границы, отделяющие их от внешней среды, и могут быть гомогенными или гетерогенными.
Гомогенная система — система, в которой все макроскопические свойства в любых ее частях имеют одно и то же значение или непрерывно меняются от точки к точке. Примеры: ненасыщенные растворы, пар, газовые смеси. Составленные части гомогенной системы не могут быть выделены из нее с помощью простых механических приемов (фильтрования, отбора и т. д.).
Гетерогенная система — система, составные части которой отделены друг от друга видимыми поверхностями раздела, на которых происходят резкие скачкообразные изменения какого-либо свойства. Примеры: насыщенный раствор какой-либо соли, находящийся в равновесии с кристаллами этой соли, две несмешивающиеся жидкости и т. д.). Составные части таких систем могут быть отделены друг от друга с помощью механических операций.
Совокупность тел, энергетически взаимодействующих между собой и с другими телами, обменивающихся с ними веществом, называется термодинамической системой.
Системы делят на изолированные (это те системы, которые не обмениваются энергией и веществом с другими системами), открытые (те системы, которые обмениваются с окружающей средой и веществом, и энергией), закрытые (системы, в которых есть только обмен энергией).
2. Термодинамические параметры. Термодинамические показатели. Баланс напряжений
Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми.
Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы — равновесные.
В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы — процессы, в которых система возвращается в первоначальное состояние.
Необратимые — когда система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, — функции состояния; внутренняя энергия, энтальпия, энтропия и другие — полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A.
Функции можно разделить на две группы: экстенсивные и интенсивные.
Экстенсивное свойство системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F.
Интенсивное свойство системы не зависит от массы системы и не обладает свойством аддитивности: Q, A, T, P.
Давление — параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура определяет меру интенсивности теплового движения молекул.
Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению).
Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры — абсолютный нуль, равный 273,15 о С.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, — уравнение состояния.
Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например, температура и объем, а значение третьего параметра — давления — можно определить из уравнения состояния
Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру. Таким образом, термодинамическая поверхность — геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров.
Пусть дан изолированный сосуд, который разделен полупроницаемой перегородкой (рис. 1). В первой части сосуда температура Т1, во второй — температура Т2; Т1 > Т2.
Молекулы, ударяясь о полупроницаемую перегородку, будут отдавать часть энергии, а другие — принимать ее, без механического перемещения.
Форма передачи энергии от одной части системы к другой называется теплотой Q.
Мера переданной энергии от одной системы к другой — количество теплоты. Q не является функцией состояния и не является полным дифференциалом ΔQ.
Работа процесса — это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому.
Обмен энергией между системой и внешней средой обуславливается работой, совершаемой этой системой:
Работа (А) определяется суммой произведений сил, действующих на систему сил (давления и изменения объема).
Работа не является полным дифференциалом, ΔА.
Если протекают равновесные процессы, то работа равновесного процесса будет максимальной величиной, по сравнению с неравновесным процессом
Если телу сообщают определенное количество теплоты, то это значит, что тело надо нагреть, а охладить систему — произвести действие, обратное нагреванию, т. е. отвести энергию.
Работа и теплота являются количественными характеристиками двух форм обмена энергией между системой и окружающей средой.
Понятие внутренней энергии
Внутренняя энергия системы Uвнскладывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярного колебательного движений атомов и атомных групп, энергии, заключающейся в ядрах атомов, энергии межмолекулярного взаимодействия.
Uвнявляется полным дифференциалом, она не зависит от пути процесса, а зависит от начального и конечного состояний системы, она однозначно непрерывна и конечна. Абсолютное значение Uвнопределить нельзя, можно определить только ее изменения.
Q и А качественно и количественно характеризуют форму передачи энергии, взаимосвязь между Q, A, Uвнустанавливает первый закон термодинамики.
К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условий, что система находится в равновесии. Напряжение разложения:
где ΔG — изменение термодинамического потенциала;
п — число электронов, участвующих в химической реакции;
где А — максимальная работа, которую способна совершить система в равновесном состоянии.
где Q — тепловой эффект реакций;
Up — термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза.
Отклонение системы — поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий:
1) подвод реагирующего вещества к границе раздела фаз;
2) разряд и ионизация;
3) отвод продуктов реакции.
Поляризация, определяемая медленной стадией массопереноса — концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природа реагирующего вещества, материал электрода, состояние поверхности электрода, плотность тока, состав раствора и режим электролиза. Кинетический параметр — параметр, определяемый в реальных условиях электрохимической системы: ρ тока, ЕАКТИВ, коэффициент диффузии, коэффициент переноса α (на катод), β (на анод) — доля расхода на процесс:
1) сила тока в электрохимическом аппарате J= iKSед загрузки, A, Z, iK — в зависимости от электролита;
2) скорость электролиза — образование массы вещества за единицу времени
где q — электрохимический эквивалент, v электролиза — J тока,
если в 1 см 2 — v — i тока.
Баланс напряжений. Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих:
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА



Химическая термодинамика изучает энергетические эффекты реакций, их направление и пределы самопроизвольного протекания.
Объект изучения в химической термодинамике — термодинамическая система (в дальнейшем просто система) — это совокупность взаимодействующих веществ, мысленно или реально обособленная от окружающей среды.
Система может находиться в различных состояниях. Состояние системы определяется численными значениями термодинамических параметров: температуры, давления, концентраций веществ и пр. При изменении значения хотя бы одного из термодинамических параметров, например, температуры происходит изменение состояния системы. Изменение состояния системы называется термодинамическим процессом или просто процессом.
Процессы могут протекать с различными скоростями. В зависимости от условий перехода системы из одного состояния в другое, в химической термодинамике различают несколько типов процессов, простейшими из которых являются изотермический, протекающий при постоянной температуре (Т=соnst), изобарный, протекающий при постоянном давлении (р=соnst), изохорный, протекающий при постоянном объёме (V=соnst) и адиабатический, который осуществляется без обмена теплотой между системой и окружающей средой (q=соnst). Наиболее часто в химической термодинамике реакции рассматриваются как изобарно-изотермические (р=соnst, Т=соnst) или изохорно-изотермические (V=соnst, Т=соnst) процессы.
Чаще всего в химической термодинамике рассматриваются реакции, притекающие в стандартных условиях, т.е. при стандартной температуре и стандартном состоянии всех веществ. В качестве стандартной принята температура 298К. Стандартным состоянием вещества является его состояние при давлении 101,3 кПа. Если вещество находится в растворе, за стандартное принимается его состояние при концентрации 1 моль/л.
Для характеристики процессов химическая термодинамика оперирует особыми величинами, называемыми функциями состояния: U – внутренняя энергия, Н – энтальпия, S – энтропия, G – энергия Гиббса и F – энергия Гельмгольца. Количественными характеристиками любого процесса являются изменения функций состояния, которые и определяются методами химической термодинамики:? ΔU, ΔH, ΔS, ΔG, ΔF.
Термохимический расчёт заключается в определении теплового эффекта реакции (теплоты реакции). Теплотой реакции, называется количество выделенной или поглощённой теплоты q. Если в ходе реакции теплота выделяется, такая реакция называется экзотермической, если теплота, поглощается, реакция называется эндотермической.
Численное значение теплоты реакции зависит от способа её проведения. В изохорном процессе, проводимом при V=соnst, теплота реакции qV = ΔU, в изобарном процессе при р = соnst тепловой эффект qp = ΔH. Таким образом, термохимический расчёт заключается в определении величины изменения или внутренней энергии, или энтальпии в ходе реакции. Поскольку подавляющее большинство реакций протекает в изобарных условиях (например, это все реакции в открытых сосудах, протекающие под атмосферным давлением), при проведении термохимических расчётов практически всегда производится расчёт ΔН. Если ΔН 0, то реакция эндотермическая.
Термохимические расчёты производятся, используя следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом суммы теплот (энтальпий) образования реагентов.
Запишем в общем виде уравнение реакции: аА + bВ = сС + dD. Согласно следствию из закона Гесса теплота реакции определяется по формуле:
Базовыми величинами в данной формуле являются теплоты (энтальпии) образования реагентов и продуктов. Теплотой (энтальпией) образования соединения называется тепловой эффект реакции, в ходе которой образуется 1 моль этого соединения из простых веществ, находящихся в термодинамически устойчивых фазах и модификация. Например, теплота образования воды в парообразном состоянии равна половине теплоты реакции, выражаемой уравнением: 2Н2(г) + О2(г) = 2Н2О (г). Размерность теплоты образования – кДж/моль.
Энергией Гиббса реакции называется изменение энергии Гиббса ΔG при протекании химической реакции. Так как энергия Гиббса системы G = Н – ТS, её изменение в процессе определяется по формуле: ΔG =ΔН – ТΔS, где Т – абсолютная температура, К.
Энергия Гиббса химической реакции характеризует возможность её самопроизвольного протекания при постоянном давлении и температуре (при р=соnst, Т=соnst). Если ΔG 0 самопроизвольное протекание реакции невозможно, если ΔG = 0, система находится в состоянии равновесия.
Для расчёта энергии Гиббса реакции отдельно определяются ΔН и ΔS. При этом в большинстве случаев используется слабая зависимость величин изменения энтальпии ΔН и энтропии ΔS от условий протекания реакции, т.е. пользуются приближениями: ΔН = ΔН°298 и ΔS = ΔS°298.
Стандартную теплоту реакции ΔН°298 определяют, используя следствие из закона Гесса, а стандартную энтропию реакции аА + bВ = сС + dD рассчитывают по формуле: ΔS°298= (сS°298 обрС + dS°298, обрD) – (aS°298 обрА + bS°298обрB), где ΔS°298 – табличные значения абсолютных стандартных энтропии соединений в Дж/(мольК), а ΔS°298 – стандартная энтропия реакции в Дж/К.
Если реакция протекает в стандартных условиях при температуре 298К, расчёт её энергии Гиббса (стандартной энергии Гиббса реакции) можно производить аналогично расчёту стандартной теплоты реакции по формуле, которая для реакции, выраженной уравнением аА + bВ = сС + dD, имеет вид:
ΔG°298=(сΔG°298 С + dΔG°298 D) – (аΔG°298 A + bΔG°298 B), где ΔG°298 — стандартная энергия Гиббса образования соединения в кДж/моль (табличные значения) – энергия Гиббса реакции, в которой при температуре 298К образуется 1 моль данного соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, а ΔG°298 – стандартная энергия Гиббса реакции в кДж.
Задача 1. Для данной реакции 2SO2 (г)+ O2(г) = 2SO3(г) рассчитайте изменение энтальпии ΔН298, энтропии ΔS298 и энергии Гиббса ΔG298. Рассчитайте температурную область самопроизвольного протекания реакции. Рассчитайте константу равновесия данной реакции при стандартных условиях (таблицы стандартных термодинамических потенциалов приводятся в различных справочниках).
из приложения Таблицы стандартных термодинамических потенциалов выбираем значения ΔН ° 298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
из таблицы стандартных термодинамических потенциалов выбираем значения ΔS ° 298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
=2? 256,2 – (2?248,1 +205) = –188,8 
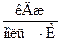
по полученным данным рассчитываем энергию Гиббса (при стандартных условиях Т = 298К):
ΔG ° 298=ΔН ° 298–T?ΔS ° 298=−197,2кДж/моль – 298?(–0,1888) 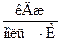
Так как условием самопроизвольного протекания реакции является отрицательность DG (DG ° 298≤ 0, следовательно:
ΔН ° 298– T? ΔS ° 298 ≤ 0, отсюда Т ≤ 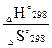
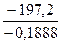

т.е. при всех температурах, меньших 1044,5 К, будет обеспечиваться отрицательность DG и, следовательно, в данном температурном диапазоне будет возможным самопроизвольное протекание рассматриваемой реакции.
Расчет константы химического равновесия:
Кр = e 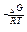
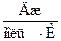
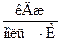
Рассчитываем, используя известные данные:
–