Что изображено на рисунках а и б назвать этапы приготовления препарата
ЭТАПЫ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА
РУКОВОДСТВО ДЛЯ СТУДЕНТОВ
К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
ПО МИКРОБИОЛОГИИ






«Энгельсский медицинский колледж»
РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований»
раздел «Морфология микроорганизмов»
Руководство для студентов
отделения 060110 «Лабораторная диагностика»
на руководство к практическим занятиям
по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований»
раздел «Морфология микроорганизмов»,
составленное преподавателем микробиологии А.В. Палиенко
Представленная работа составлена в соответствии Государственного стандарта и квалификационной характеристики специальности 060110 «Лабораторная диагностика». Построено в соответствии современными педагогическими и методическими требованиями. Данное руководство обеспечит самостоятельность студентов в работе на практических занятиях по микробиологии и облегчит педагогический процесс. Для эффективного усвоения материала имеются вопросы и тестовые задания для студенческого самоконтроля. По каждому занятию указан объем выполняемой практической работы. Приведенные в работе алгоритмы, рисунки, схемы помогут систематизировать и закрепить знания студентов по данной теме.
В руководстве приводится микроскопический метод исследования микроорганизмов, который позволяет изучить тинкториальные и морфологические свойства микроба, степень чистоты выделенной культуры, расположение микроорганизмов в мазках, выявить структуры клетки – споры, капсулы, определить подвижность микроба, дифференцировать кислотоустойчивые бактерии. Все эти признаки необходимы для идентификации микроорганизма. С помощью этого метода можно подтвердить клинический диагноз инфекционных заболеваний.
Учебное пособие предназначено для использования во время практических занятий по микробиологии раздел «Морфология микроорганизмов», а также для самостоятельной работы студентов дома.
Рецензент: Глинская Е.В., к.б.н., доцент кафедры микробиологии и физиологии растений биологического факультета СГУ им. Н.Г.Чернышевского
Ответы на тестовые задания ………………………………………. 31
Лабораторные занятия проводятся в специально оборудованных помещениях, имеющих подводку электричества к каждому рабочему месту, а также раковину с водопроводной водой. Поверхность рабочих столов покрыта стеклом для лучшей дезинфекции. За каждым студентом закрепляется постоянное рабочее место, на котором должно быть оборудование, необходимое для выполнения конкретного задания, рабочая тетрадь, ручка и карандаш. Для личных вещей отводится специальное место.
В начале занятия студенты знакомятся с определенным заданием, изложенным в учебном пособии, делают записи основных методик в рабочей тетради, а затем приступают к выполнению работы под наблюдением преподавателя. Результаты исследований в виде рисунков, описаний морфологии микроорганизмов заносятся в тетрадь, и работа представляется преподавателю для проверки.
В связи с тем, что на практических занятиях студенты работают с живыми культурами микробов, анилиновыми красителями, химическими веществами, а также используют электрические приборы (лампы) и спиртовки, они обязаны выполнять основные правила техники безопасности (приложение №1,2).
Все задания студентами выполняются самостоятельно в соответствии с задачами, поставленными в учебном пособии.
Автор будет признателен за все замечания и предложения по содержанию включенного материала и совершенствованию методики обучения.
ВВЕДЕНИЕ В ПРАКТИКУМ
Объективы подразделяются на сухие и иммерсионные (погруженные). При работе с сухими объективами между фронтальной линзой и изучаемым объектом находится воздух. При этом, в виду разницы коэффициентов преломления предметного стекла и воздуха, часть световых лучей отклоняется и не попадает в объектив.
Объективы иммерсионные обозначают буквами О.И. и цифрами х90 и х100.
Современные микроскопы имеют ряд усовершенствований. Так, бинокулярный микроскоп с двумя тубусами дает возможность вести наблюдение одновременно обоими глазами.
Для изучения неокрашенных объектов используется фазово-контрастное устройство, с помощью которого можно получить четкое контрастное изображение прозрачных, не имеющих окраски микроорганизмов. При прохождении света через окрашенный препарат, изменяется интенсивность света (амплитуда световой волны), что легко улавливается глазом. При прохождении же пучка света через неокрашенный, прозрачный объект изменяется только скорость его движения, т.е. фаза колебаний светового луча, что глазом не улавливается. Принцип фазово-контрастного устройства заключается в переводе невидимых колебаний света в амплитудные видимые.
В ряде специальных исследований, в частности при изучении внутриклеточных структур микроорганизмов, используется люминесцентная микроскопия, основанная на способности некоторых объектов при специальном окрашивании флюорохромами светиться в коротковолновых лучах света (ультрафиолетовых, синих и др.). К флюорохромам относятся акридиновый желтый, пиронин, акридиновый оранжевый. Люминесцентная микроскопия проводится с обычным микроскопом, снабженным источником ультрафиолетовых лучей и набором светофильтров, выделяющих коротковолновую часть спектра.
Наиболее совершенными приборами, дающими возможность получать полезное увеличение объекта в 200-500 тыс. и более раз, являются электронные микроскопы, в которых вместо световых лучей используется поток электронов. С помощью электронных микроскопов удается рассмотреть белковые молекулы.
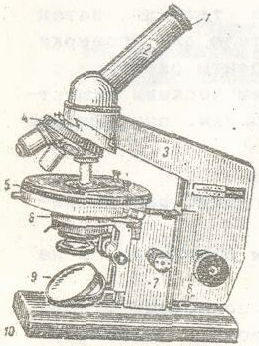
1 – окуляр, 2 – тубус,
4 – револьвер объективов,
5 – предметный столик,
7 – микровинт, 8 – макровинт
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №1
Простые и сложные методы окрашивания. Окраска препаратов по методу Грама. Способы приготовления красителей.
Студент должен знать:
— технику безопасности в кабинете (лаборатории) микробиологии (приложение №1),
— требования к помещению и оборудованию в лаборатории (приложение №2),
— характеристика «грязной» и «чистой» зоны лаборатории. Перечень комнат и их предназначение,
— требования к проведению работ в бактериологической лаборатории,
— спецпрофилактика сотрудникам лаборатории,
— этапы приготовления препарата, его фиксация: виды и цель,
— простые методы окрашивания,
— сложные методы, сущность метода Грама,
— особенности окраски по методу Грама, красители и реактивы,
— подготовка насыщенных, водных растворов и красителей.
Студент должен уметь:
— доставка патологического материала. Материал на патогенные биологические агенты (ПБА),
— прием материала в регистратуре,
— обработка отработанного материала и лабораторной посуды,
— поведение при «аварии» в лаборатории,
— приготовление бактериального препарата,
— окраска препарата по методу Грама,
-микроскопия окрашенных препаратов с использованием иммерсионной системы,
— соблюдение мер безопасной работы с живыми культурами микробов,
— обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы:
1. Подготовить препараты и окрасить их простым методом и по методу Грама
2. Препараты промикроскопировать с иммерсией
3. Обработать рабочие места и руки
4. Зарисовать результаты микроскопирования в дневник
Рецепты приготовления красителей
1. Карболовый фуксин Циля:
— насыщенного спиртового раствора основного фуксина – 10 мл
Внимание! Карболовую кислоту вливают в краситель, а не наоборот. Смесь встряхивают, фильтруют и сливают во флакон
2. Насыщенные спиртовые растворы (исходные):
Смесь помещают в термостат на несколько дней до полного растворения. Взбалтывают ежедневно, хранят с притертыми пробками
3. Фуксин Пфейффера:
— воды дистиллированной – 9 мл
Готовят непосредственно перед употреблением, т.к. раствор нестойкий.
4. Бумага по Синеву:
— 1%спиртовой раствор кристаллического фиолетового:
на 100 мл 96% спирта добавляют 1 гр сухого красителя и 3 мл глицерина
Полоски фильтровальной бумаги пропитывают раствором и высушивают.
ЭТАПЫ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА
Занятие № 5-6. Тема: «Техника приготовления микропрепаратов для микроскопии»
Занятие кружка « Мир под микроскопом»
Тип занятия : комплексное применение знаний
Форма обучения: заочная ( с применением информационно-коммуникативных технологий, в том числе с применением дистанционных образовательных технологий)
Занятие разработано: по Дополнительно общеобразовательной (общеразвивающая) программе «Мир под микроскопом» Составитель: канд. биол. наук, доцент Габдулинова Камиля Гапбасовна.
Основой занятия – Является просмотром видео лекций, презентации, самостоятельное выполнение заданий, обобщающее тестирование.
Необходимые технические средства: выход в интернет, ноутбук. смартфон, микроскоп.
Методы и приемы: репродуктивные, интерактивные, частично-поисковые, исследовательские, наглядные, диалоговый.
Деятельность обучающихся: индивидуальная
Технологии: ИКТ, личностно-ориентированная, здоровье сберегающая.
Основные принципы при проведении занятия:
не развлекательность, а занимательность и увлечение как основа эмоционального фона занятия;
создание условий для общения учащихся как основы внутренней мотивации к учению;
уважительное отношение к детскому знанию и незнанию;
оценка не только знаний, но и стремления к ним, находчивости;
Образовательные: (ориентированные на достижение предметных результатов):
— развивать самостоятельность при ведении учебно-познавательной деятельности.
— знакомить с многообразием микроскопов, устройством и правилами работы с ними (на примере цифрового микроскопа).
— обучать технике изготовления микропрепаратов; способам фиксирования результатов наблюдений в виде фото и видео, выполненных с помощью цифрового микроскопа.
— сформировать у школьников представление о принципах функционирования микроскопа и об основных методах микроскопирования;
Развивающие: (ориентированные на метапредметные результаты образования):
— развить способности аналитически мыслить, сравнивать, обобщать, классифицировать изучаемую информацию;
— развивать у обучающихся представления и понятий об объектах и явлениях окружающего мира (неживой и живой природы, а также предметах, изготовленных людьми) в процессе работы с цифровым микроскопом.
Воспитательные: (ориентированные на личностные результаты):
— воспитание бережного отношения к природе через осознание неповторимости и своеобразия природных объектов и явлений в процессе их изучения с помощью микроскопа.
— развитие эмоциональной сферы и восприятия, сохранение чувства удивления, восхищения открывающимися гранями красоты природы при созерцании микромира
Техника приготовления временных микропрепаратов
Видео лекция « Приготовление временных препаратов»
Задание для индивидуальной работы
Микроскопы открывают крохотные миры. С помощью микроскопа можно увидеть невероятный мир, существующий на клеточном уровне. Поразительным свойством микропрепаратов является возможность их длительного хранения и наблюдения распада клеток с течением времени. В любом случае, если не терпится поскорее взглянуть на образец или проводится долгое научное исследование, нужно научиться приготавливать микропрепараты.
Приготовление сухого препарата
Сухие препараты используются для изучения образцов, не требующих для выживания контакта с водой. Для начала потребуется чистое предметное стекло. Осторожно поместите как можно более тонкий срез образца в центр предметного стекла и накройте его покровным стеклом. Если вы в резиновых перчатках, можете слегка придавить покровное стекло, чтобы выровнять препарат.
Приготовление влажного препарата
Влажные препараты используются, если образец не может обходиться без воды, чтобы оставаться живым. Это часто бывает с одноклеточными организмами и мелкими животными. Возьмите чистое предметное стекло. С помощью пипетки, поместите одну-две капли дистиллированной воды в центр стекла. Поместите в воду образец и накройте его покровным стеклом. Опять же, можно немного прижать покровное стекло, если на руках резиновые перчатки. Прикосновение к стеклу без перчаток оставит на нем отпечатки, мешающие наблюдениям препарата под микроскопом.
Влажные препараты сами по себе удерживают покровное стекло на месте и могут храниться некоторое время. Если исследуемые микроорганизмы слишком подвижны, чтобы их можно было изучать, «замедлить» их, добавив в воду связующий компонент, например «Protoslo» (1,5% раствор метилцеллюлозы).
Некоторые организмы трудно увидеть под микроскопом без дополнительного окрашивания. Лучший способ это сделать – добавить капельку раствора Люголя (раствор йода и йодида калия) в воду перед тем, как поместить в нее образец. Также можно использовать растворы «метиленового синего» или «кристаллического фиолетового».
Видео лекция » Приготовление временных препаратов»
Рекомендации по изготовлению временных микропрепаратов
и выполнению биологического рисунка
Правила приготовления микропрепаратов
Техника приготовления временных микропрепаратов
1. Микропрепараты готовят путем помещения объектов в каплю воды на предметном стекле, тщательно расправляя их с помощью препаровальных игл
и накрывая покровным стеклом. Избыток воды удаляется фильтровальной бумагой.
2. Приготовленный препарат рассматривается вначале при малом (×8, ×20),
а затем при большом (×40, ×60, ×90 с иммерсией) увеличении микроскопа с осветителем. При использовании иммерсионной системы микроскопа на препарат наносят каплю кедрового масла и рассматривают без покровного стекла.
3. Рассматриваемые объекты зарисовываются и подписываются.
4. Узнать увеличение микроскопа, при котором рассматривается тот или иной объект, просто. Для этой цели необходимо умножить цифру, стоящую на объективе, на цифру, обозначенную на окуляре (эта цифра всегда со знаком ×). Например, при объективе 40 и окуляре ×10, микроскоп дает увеличение в 400 раз.
Техника выполнения биологического рисунка
Зарисовке ботанических объектов нужно уделять серьезное внимание, так как это не только способ оформления результатов наблюдения, но и метод эксперимента, позволяющий более детально изучить объект.
1. Рисунок должен быть четким, пропорциональным, правильно отражать результаты наблюдений, трактовку исследованных структур.
2. Схему строения таллома рисуют при малом, а детальное строение отдельных клеток при большом увеличении микроскопа.
3. Располагают рисунок с левой стороны листа.
4. На правую сторону выносят стрелки с цифрами и расшифровывают их
в подрисуночной подписи.
5. Рисунок должен быть крупным (не более двух на листе). Делают его простым карандашом.
Видео лекция «Приготовление фиксированных препаратов»
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Практический материал «Техника приготовления временных препаратов»
Задание 1. Ознакомление с лабораторным оборудованием, применяемом при работе с микроскопом.
Ознакомьтесь с назначением лабораторного оборудования, применяе- мого при работе с микроскопом: микротомом, предметными и покровными стеклами, пинцетом, пипеткой, препаровальной иглой и др.
Задание 2. Освоение техники приготовления временных препаратов.
Изготовьте препарат эпидермы (кожицы) сочной чешуи луковицы лука. Для правильного выполнения задания используйте литературу для учащихся [2, 3], презентацию лекции «Продолжим знакомство с микроско- пом».
Найдите и рассмотрите при малом увеличении участок эпидермы, со- стоящий из одного слоя клеток с хорошо заметными ядрами (используйте нижнюю подсветку микроскопа). Изучите строение клетки при большом увеличении.
Задание 3. Выводы по занятию.
Литература для педагога
Приготовление микропрепаратов. https://www.4glaza.ru/articles/about_kits_for_experimenting/
Литература для учащихся и учебная литература
Литература для родителей:
ЭТАПЫ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА
РУКОВОДСТВО ДЛЯ СТУДЕНТОВ
К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
ПО МИКРОБИОЛОГИИ






Государственное образовательное учреждение
среднего профессионального образования
«Энгельсский медицинский колледж»
РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований»
раздел «Морфология микроорганизмов»
Руководство для студентов
отделения 060110 «Лабораторная диагностика»
на руководство к практическим занятиям
по курсу «Микробиология с основами эпидемиологии и методами микробиологических исследований»
раздел «Морфология микроорганизмов»,
составленное преподавателем микробиологии А.В. Палиенко
Представленная работа составлена в соответствии Государственного стандарта и квалификационной характеристики специальности 060110 «Лабораторная диагностика». Построено в соответствии современными педагогическими и методическими требованиями. Данное руководство обеспечит самостоятельность студентов в работе на практических занятиях по микробиологии и облегчит педагогический процесс. Для эффективного усвоения материала имеются вопросы и тестовые задания для студенческого самоконтроля. По каждому занятию указан объем выполняемой практической работы. Приведенные в работе алгоритмы, рисунки, схемы помогут систематизировать и закрепить знания студентов по данной теме.
В руководстве приводится микроскопический метод исследования микроорганизмов, который позволяет изучить тинкториальные и морфологические свойства микроба, степень чистоты выделенной культуры, расположение микроорганизмов в мазках, выявить структуры клетки – споры, капсулы, определить подвижность микроба, дифференцировать кислотоустойчивые бактерии. Все эти признаки необходимы для идентификации микроорганизма. С помощью этого метода можно подтвердить клинический диагноз инфекционных заболеваний.
Учебное пособие предназначено для использования во время практических занятий по микробиологии раздел «Морфология микроорганизмов», а также для самостоятельной работы студентов дома.
Рецензент: Глинская Е.В., к.б.н., доцент кафедры микробиологии и физиологии растений биологического факультета СГУ им. Н.Г.Чернышевского
Ответы на тестовые задания ………………………………………. 31
Лабораторные занятия проводятся в специально оборудованных помещениях, имеющих подводку электричества к каждому рабочему месту, а также раковину с водопроводной водой. Поверхность рабочих столов покрыта стеклом для лучшей дезинфекции. За каждым студентом закрепляется постоянное рабочее место, на котором должно быть оборудование, необходимое для выполнения конкретного задания, рабочая тетрадь, ручка и карандаш. Для личных вещей отводится специальное место.
В начале занятия студенты знакомятся с определенным заданием, изложенным в учебном пособии, делают записи основных методик в рабочей тетради, а затем приступают к выполнению работы под наблюдением преподавателя. Результаты исследований в виде рисунков, описаний морфологии микроорганизмов заносятся в тетрадь, и работа представляется преподавателю для проверки.
В связи с тем, что на практических занятиях студенты работают с живыми культурами микробов, анилиновыми красителями, химическими веществами, а также используют электрические приборы (лампы) и спиртовки, они обязаны выполнять основные правила техники безопасности (приложение №1,2).
Все задания студентами выполняются самостоятельно в соответствии с задачами, поставленными в учебном пособии.
Автор будет признателен за все замечания и предложения по содержанию включенного материала и совершенствованию методики обучения.
ВВЕДЕНИЕ В ПРАКТИКУМ
Объективы подразделяются на сухие и иммерсионные (погруженные). При работе с сухими объективами между фронтальной линзой и изучаемым объектом находится воздух. При этом, в виду разницы коэффициентов преломления предметного стекла и воздуха, часть световых лучей отклоняется и не попадает в объектив.
Объективы иммерсионные обозначают буквами О.И. и цифрами х90 и х100.
Современные микроскопы имеют ряд усовершенствований. Так, бинокулярный микроскоп с двумя тубусами дает возможность вести наблюдение одновременно обоими глазами.
Для изучения неокрашенных объектов используется фазово-контрастное устройство, с помощью которого можно получить четкое контрастное изображение прозрачных, не имеющих окраски микроорганизмов. При прохождении света через окрашенный препарат, изменяется интенсивность света (амплитуда световой волны), что легко улавливается глазом. При прохождении же пучка света через неокрашенный, прозрачный объект изменяется только скорость его движения, т.е. фаза колебаний светового луча, что глазом не улавливается. Принцип фазово-контрастного устройства заключается в переводе невидимых колебаний света в амплитудные видимые.
В ряде специальных исследований, в частности при изучении внутриклеточных структур микроорганизмов, используется люминесцентная микроскопия, основанная на способности некоторых объектов при специальном окрашивании флюорохромами светиться в коротковолновых лучах света (ультрафиолетовых, синих и др.). К флюорохромам относятся акридиновый желтый, пиронин, акридиновый оранжевый. Люминесцентная микроскопия проводится с обычным микроскопом, снабженным источником ультрафиолетовых лучей и набором светофильтров, выделяющих коротковолновую часть спектра.
Наиболее совершенными приборами, дающими возможность получать полезное увеличение объекта в 200-500 тыс. и более раз, являются электронные микроскопы, в которых вместо световых лучей используется поток электронов. С помощью электронных микроскопов удается рассмотреть белковые молекулы.
1 – окуляр, 2 – тубус,
4 – револьвер объективов,
5 – предметный столик,
7 – микровинт, 8 – макровинт
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №1
Простые и сложные методы окрашивания. Окраска препаратов по методу Грама. Способы приготовления красителей.
Студент должен знать:
— технику безопасности в кабинете (лаборатории) микробиологии (приложение №1),
— требования к помещению и оборудованию в лаборатории (приложение №2),
— характеристика «грязной» и «чистой» зоны лаборатории. Перечень комнат и их предназначение,
— требования к проведению работ в бактериологической лаборатории,
— спецпрофилактика сотрудникам лаборатории,
— этапы приготовления препарата, его фиксация: виды и цель,
— простые методы окрашивания,
— сложные методы, сущность метода Грама,
— особенности окраски по методу Грама, красители и реактивы,
— подготовка насыщенных, водных растворов и красителей.
Студент должен уметь:
— доставка патологического материала. Материал на патогенные биологические агенты (ПБА),
— прием материала в регистратуре,
— обработка отработанного материала и лабораторной посуды,
— поведение при «аварии» в лаборатории,
— приготовление бактериального препарата,
— окраска препарата по методу Грама,
-микроскопия окрашенных препаратов с использованием иммерсионной системы,
— соблюдение мер безопасной работы с живыми культурами микробов,
— обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы:
1. Подготовить препараты и окрасить их простым методом и по методу Грама
2. Препараты промикроскопировать с иммерсией
3. Обработать рабочие места и руки
4. Зарисовать результаты микроскопирования в дневник
Рецепты приготовления красителей
1. Карболовый фуксин Циля:
— насыщенного спиртового раствора основного фуксина – 10 мл
Внимание! Карболовую кислоту вливают в краситель, а не наоборот. Смесь встряхивают, фильтруют и сливают во флакон
2. Насыщенные спиртовые растворы (исходные):
Смесь помещают в термостат на несколько дней до полного растворения. Взбалтывают ежедневно, хранят с притертыми пробками
3. Фуксин Пфейффера:
— воды дистиллированной – 9 мл
Готовят непосредственно перед употреблением, т.к. раствор нестойкий.
4. Бумага по Синеву:
— 1%спиртовой раствор кристаллического фиолетового:
на 100 мл 96% спирта добавляют 1 гр сухого красителя и 3 мл глицерина
Полоски фильтровальной бумаги пропитывают раствором и высушивают.
СПОСОБ ГРАМА
1. На фиксированный мазок нанести генцианвиолет (бумага по Синеву) на 1-2 мин
2. Краску слить и нанести раствор Люголя на 1 мин
3. Раствор Люголя слить и на мазок нанести 96% спирт на 15-20 мин в зависимости от толщины мазка
4. Спирт смыть дистиллированной водой
5. Мазок дополнительно окрасить разведенным фуксином Пфейффера на 2-3 мин
6. Краситель смыть водой, препарат высушить, промикроскопировать с иммерсией
7. Микроскопия с иммерсией.
Генцианвиолет связывается с пептидогликаном клеточной стенки (рис. №2). Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет
Грамположительные (Гр+) бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные (Гр-) бактерии окрашиваются в красный цвет.
Рис. № 2. Грамотрицательные и грамположительные бактерии
| Грамположительные микроорганизмы |
 |
| Грамотрицательные микроорганизмы |
 |
Стрептококки Гр+
кокки, располагающиеся в виде цепочек
Streptococcus piogenes
Enterococcus faecalis
Стафилококки Гр+
кокки, располагающиеся в
Staphylococcus aureus
Staphylococcus epidermidis
Бактерии Гр-
палочковидные неспорообразующиие микроорганизмы
Esherichia coli
Salmonella typhi
Mycobacterium tuberculosis
Клостридии Гр+
палочковидные спорообразующие микроорганизмы. Диаметр спор больше поперечника клетки
Clostridium perfringens
Clostridium tetani
Clostridium botulinum
Вибрионы Гр-
Vibrio cholerae
Vibrio parahaemolyticus
ДИАГНОСТИКА ТУБЕРКУЛЕЗА
МЕТОД ЦИЛЯ-НИЛЬСЕНА
(ИНСТРУКЦИЯ 1999ГОД)
1. 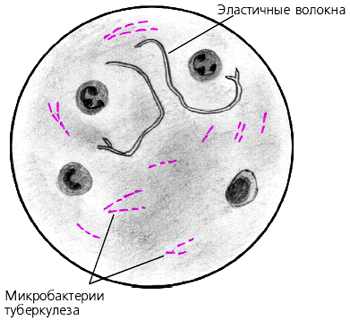
Рис. №4. Кислотоустойчивая микобактерия
МЕТОД ЦИЛЯ-НИЛЬСЕНА
1. На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза)
7. Микроскопия с иммерсией.
Кислотоустойчивые бактерии окрашиваются в красный цвет, остальные – в синий (рис. № 4,5).
Рис. № 5Mycobacterium tuberculosis в мокроте
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №3
Выявление капсул по методу Бурри, Бурри-Гинса.
Студент должен иметь представления:
— негативные методы окраски.
Студент должен знать:
— методы микробиологических исследований,
— виды микроскопии, их особенности,
— строение, состав и функции капсулы,
— капсулообразование как фактор патогенности,
— примеры капсульных микробов,
— особенности фиксации и окраски по методу Бурри и Бурри-Гинса, красители и реактивы,
— цель применения и сущность метода.
Студент должен уметь:
— выявление капсул у бактерий методом Бурри – Гинса,
-микроскопия окрашенных препаратов с использованием иммерсионной системы,
— соблюдение мер безопасной работы с живыми культурами микробов,
— обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы:
5. Подготовить препарат из культуры и окрасить его по методу Бурри-Гинса
6. Препараты, подготовленные и демонстрационные, промикроскопировать с иммерсией
7. Обработать рабочие места и руки
8. Зарисовать результаты микроскопирования и записать алгоритм метода в дневник
ОБНАРУЖЕНИЕ КАПСУЛ У БАКТЕРИЙ

Рис. №6. ПРИГОТОВЛЕНИЕ МАЗКА ДЛЯ ВЫЯВЛЕНИЯ КАПСУЛЫ
ОКРАСКА ПО МЕТОДУ ОЖЕШКО
1. На высушенный мазок (нефиксированный!) + несколько капель 0,5% НCl, держать над пламенем спиртовки до образования паров
2. Высушивают и фиксируют физическим способом
3. Окрашивают по методу Циля-Нильсена:
1) На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза)
4. Микроскопия с иммерсией
Метод Ожешко сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты в качестве протравы, разрыхляющей оболочку споры, которая плохо воспринимает красители.
Кислотоустойчивые споры окрашиваются в розово-красный, а бактериальная клетка в голубой цвет (рис. № 9).
Рис. №9. Споры у Bacillus subtilis
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5
Определение подвижности микроорганизмов
методами нативных препаратов.
Студент должен знать:
— строение, состав и значение жгутиков,
— классификация бактерий по расположению жгутиков,
— примеры жгутиковых микробов,
— факторы, влияющие на скорость движения микробов,
— методы определения подвижности микробов,
— особенности темнопольной микроскопии,
— принцип строения влажной камеры, ее предназначение,
— особенности культур, используемых в данных методах.
Студент должен уметь:
— техника микроскопии нативных неокрашенных препаратов в темном поле,
— выявление подвижности микроорганизмов,
— методика приготовления висячей капли,
— методика приготовления раздавленной капли,
— соблюдение мер безопасной работы с живыми культурами микробов,
— обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы:
13. Подготовить препараты висячая и раздавленная капли из культуры, выращенной на жидкой питательной среде
14. Препараты бактериоскопировать в темнопольной микроскопии
15. Обработать рабочие места и руки
16. Записать результаты микроскопирования и алгоритмы методов в дневник
МЕТОД РАЗДАВЛЕННОЙ КАПЛИ
1. На предметное стекло наносят пипеткой или петлей каплю культуры и покрывают ее покровным стеклом. !Чтобы не образовалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его
2. Для предохранения от высыхания препарат помещают во влажную камеру
3. Микроскопируют в темном поле при увеличении объектива 40Х
Препарат можно поместить во влажную камеру для предохранения от высыхания
МЕТОД ВИСЯЧЕЙ КАПЛИ
1. 
2. На покровное стекло наносят каплю культуры и осторожно накрывают покровное стекло стеклом с лункой так, чтобы капля оказалась в центре
3. Склеившиеся стекла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время
Микроскопия сначала при увеличении 8Х. Находят край капли, а затем переводят на большое увеличение 40Х (рис. № 11).
Рис. №10. Техника приготовления препарата висячая капля
| Рис. №11. Лептоспира в темном поле |
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №6
Зачетное занятие с замером навыков по теме:
Перечень манипуляций к зачету:
— подготовить препарат и окрасить его по методу Грама. Значение метода
— подготовить препарат и окрасить его по методу Ожешко. Значение метода
— подготовить препарат и окрасить его по методу Бурри-Гинса. Значение метода
— подготовить препарат, окрасив его по методу Циля-Нильсена (1999г). Значение метода
— подготовить препарат висячая капля, значение методики
— подготовить препарат раздавленная капля, значение методики
— промикроскопировать готовые препараты, окрашенные различными методами: по Граму, Ожешко, Бурри-Гинсу, Циля-Нильсену.
— назовите основные формы бактериальных клеток,
-перечислите основные и дополнительные структуры прокариотической клетки, их функции,
— укажите состав и строение жгутиков, группы бактерий по расположению жгутиков,
— назовите строение и функции нуклеоида у прокариот,
— укажите, что собой представляет спора и ее значение для бактерий, расположение спор в клетке (примеры микробов).
Тестовые задания для самоконтроля
1. Расставьте этапы приготовления препарата в нужном порядке:
в) приготовление мазка
2. Укажите соответствие между возбудителем и методом его окраски:
1) стафилококк а) по Граму
4) бацилла сибирской язвы г) Ожешко
3. Простой метод окраски:
б) метиленовым синим
4. Хранителем наследственной информации у прокариот является:
5. Окраска по методу Бурри отличается от метода Бурри-Гинса:
а) по времени окрашивания
б) отсутствия фуксина Пфейффера
в) разные разведения туши
г) мазок фиксируется в пламени горелки
6. При окраске препарата методом Циля-Нильсена (инструкция 1999г.) используется:
7. К спорообразованию способны:
г) кишечная палочка
8. В методике окраски по Бурри-Гинсу используется черная тушь, разведенная в
9. Укажите соответствие:
Метод окраски: Цель метода:
1. метод Ожешко а) обнаружение капсулы
2. метод Бурри б) определение кислотоустойчивости
3. метод Циля-Нильсена в) отношение к Граму
4. метод Грама г) определение споры
10. При изучении подвижности используется микроскопия:
а) фазово-контрастная
12. При окраске по Граму используется следующий краситель:
б) метиленовый синий
в) бриллиантовый зеленый
г) генциановый фиолетовый
13. Спору у бактерий можно выявить, окрасив препарат:
а) метиленовым синим
15. Укажите соответствие:
Вид микроскопии: Цель применения:
1) Световая обычная микроскопия а) для изучения живых неокрашенных
2)Фазово-контрастная микроскопия б) для изучения окрашенных препаратов
а) по всей поверхности
в) пучок на одном из концов
г) один жгутик на конце клетки
1) физический а) пламя горелки, б) смесь Никифорова,
2) химический в) ацетон, г) спирт
18. Предметное стекло с лункой используется:
а) в методе Циля-Нильсена
б) изучение подвижности
в) изучения на наличие капсулы
г) при обнаружении споры
19. Дополнительной структурой бактерий является:
20. Препарат из нативного материала готовится при окраске:
21. Бактерии штопорообразной формы называют:
22. Негативные методы окраски используются при методе:
23. В состав клеточной стенки бактерий входит: