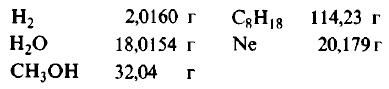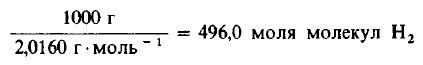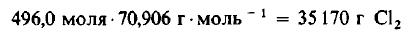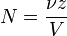Что измеряется в молях
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
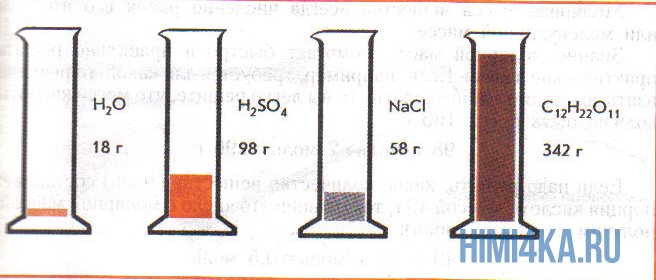
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Что измеряется в молях
Моль принят в качестве единицы СИ XIV Генеральной конференцией по мерам и весам в 1971 году. Точное определение моля формулируется так [2] :
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Из определения моля непосредственно следует, что молярная масса углерода-12 равна 12 г/моль точно.
1/12 массы атома углерода-12 называют атомной единицей массы (обозначение а. е. м.). Отсюда следует, что 1 а. е. м. = 0,001/ NA кг.
Из определения а. е. м. вытекает, что молярная масса вещества, выраженная в граммах на моль, численно равна массе молекулы этого вещества, выраженной в атомных единицах массы.
Кратные и дольные единицы
Десятичные кратные и дольные единицы образуют с помощью стандартных приставок СИ. Причём, единица измерения йоктомоль может использоваться лишь формально, так как столь малые количества вещества должны измеряться отдельными частицами (1 имоль формально равен 0,602 частицы).
| Кратные | Дольные | ||||||
|---|---|---|---|---|---|---|---|
| величина | название | обозначение | величина | название | обозначение | ||
| 10 1 моль | декамоль | дамоль | damol | 10 −1 моль | децимоль | дмоль | dmol |
| 10 2 моль | гектомоль | гмоль | hmol | 10 −2 моль | сантимоль | смоль | cmol |
| 10 3 моль | киломоль | кмоль | kmol | 10 −3 моль | миллимоль | ммоль | mmol |
| 10 6 моль | мегамоль | Ммоль | Mmol | 10 −6 моль | микромоль | мкмоль | µmol |
| 10 9 моль | гигамоль | Гмоль | Gmol | 10 −9 моль | наномоль | нмоль | nmol |
| 10 12 моль | терамоль | Тмоль | Tmol | 10 −12 моль | пикомоль | пмоль | pmol |
| 10 15 моль | петамоль | Пмоль | Pmol | 10 −15 моль | фемтомоль | фмоль | fmol |
| 10 18 моль | эксамоль | Эмоль | Emol | 10 −18 моль | аттомоль | амоль | amol |
| 10 21 моль | зеттамоль | Змоль | Zmol | 10 −21 моль | зептомоль | змоль | zmol |
| 10 24 моль | йоттамоль | Имоль | Ymol | 10 −24 моль | йоктомоль | имоль | ymol |
| применять не рекомендуется | |||||||
См. также
Примечания
Полезное
Смотреть что такое «Моль» в других словарях:
МОЛЬ — жен. тля (от малый) крошечный сумеречник (бабочка), метличка; гусеничка его, которая точит меха и шерстяную одежу, Tinca. Есть моль шубная, платяная, сырная, хлебная, овощная. Моль пропадает от хмелю, камфары. | Моль овощная, тля, мотылица,… … Толковый словарь Даля
МОЛЬ — жен. тля (от малый) крошечный сумеречник (бабочка), метличка; гусеничка его, которая точит меха и шерстяную одежу, Tinca. Есть моль шубная, платяная, сырная, хлебная, овощная. Моль пропадает от хмелю, камфары. | Моль овощная, тля, мотылица,… … Толковый словарь Даля
моль — 1. МОЛЬ, и; ж. Небольшая бабочка, гусеница которой является вредителем шерстяных вещей, хлебных зёрен и растений. 2. МОЛЬ, и; ж.; МОЛЬ, я; м. Спец. Лес, сплавляемый по реке брёвнами, не связанными в плот. По реке плыла м. Пробираться на лодке… … Энциклопедический словарь
МОЛЬ — единица количества вещества в СИ, определяемая как количество вещества, содержащее столько же формульных (структурных) единиц этого вещества (атомов, молекул, ионов, электронов и др.), сколько содержится атомов в 12 г изотопа углерода 12 (12С);… … Большая политехническая энциклопедия
моль — источено молью.. Словарь русских синонимов и сходных по смыслу выражений. под. ред. Н. Абрамова, М.: Русские словари, 1999. моль тля, мотылица Словарь русских синонимов … Словарь синонимов
МОЛЬ — 1) название пива в Нимвегене. 2) шерстяная материя. 3) у пчеловодов: сплетение вверху улья. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. моль 1 ит. molle мягкий) муз. то же, что минор 1 (противоп. дур). 2… … Словарь иностранных слов русского языка
моль — Ед. кол ва вещ ва, т.е. величины, оценив. кол вом содерж. в физич. системе тождест. структур, элементов (атомов, молекул, ионов и др. частиц или их специфич. групп), м. равен кол ву вещ ва системы, содерж. столько же структурных элементов… … Справочник технического переводчика
МОЛЬ — • МОЛЬ (Mohl) Хуго фон (1805 1872), немецкий ботаник, пионер в исследовании анатомии и физиологии КЛЕТОК растений. Сформулировал гипотезу о том, что ядро клетки окружено гранулированным коллоидным веществом, которое в 1846 г. он назвал… … Научно-технический энциклопедический словарь
моль — МОЛЬ, и, жен. Маленькая бабочка, гусеница к рой является вредителем меха, шерсти, хлебных зёрен, растений. Молью изъедено (также перен.: о чём н. явно устарелом, отжившем; неод.). | прил. молевый, ая, ое. II. МОЛЬ, я, муж. (спец.). Сплав леса… … Толковый словарь Ожегова
МОЛЬ — (моль, mol), ед. СИ кол ва в ва. В 1 М. содержится столько молекул (атомов, ионов или к. л. др. структурных элементов в ва), сколько атомов содержится в 0,012 кг 12С (нуклида углерода атомной массой 12), (см. АВОГАДРО ПОСТОЯННАЯ). Физический… … Физическая энциклопедия
-моль — МОЛЬ, в знач. неизм. прил. (муз.). То же, что мольный. Соната а моль. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Урок 15. Моляльность и молярность
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Растворитель и растворенное вещество
Расчет концентрации раствора
Молярная концентрация
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
Число молей растворенного сульфата аммония равно:
Завершающий шаг! Молярность раствора равна:
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Число молей уксусной кислоты в 5 г равно:
Масса 1 л этанола равна:
Последний этап. Найдем моляльность полученного раствора:
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
где с 1 и V 1 — молярная концентрация и объем раствора до разбавления, с 2 и V 2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Моляльность
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это соотношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора) правильно называть долями. Однако на практике для обоих видов выражения состава применяют термин концентрация и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Содержание
Массовая доля (также называют процентной концентрацией)
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
Массовое процентное содержание компонента, m%
В бинарных растворах часто существует однозначная зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в аккумуляторных) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров.
Молярность (молярная объёмная концентрация)
Моляльность (молярная весовая концентрация)
Моляльность — число молей растворённого вещества в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-моляльным.
Нормальная концентрация (мольная концентрация эквивалента)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль/л, называют децинормальным и записывают как 0,1 н.
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата KHSO4, и двухнормальным в реакции с образованием K2SO4.
Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
Другие способы выражения концентрации растворов
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, т.к. при этом изменяется плотность растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т.п.
Формулы перехода от одних выражений концентраций растворов к другим
Наиболее распространённые единицы
| Измеряемая величина | Запись | Формула | Типичная единица |
|---|---|---|---|
| Атомный процент (A) | at.% | 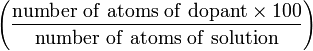 | % |
| Атомный процент (B) | at.% | 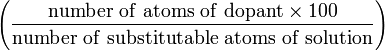 | % |
| Массовый процент | wt% | 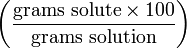 | % |
| Mass-volume percentage | — | 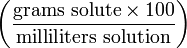 | % though strictly %g/mL |
| Volume-volume percentage | — | 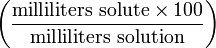 | % |
| Молярность | M | 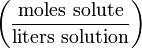 | mol/L (or M or mol/dm 3 ) |
| Molinity | — | 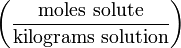 | mol/kg |
| Моляльность | m | 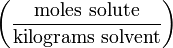 | mol/kg (or m**) |
| Мольная доля | Χ (chi) | 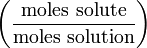 | (decimal) |
| Formal | F | 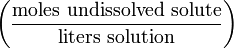 | mol/L (or F) |
| Нормальность | N | 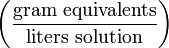 | N |
| Частей на сто (Parts per hundred) | % (or pph) | 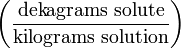 | da.g/kg |
| Частей на тысячу (Parts per thousand) | ‰ (or ppt*) | 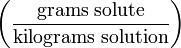 | g/kg |
| Частей на миллион | ppm | 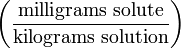 | mg/kg |
| Частей на миллиард (Parts per billion) | ppb | 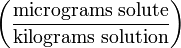 | µg/kg |
| Parts per trillion | ppt* | 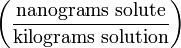 | ng/kg |
| Parts per quadrillion | ppq | 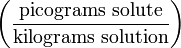 | pg/kg |
Полезное
Смотреть что такое «Моляльность» в других словарях:
моляльность — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN molality … Справочник технического переводчика
моляльность — – число молей компонента раствора, приходящегося на 1 кг растворителя. Словарь по аналитической химии [3] … Химические термины
моляльность — моляльная концентрация; моляльность Концентрация, выраженная числом молей растворенного вещества, приходящихся на 1 кг растворителя … Политехнический терминологический толковый словарь
моляльность — molialumas statusas T sritis Standartizacija ir metrologija apibrėžtis Ištirpusios medžiagos molekulių molių skaičius 1 kg tirpiklio. atitikmenys: angl. molality; molar concentration vok. Kilogramm Molalität, f; molale Konzentration, f; Molalität … Penkiakalbis aiškinamasis metrologijos terminų žodynas
моляльность — molialumas statusas T sritis chemija apibrėžtis Ištirpusios medžiagos molių kiekis 1 kg tirpiklio. atitikmenys: angl. molal concentration; molality rus. моляльная концентрация; моляльность ryšiai: sinonimas – molialinė koncentracija … Chemijos terminų aiškinamasis žodynas
моляльность — molialumas statusas T sritis fizika atitikmenys: angl. molal concentration; molality vok. Kilogramm Molalität, f; molale Konzentration, f; Molalität, f rus. моляльная концентрация, f; моляльность, f pranc. concentration molale, f; molalité, f … Fizikos terminų žodynas
Моляльность — раствора, концентрация раствора, выраженная числом молей (грамм молекул (См. Грамм молекула)) растворённого вещества, содержащегося в 1000 г растворителя; см. также Концентрация (в химии) … Большая советская энциклопедия
МОЛЯЛЬНОСТЬ — см. Концентрация … Химическая энциклопедия
моляльность — моляльная концентрация … Cловарь химических синонимов I
МОЛЯЛЬНОСТЬ РАСТВОРА — концентрация раствора, выраженная числом (см.) растворённого вещества, содержащегося в 1 кг растворителя (не следует смешивать с молярностью (см.)). Моляльная концентрация в СИ выражается числом молей растворённого вещества в 1 м3 растворителя… … Большая политехническая энциклопедия