Гуморальный иммунитет при коронавирусе что это
Гуморальный иммунитет после прививки против коронавируса сохраняется до двух лет, а клеточный – более долгосрочный
Вакцина уполномочена защитить
 Анжела ГАЛЕНЧИК. Анжела ГАЛЕНЧИК. |  Ольга ФЕСЬКО. Ольга ФЕСЬКО. |
Собираюсь делать прививку на следующей неделе. Как к ней правильно подготовиться и какие ограничения после введения?
— До и после процедуры в течение 3—5 дней исключить употребление алкоголя, интенсивные физические нагрузки. По питанию запретов нет. Что касается спиртных напитков, после вакцинации нельзя злоупотреблять в течение 21 дня. С терапевтом надо оговорить наличие острых заболеваний, обострение хронических, аллергических реакций в анамнезе. При наличии вышеуказанных состояний прививку делают через 2–4 недели после выздоровления или ремиссии.
На днях мне дети привезли памятку по вакцинации, изучаю. Такой вопрос: должен ли при проведении выездной кампании вместе с медсестрой находиться врач? Ведь при защите от гриппа этого не требуется.
Янина Иосифовна, Солигорский район
— В любом случае, прививаетесь вы в поликлинике или на предприятии, куда прибыла выездная бригада, присутствие врача обязательно. Так как процедуру назначает именно врач после опроса пациента, медосмотра и изучения анамнеза.
Пять месяцев назад я переболела коронавирусом, сейчас задумываюсь о вакцинации, но беспокоюсь вот по какому поводу: надо ли проверять наличие антител? И если они есть, стоит ли прививаться?
Юлия Высоцкая, Столбцы
— По рекомендациям Минздрава, вакцинация может быть сделана через 3–6 месяцев после выздоровления. Сдавать кровь на наличие антигена или антител к коронавирусу нецелесообразно, так как присутствие антител у переболевших не гарантирует защиту от повторного заражения уже через 3–6 месяцев после перенесенной инфекции. Поэтому прививка показана и данной категории людей.
Но если к имеющимся в организме иммуноглобулинам добавятся прививочные, не может ли это навредить?
— Нет, у большинства переболевших защитные антитела сохраняются максимум в течение трех месяцев и не могут нанести вред в сочетании с прививочными. Даже если определенное количество иммуноглобулинов обнаружено до прививки — лучше защититься, ведь поствакцинальный иммунитет гораздо сильнее, чем после заболевания, и сохраняется, по некоторым данным, до двух лет.
Мне 65 лет, и я полиаллергик. Сейчас обострилась аллергия на цветение берез, к тому же раньше на прием антибиотиков перенесла отек Квинке. У мужа тоже проблемы со здоровьем — псориаз. Можно ли нам прививаться?
Надежда Алексеевна, Минский район
— В каждом конкретном случае решение должен принимать лечащий врач, только он детально знает особенности диагноза своего пациента. Поскольку аллергия у вас проявляется периодически в течение всей жизни, скорее всего, стоит выждать некоторое время, чтобы ее исключить. При перенесенном отеке Квинке, анафилактическом шоке, тяжелых аллергических реакциях или аутоиммунных заболеваниях, к которым относится псориаз, вакцинация применяется с осторожностью. Надо взвесить все за и против, оценить пользу и риски, возможно, пройти лабораторное и/или диагностическое исследование. К слову, по рискам заражения и тяжелой переносимости коронавируса вы и супруг в силу возраста попадаете в уязвимую группу.
У моего взрослого сына аллергия на укус пчел и ос, даже лежал в реанимации. Не противопоказана ли ему прививка?
Марина Сергеевна, Пуховичи
— Нет, потому что компоненты, которые содержатся в вакцине, отличны от вещества, вызывающего аллергию у вашего сына, однако этот вопрос желательно проработать с врачом-терапевтом по месту медицинского обслуживания.
Подскажите, чем различаются китайская и российская вакцины, какую лучше выбрать и защищают ли они от разных штаммов, которые образуются вследствие мутации?
Дмитрий Васильев, Могилев
— Если простыми словами, китайский препарат создан на основе инактивированного (убитого) целого вируса, это классический тип вакцин. «Спутник V» разработан на основе двух векторов — аденовирусов. В них «вставляют» кусочек РНК с информацией о белке коронавируса (S-белке), с которым необходимо познакомиться иммунной системе, чтобы выработать защитные антитела. То есть аденовирус выступает в качестве «транспортного средства», к которому «прицеплен» S-белок — безопасный для человека, но при этом способен сформировать антительный (гуморальный) и клеточный иммунный ответы. Делаем вывод: один и другой препараты испытаны, зарегистрированы, надежны.
У знакомой после укола первым компонентом поднялась температура, после второго — болели ноги. Чем лучше привиться, чтобы избежать побочки?
Валентина, Смолевичи
— Эти побочные реакции прописаны в общей характеристике «Спутника», поэтому ожидаемы и проходят без последствий в течение трех дней. Китайская вакцина в этом плане наиболее щадящая. На такой же платформе, где взят за основу инактивированный (убитый) вирус, разрабатывается и белорусская.
А что же векторный «Спутник V» — не белорусская вакцина?
— Нет, «Спутник» произведен в нашей стране по трансферу российских технологий, и его действующее вещество идентично российскому препарату. Каждая партия, изготовленная на предприятии «Белмедпрепараты», проходит контроль качества в институте-разработчике имени Гамалеи при безусловном соблюдении всех необходимых условий транспортировки и хранения. Вакцина белорусской разработки в процессе создания.
Работаю учителем, но прививаться пока не решила. Хочу узнать, есть ли в настоящее время список профессий, при которых обязательно вакцинирование? Или работодатели не имеют права настаивать?
Ольга Петрова, Солигорск
— Согласно Национальному плану мероприятий по вакцинации против инфекции COVID-19 на 2021–2022 годы, утвержденному заместителем Премьер-министра, на первом этапе прививались медицинские и фармацевтические сотрудники, работники социальных учреждений, а также учреждений с круглосуточным режимом пребывания и сферы образования. Потому что эти категории из-за большого количества социальных контактов подвержены заражению коронавирусной инфекцией в большей степени. Но в любом случае профилактическая кампания проходит на добровольной основе, руководитель не имеет права заставлять подчиненных. Другое дело — он может заботиться об их здоровье и порекомендовать, объяснить надобность и безопасность вакцинации, пригласив для этого компетентных специалистов. Как работнику учреждения образования, я бы советовала вам, исключив факторы острых и обострения хронических заболеваний, привиться.
Болит зуб мудрости. Это же не противопоказание?
— Нет. Можете не тревожиться.
Беспокоюсь по такому поводу: 14 дней назад мне ввели первый компонент, все было нормально. А теперь стало болеть горло, небольшая температура. Просквозило, подхватила ОРИ и боюсь, что через 21 день получить второй компонент не удастся. Можно ли это сделать позже? Или будет неэффективно?
Елена Пахирко, Светлогорск
— Обратитесь для осмотра и за консультацией к участковому терапевту по месту жительства, скорее всего, вам положен больничный лист. О втором компоненте не беспокойтесь, получите его через 2—4 недели после выздоровления. К слову, это минимальный интервал, а максимальный не регламентирован. Поэтому можно и позже, эффект не потеряется, но второй компонент обязательно стоит ввести, чтобы усилить защитное действие.
А если человек заболеет коронавирусной инфекцией, нужно ли получать вторую дозу?
— Нужно, но не раньше чем через 6 месяцев после перенесенной инфекции.
Мне за 70 лет, периодически скачет давление, посоветуете ли прививаться в таком случае?
Василий Томнич, Столинский район
— Конечно, потому что вы находитесь в группе риска. Обратитесь к участковому врачу-терапевту по месту жительства, и при отсутствии противопоказаний вам сделают прививку.
Надо ли носить маску после вакцинации? И может ли привитый быть распространителем вируса?
Ольга, по электронной почте
— Сразу уточню: конкретно после вакцинации заразиться COVID-19 нельзя, потому что вирус в составе российского и китайского препаратов неживой. Однако любая вакцина не гарантирует 100-процентного избежания дальнейшего заболевания, меж тем с высокой вероятностью избавит от его тяжелых форм. Как и в случае с гриппом. Соответственно, если человек теоретически может заболеть, то и быть распространителем способен, пусть и бессимптомным. Поэтому, пока не защитится 75 процентов взрослых людей и 60 процентов от общей численности населения, мы не сможем снять защитные повязки или ограничить другие меры безопасности. В соответствии с Национальным планом мероприятий по вакцинации против инфекции COVID-19 на 2021–2022 годы, это количество необходимо вакцинировать как в каждом регионе, так и в Беларуси в целом.
Надо ли для прививки в поликлинике иметь территориальное закрепление за ней?
Владимир, по электронной почте
— В первую очередь следует прививаться в поликлинике по месту жительства или медобслуживания. Вы вправе обратиться и в другое медучреждение, но, согласно Национальному плану мероприятий по вакцинации против инфекции COVID-19 на 2021–2022 годы, профилактическая кампания проводится поэтапно. На данный момент защищаются в первую очередь люди с хроническими заболеваниями и лица старше 60 лет. Поэтому в зависимости от количества вакцины, если вы не подпадаете под эту категорию, с прививкой в другой поликлинике могут повременить. Еще один аргумент, почему стоит обращаться в медучреждение по месту жительства или медобслуживания: именно там находится ваша амбулаторная карта, что особенно пригодится для уточнения медицинского анамнеза и принятия решения о возможности привиться.
Что делать, если после укола поднялась высокая температура?
Варвара, по электронной почте
— В течение первых-вторых суток она может достигнуть 38 градусов и выше, включая озноб и общее недомогание. Состояние улучшается в течение трех последующих дней, для его стабилизации рекомендуется принимать нестероидные противовоспалительные средства. И ни в коем случае из-за плохого самочувствия не тревожьтесь. О том, что могут возникнуть нежелательные реакции после процедуры, вам сообщает врач, а также выдает памятку.
Надо ли после прививки проверять наличие антител, и если да, то отличается ли система их определения после перенесенного заболевания?
Максим, по электронной почте
— Обязательной надобности в этом нет, но при желании можно провести качественный (на наличие антител) и количественный (на количество антител) анализ. После вакцинации вырабатывается гуморальный (антитела) и клеточный (антигены уничтожаются Т-лимфоцитами) иммунитеты. Исследования показывают, что большинство людей, перенесших в самом начале 2000-х коронавирус разновидности Sars, до сих пор имеют к нему специфические Т-клетки. И если вдруг гуморальный иммунитет формируется медленно, то отреагирует клеточный. Насчет систем определения антител, действительно есть специальные тесты для оценки поствакцинального иммунитета, и по желанию для большей осведомленности о своем здоровье их можно использовать.
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
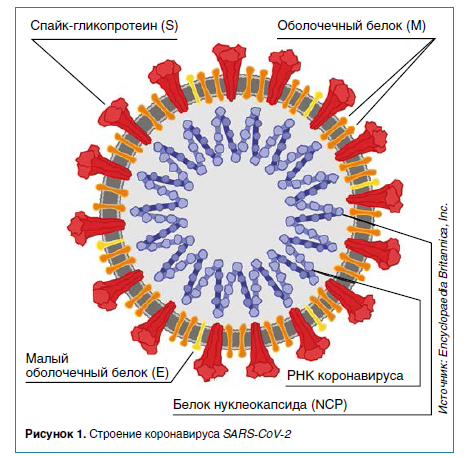
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Иммунный ответ в контексте коронавируса SARS-CoV-2
Сильный иммунитет, слабый иммунитет, риски тяжёлой формы болезни COVID-19.
Люди по всему миру болеют новой коронавирусной инфекцией. Одни переносят легко, другие тяжело, с угрозой для жизни — какие тут факторы важны и какова роль иммунитета? Есть накапливающаяся статистика: все уже запомнили, что риски тяжёлого течения COVID-19 сильно растут с возрастом пациента, значительно выше для мужчин, чем для женщин, выше для людей с астмой, заболеваниями сердца и почек, для тех, кто принимает сартаны (распространённое лекарство для лечения артериальной гипертензии) и т.д. Но эти разрозненные факты не особо помогают понять патогенез, т.е. как развивается болезнь, и выделить важные факторы выздоровления или наоборот, проявления тяжёлой формы COVID-19.
Есть основания полагать, что большинство смертей от коронавируса связаны с чрезмерной и разрушительной реакцией иммунной системы, а не с прямыми повреждениями, которые организму наносит размножающийся вирус.
Как определить риск такой реакции, и что, собственно, происходит с иммунитетом?
Иммунная реакция на вирус отличается у разных людей уже с первых часов заражения, она зависит и от наследственных факторов, факторов среды (например, загрязнённый городской воздух) и от привычек (например, курения или занятий спортом), влияющих на состояние иммунитета слизистых оболочек дыхательных путей. У кого-то быстро вырабатываются интерфероны — первые сигналы для организма о необходимости противовирусной защиты. В идеальной ситуации сигнал интерферонов I типа приводит к тому, что эпителий сам защищается от репликации вируса, и вдобавок иммунные клетки приходят и уничтожают заражённые клетки, которых на первой стадии немного. Если выработка интерферонов происходит с задержкой, вирус успевает размножиться, и для борьбы с ним требуется больше активирующих сигналов иммунитету, воспаление развивается интенсивнее/стремительнее, что приводит к — бóльшему повреждению ткани (эпителия альвеол лёгких).
У вируса Эболы, например, есть белок VP35, ответственный за подавление выработки интерферона, поэтому Эбола сразу переходит на второй тип динамики вирусного иммунного ответа. Из других респираторных вирусов пандемический штамм гриппа 1918 года тоже отличался нехарактерным для большинства сезонных штаммов гриппа эффективным подавлением продукции интерферонов I типа и параллельно повышал, как считается, уровень воспалительных сигналов (цитокинов) в системном кровотоке, что приводило к тяжёлому устойчивому воспалению ткани лёгких.
Параллельно и чуть позже выработки интерферонов, происходит реакция клеток врождённого иммунитета [1], в первую очередь, нейтрофилов и макрофагов. Цели этой фазы иммунного ответа (будем считать второй фазой после интерферонов): заблокировать синтез вирусных белков, распознать вирус, слепить/связать в удобные для транспортировки комки, доставить в лимфоузлы, а также позвать побольше клеток иммунитета в зону «военных действий» — первую локацию инфекции в организме. После этого в ближайших лимфоузлах при распознавании вирусных белков начинается фаза ответа адаптивного иммунитета, специфичного для конкретного вируса. Цели этой, третьей, фазы:
Реакция адаптивного иммунитета точнее и безопаснее, на этой фазе организм стремится уменьшить мощности врождённого иммунитета и быстро ответить с помощью адаптивных иммунных клеток. Если нашлись специфичные к вирусу Т-клетки и В-клетки (способные узнать белковые фрагменты вируса своими Т- и В-клеточными рецепторами), они получают лицензию на работу и размножение, это значит, что в организме формируется клон клеток — множество одинаковых специфичных к вирусу клеток. Из этого множества одинаковых потомков часть клеток скорее всего выживет и сформирует иммунную память, чтобы повторно человек не заразился.
Самая важная часть противовирусного адаптивного иммунного ответа — это специфичные Т-киллеры (CD8+ Т-клетки), которые уничтожают заражённые клетки респираторного/кишечного эпителия. При этом тоже повреждается ткань альвеол, но иначе мы не можем избавиться от вируса, уютно и спокойно размножающегося внутри наших клеток. Т-клеточный иммунный ответ на новые инфекции сильно ослабляется с возрастом, особенно после 60 лет. Специфичную Т-клетку к совершенно новой инфекции сложно подобрать, скорее всего, у пожилого пациента в организме вообще нет таких подходящих клеток: почти все Т-клетки представляют собой клоны иммунной памяти на старые прошедшие инфекции, а тимус (вилочковая железа) уже не производит новые Т-клетки [2].
Что делать иммунитету, если не хватает подходящих Т-клеток?
Важны ли антитела [3], которые производят В-клетки, начиная со второй недели инфекции?
Очень многие эксперты сейчас говорят и пишут, что как только ваш организм начинает вырабатывать нейтрализующие коронавирус антитела, вы точно выздоровеете, это дело времени. Это не совсем так. Кроме того, что можно не успеть обогнать вирус, сейчас всё больше данных говорит о том, что антитела усиливают повреждение лёгких и ускоряют кровоизлияние в них, от которого человек погибает. Например, здесь показано, что титр (концентрация, уровень в плазме крови) IgG-антител скоррелирован с возрастом, тяжёлыми симптомами и лимфопенией (снижением количества клеток адаптивного иммунитета). Это же показывает и модель, в которой макак заражали предыдущим вирусом SARS (высокий титр эффективных нейтрализующих антител IgG к spike-белку оболочки коронавируса коррелировал с сильным повреждением ткани лёгких). Почему так происходит, что от антител ухудшается течение COVID-19, интуитивно же должно же быть наоборот?
Дело в том, что кроме последовательности
врождённый иммунитет → доставка вируса или его обломков в лимфоузел → подбор, поиск и активация адаптивного иммунитета
Как же тогда сработают терапевтические антитела к коронавирусу?
Возможно, при производстве терапевтических антител подойдёт применяющийся сейчас подход с оптимизацией по максимальной прочности связывания антител с вирусом. При этом может возникнуть необходимость поменять изотип гуманизованных антител, например, с IgG1 на IgG4, т.к. IgG4 будут мешать вирусу проникать в клетку, но не будут активировать макрофаги. Возможно, подход к подбору терапевтических антител придётся поменять и это вообще будет антитело не на spike-гликопротен вируса, а на другой антиген. Относительно лечения пациентов с COVID-19 сывороткой, полученной от переболевших этим заболеванием людей, что-то определённое сказать сложно, т.к. подобный препарат будет содержать смесь антител с разными свойствами и функциями, и прогнозировать результат терапии на современном этапе весьма затруднительно. Об этом проще будет говорить по результатам, которые мы увидим в течение следующих двух-трёх месяцев.
Есть ли у SARS-CoV-2 особенные механизмы подавления иммунитета, неправильной активации иммунитета?
За последние недели я видела довольно много противоречивых данных о лимфопении (снижении количества клеток адаптивного иммунитета) у пациентов COVID-19. Пока непонятно, это все клетки ушли на войну в лёгкие/кишечник и поэтому снижена численность в крови? Или иммунные клетки активно погибают? Вопрос остаётся открытым, но и не все исследования подтверждают этот факт. В некоторых когортах не было разницы по общей численности лимфоидных клеток между пациентами с лёгким и тяжёлым протеканием болезни, то есть лимфопения под вопросом.
Кажется, есть возможность для более сложной регуляции работы В-клеток и выработки антител, но это на данный момент не до конца изучено. В геноме SARS-CoV-2 (у первого SARS такого не было) есть участок, комплементарный продукту гена BLNK, который важен для развития В-лимфоцитов. Теоретически, коронавирус может с помощью этой РНК влиять на дифференцировку новых наивных В-клеток и в селекции активированных В-клеток, пока идёт отбор оптимальных антител, тем самым меняя адаптивный иммунный ответ.
Прививка BCG: проще ли протекает COVID-19 у вакцинированных?
Сейчас есть только нечёткие эпидемиологические данные, и понимание молекулярных механизмов появится нескоро. В целом известно, что БЦЖ снижает частоту тяжёлых осложнений не только в случае туберкулёза, а при различных респираторных инфекциях (особенно если вакцинируют в юном возрасте, по-видимому). Этот положительный эффект обусловлен не специфичным адаптивным иммунитетом, а зависит от феномена «тренированного врождённого иммунитета» и работы иммунных клеток, занимающих промежуточное положение между врождённым и адаптивным иммунитетом. Другими словами, выигрыш, заключающийся в уменьшении частоты осложнений, объясняется через «тренированное» состояние иммунных клеток, живущих в респираторном эпителии. Если преимущество вакцинации БЦЖ подтвердится и для нового коронавируса, то это не будет чем-то удивительным.
P.S. Пруфы по каждому предложению, на чём я основываюсь, и ссылки, где почитать дальше — по запросу, спрашивайте. Про терапию рекомендую читать тут: http://spid.center/ru/articles/2678/. Для вдохновения и мысленных споров использовала https://elemental.medium.com/this-is-how-your-immune-system-reacts-to-coronavirus-cbf5271e530e и свою вирусологическо-иммунологическую ленту твиттера, например, https://twitter.com/VirusesImmunity/status/1243997325804142593.
Что почитать про упомянутые механизмы иммунитета
Материал подготовлен по заказу и при участии канала «Рационально о коронавирусе».