Что значит титрация дозы
Что значит титрация дозы
Цели лекарственной терапии должны быть установлены до начала лечения. Они могут состоять из экстренной корректировки серьезного патофизиологического процесса, облегчения острых либо хронических симптомов или изменения суррогатных конечных точек (АД, ХС плазмы или MHO), что связано с предпочтительными исходами в заданной популяции.
Уроки CAST и применения инотропных препаратов должны заставить врачей относиться скептически к терапии, направленной на суррогатные конечные точки при отсутствии контролируемых клинических исследований.
Когда целью лечения является экстренная корректировка физиологических нарушений, препарат следует вводить в/в в дозах, подобранных для достижения быстрого терапевтического эффекта. Такой подход целесообразен, когда польза превосходит риск. Как было сказано ранее о лилокаине, большие дозы препарата, вводимые в/в, несут риск усиления лекарственной токсичности, поэтому даже в случае самого экстренного назначения препарата этот подход не будет правильным. Исключением является аденозин, который следует вводить быстро болюспо, т.к. он за короткое время и повсеместно элиминируется из плазмы, его захватывают практически все клетки, поэтому медленное введение или инфузия редко позволяют достичь необходимых высоких концентраций в области воздействия (например, коронарной артерии, кровоснабжающей атриовентрикулярный узел, для купирования аритмии).
Время, необходимое для достижения равновесной концентрации в плазме, определяется периодом полувыведения. Введение ударной дозы может сократить это время, но только в случаях, если кинетика распределения и выведения известна изначально и выбран правильный режим насыщения, иначе возможен избыток или недостаток введения во время фазы насыщения, Таким образом, начало терапии с использованием стратегии насыщения возможно только в случае экстренного назначения.
Кривые доза-ответ отражают взаимосвязь дозы препарата и ожидаемой кумулятивной степени желательного и нежелательного эффектов. По оси X представлена дистанция между этими кривыми, называемая терапевтическим коэффициентом (индексом или окном), которая указывает на вероятность определения постоянною режима дозирования, позволяющего достичь эффект без нежелательных явлений.
Препараты с особенно широким терапевтическим коэффициентом можно вводить в случайные интервалы, даже если препарат быстро элиминируется.
При серьезных ожидаемых нежелательных эффектах наиболее подходящая стратегия лечения состоит в следующем: низкие стартовые дозы и оценка необходимости повышения доз, когда достигнут стабильный эффект препарата. Этот подход имеет преимущество, т.к. минимизирует риск дозозависимых нежелательных эффектов, но требует титрации доз для достижения эффективности. Примером служит соталол: поскольку риск пируэтной ЖТ повышается с дозой препарата, стартовая доза должна быть низкой.
При ожидаемой относительно малой и легко управляемой токсичности необходимо начинать лечение с больших доз, чем минимальные, для достижения терапевтического эффекта, допуская риск нежелательных эффектов; некоторые АГП назначают именно таким образом. Тем не менее должно стать правилом использование наименьших доз для снижения токсичности, особенно непредсказуемой и не связанной с известным фармакологическим действием.
Иногда увеличение дозы в широком терапевтическом интервале не приводит к желаемым эффектам и отсутствию нежелательных явлений. В этих условиях врач должен быть готов к возможности межлекарственных взаимодействий на фармакокинетическом и фармакодинамическом уровнях. В зависимости от природы ожидаемой токсичности возможно повышение дозы, выходящее за границы обычною терапевтического интервала, но только в том случае, если ожидаемая токсичность несерьезна и легко преодолима.
Подбор дозы базального инсулина для достижения оптимального гликемического контроля: роль врача и пациента
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Достижение целевых уровней гликированного гемоглобина (HbA1c) снижает риск поздних осложнений сахарного диабета (СД), но многим пациентам с СД 2 типа не удается достичь адекватного гликемического контроля. Это может быть следствием клинической инерции, обусловленной у пациента страхом гипогликемии или набора массы тела, обременяющими режимами терапии, низкой приверженностью инъекционной терапии, нехваткой времени у врача для обучения пациентов, сложностями с пониманием пациентом необходимости подбора дозы препарата, переживаниями по поводу потраченного времени на достижение целевых показателей. Новая форма инсулина гларгин 300 ЕД/мл обеспечивает более плавный профиль активности препарата, удлиняет его действие и позволяет более стойко поддерживать концентрации глюкозы в крови. Результаты исследования TAKE CONTROL свидетельствуют о том, что самостоятельная титрация инсулина гларгин 300 ЕД/мл превосходила титрацию, управляемую врачом, с точки зрения снижения HbA1c.
Ключевые слова: базальный инсулин, титрация, гларгин 300 ЕД/мл, сахарный диабет.
Для цитирования: Демидова Т.Ю. Подбор дозы базального инсулина для достижения оптимального гликемического контроля: роль врача и пациента. РМЖ. Медицинское обозрение. 2019;3(10(II)):75-81.
Pirogov Russian National Research Medical University, Moscow
Achieving target levels of glycated haemoglobin (HbA1c) reduces the risk of diabetes mellitus late complications, however, many patients with type 2 diabetes mellitus do not achieve adequate glycemic control in general practice. Inadequate glycemic control can be a consequence of clinical inertia due to several barriers on the part of both the physician and the patient. For example, due to the fear of hypoglycemia or weight gain, burdensome therapy regimens, low adherence to injection therapy, lack of time of physician to train patients, difficulty for the patient in understanding the importance and necessity of dosage selection, and worries about the time spent on achieving targets. The new form of insulin glargine 300 U/ml provides an even smoother activity profile of the drug, prolongates its action and allows more stable maintenance of blood glucose concentrations. The TAKE CONTROL study results indicate that self-titration of insulin glargine 300 U/ml was superior to titration managed by the physician in terms of reducing HbA1c.
Keywords: basal insulin, titration, glargine 300 U/ml, diabetes mellitus.
For citation: Demidova T.Yu. Basal insulin dosage selection for optimal glycemic control: physician’s and patient’s role. RMJ. Medical Review. 2019;10(II):75–81.
В статье обсуждается роль врача и пациента в подборе дозы базального инсулина для достижения оптимального гликемического контроля
Факторы, влияющие на достижение целевых уровней гликированного гемоглобина у пациентов с СД 2 типа
Достижение целевых уровней гликированного гемоглобина (НbА1с) снижает риск поздних осложнений сахарного диабета (СД) [1], но многим пациентам с СД 2 типа (СД 2) не удается достичь адекватного гликемического контроля [2–4]. Это может быть следствием клинической инерции, обусловленной у пациента страхом гипогликемии или набора массы тела, обременяющими режимами терапии, низкой приверженностью инъекционной терапии, нехваткой времени у врача для обучения пациентов и сложностью понимания пациентом необходимости подбора дозы препарата, переживаниями по поводу потраченного времени на достижение целевых показателей, недостаточной коммуникацией между врачом и пациентами, тревожностью [5–10]. Поскольку СД является прогрессирующим заболеванием, со временем гликемический контроль ослабевает и требуется интенсификация терапии [11].
Предоставление возможности пациентам с СД 2 принимать более активное участие в их собственном лечении может помочь им достичь нужного уровня гликемии и снизить риск смертности от всех причин [12, 13], сократить стоимость лечения осложнений и количества госпитализаций [14], способствовать снижению растущего бремени СД в системах здравоохранения всех стран мира. Данная концепция пациенто-ориентированного здравоохранения и самостоятельного управления заболеванием является ключевой концепцией действующего консенсуса, представленного Американской ассоциацией диабета (ADA) и Европейской ассоциацией по изучению сахарного диабета (EASD).
Самостоятельная титрация инсулина гларгин 100 ЕД/мл может быть более эффективной, чем подбор дозы, осуществляемый врачом [14, 15], и при этом не отмечается проблем с безопасностью [16, 17]. Однако, вероятно, самостоятельная титрация может быть связана с более высоким риском симптоматической гипогликемии, чем управляемая врачом [15, 16]. Данное ограничение инсулина гларгин 100 ЕД/мл может быть преодолено при помощи самостоятельной титрации инсулина гларгин 300 ЕД/мл — базального инсулина второго поколения с более пролонгированным и стабильным фармакокинетическим и фармакодинамическим профилем, чем у инсулина гларгин 100 ЕД/мл [18, 19].
Формы препаратов инсулина и контроль гликемии
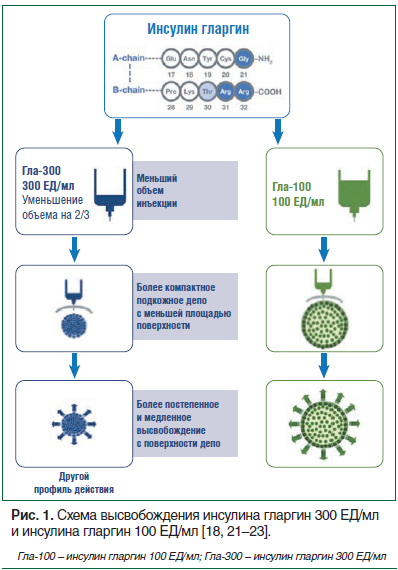
Новая форма разработана для обеспечения более плавного профиля действия препарата, его удлинения и обеспечения более стойкого поддержания концентрации глюкозы в крови. Несмотря на то что вышеуказанные препараты содержат одно и то же активное вещество — инсулин гларгин, его концентрация в единице объема в 3 раза больше в инсулине гларгин 300 ЕД/мл [20], поэтому для одного и того же количества единиц инсулина гларгин вводимый объем инсулина гларгин 300 ЕД/мл составляет 1/3 часть. Очевидно, что объем депонированного преципитата зависит от концентрации инъекционного раствора, однако количество единиц введенного инсулина остается постоянным. Таким образом, гларгин 300 ЕД/мл образует преципитат меньшего объема, чем гларгин 100 ЕД/мл. Ввиду того, что скорость высвобождения молекул инсулина гларгин из депо пропорциональна площади поверхности депо препарата, меньший объем преципитата инсулина гларгин 300 ЕД/мл обеспечивает более медленное поступление в системный кровоток инсулина по сравнению с таковым при введении инсулина гларгин 100 ЕД/мл, который имеет больший объем преципитата. В результате этого применение гларгина 300 ЕД/мл сопровождается более постепенным высвобождением инсулина и, соответственно, более равномерным и длительным периодом активности [18, 21–23] (рис. 1, 2).
Результаты исследования равновесной концентрации препарата продемонстрировали больший период полувыведения (19 ч против 13,5 ч), время действия и даже более равномерное воздействие инсулина гларгин 300 ЕД/мл по сравнению с инсулином гларгин 100 ЕД/мл. Другое исследование показало низкую внутригрупповую вариабельность инсулина гларгин 300 ЕД/мл (коэффициент вариабельности составил 17,4%). Колебания от пика до нижней точки (0,6) были ниже, чем для инсулина гларгин 100 ЕД/мл (1,6) [18]. Таким образом, в исследованиях была продемонстрирована более низкая вариабельность гликемии при применении инсулина гларгин 300 ЕД/мл, что еще более приближает лечение к физиологической норме, снижает риск гипогликемий, прогностически положительно влияет на развитие микрососудистых осложнений и облегчает управление СД [24–26].
Исследования III фазы с применением подхода «лечение до цели» продемонстрировали низкий риск гипогликемии на фоне применения инсулина гларгин 300 ЕД/мл по сравнению с инсулином гларгин 100 ЕД/мл у пациентов с СД 2, особенно в фазе титрации [27]. В исследованиях принимали участие 2737 пациентов с СД 2 и 792 пациента с СД 1. Во всех исследованиях инсулин гларгин 300 ЕД/мл был сопоставим по своему гипогликемическому эффекту с инсулином гларгин 100 ЕД/мл [28–35].
Благодаря описанному механизму, обеспечивающему более стабильный профиль фармакокинетики и фармакодинамики — низкий уровень вариабельности гликемии [18, 24–26, 36, 37], пациенты, получавшие в ходе исследований III фазы инсулин гларгин 300 ЕД/мл, имели значительно меньший риск гипогликемии, чем пациенты, получавшие инсулин гларгин 100 ЕД/мл [28–35]. В частности, это касалось меньшего риска ночной гипогликемии в исследовании EDITION 1, проводившемся среди пациентов с СД 2 на базис-болюсном режиме терапии [30, 33], меньшего риска гипогликемии в течение всего дня и ночью в исследовании EDITION 2, проводившемся среди пациентов с СД 2, получавших ранее иной базальный инсулин [31, 34].
В исследованиях EDITION 2 и EDITION 3 (исследование среди больных СД 2, не получавших инсулин ранее) пациенты, получавшие инсулин гларгин 300 ЕД/мл, имели более низкий уровень вариабельности глюкозы и низкий риск симптоматической и тяжелой гипогликемии, что было подтверждено Индексом низкой глюкозы крови (LBGI) — показателем, который подтверждает низкий вероятный риск гипогликемии [31, 32, 34].
Исследование EDITION 4, проводившееся среди больных СД 1, ранее получавших иной базальный инсулин, показало, что пациенты, получавшие инсулин гларгин 300 ЕД/мл, достигали сравнимого с инсулином гларгин 100 ЕД/мл гликемического контроля с более низким риском гипогликемии и набора массы тела при переводе с других режимов инсулинотерапии, независимо от времени введения [20].
Для оценки особенностей суточного гликемического профиля и коррекции сахароснижающей терапии пациенту было проведено непрерывное мониторирование гликемии в течение 4 дней. На графике представлены продолжительный период ночной гипогликемии, выраженная вариабельность гликемии с высокими постпрандиальными подъемами уровня глюкозы в крови в дневное время (рис. 6).
Пациенту скорректирована сахароснижающая терапия: вместо инсулина-изофана, на фоне которого зарегистрированы гипогликемии, назначен инсулин гларгин 300 ЕД/мл в эквивалентной дозе 26 ЕД/сут. Пациенту с непродолжительным анамнезом СД и выраженным ожирением инсулин короткого действия был отменен, назначен дапаглифлозин 10 мг, метформин сохранен в прежней дозе. Далее доза инсулина гларгин титровалась до достижения целевых показателей гликемии натощак и составила 32 ЕД/сут.
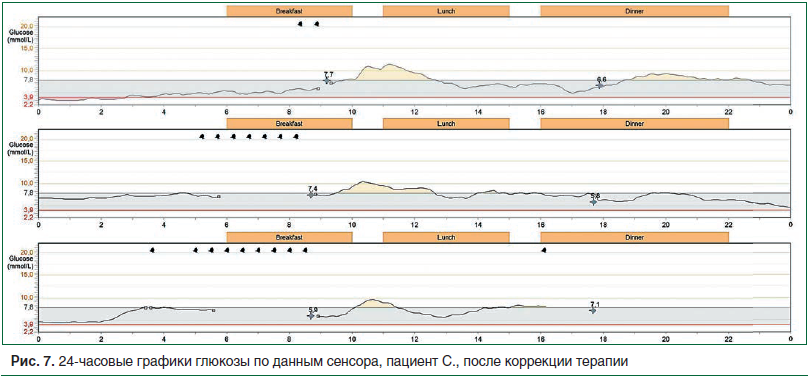
На представленном графике мониторирования после коррекции терапии отмечается существенная положительная динамика в виде стабилизации показателей гликемии в ночное время в пределах физиологической нормы, постпрандиальная гликемия в рамках целевых значений, отсутствие эпизодов гипогликемии (рис. 7).
Клинический пример № 2. Пациентка К., 63 года, страдающая СД 2 в течение 8 лет, обратилась в клинику с жалобами на ночную потливость, высокие уровни глюкозы в крови, значительные перепады показателей гликемии при самоконтроле. У пациентки диагностировано атеросклеротическое поражение коронарных артерий, проводилось стентирование огибающей ветви левой коронарной артерии 4 года назад.
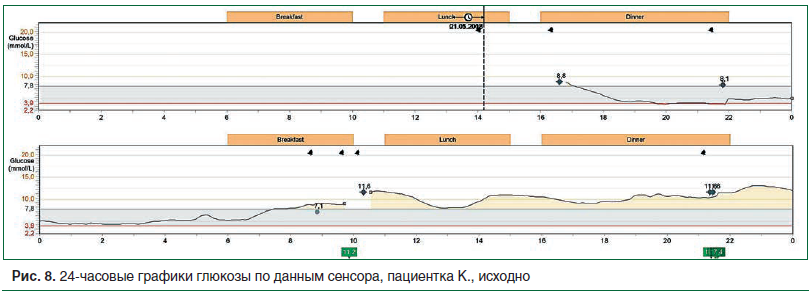
Для оценки особенностей суточного гликемического профиля и коррекции инсулинотерапии пациентке было проведено непрерывное мониторирование гликемии в течение 4 дней. На представленном графике установлены: выраженная продолжительная гипогликемия в ночное время, вариабельность гликемии с высокими постпрандиальными подъемами уровня глюкозы в крови в дневное время (рис. 8).
Была проведена коррекция назначенной терапии: инсулин-изофан был заменен на инсулин гларгин 300 ЕД/мл в дозе 12 ЕД перед сном. Гликлазид отменен, назначен дапаглифлозин 10 мг/сут, метформин сохранен в прежней дозе. Проводилось обучение в школе для пациентов с диабетом, даны рекомендации по питанию и физической активности. Доза инсулина гларгин 300 ЕД/мл титровалась до достижения целевых показателей гликемии натощак и составила 16 ЕД/сут.
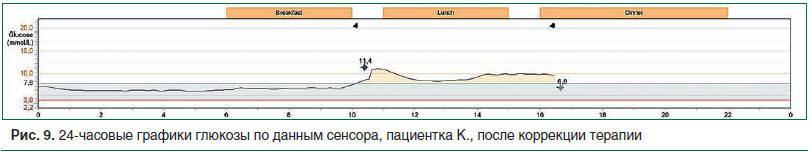
На графике гликемического профиля после коррекции терапии отражена нормализация ночной гликемии в пределах целевых значений. Постпрандиальные значения глюкозы в крови также соответствуют целевым. Гипогликемий не зарегистрировано (рис. 9).
Заключение
Поддержание целевых показателей гликемического контроля, безусловно, является одной из приоритетных задач терапии СД. Разработка базальных аналогов инсулина длительного действия, в частности аналога инсулина гларгин 300 ЕД/мл, предоставляет дополнительные возможности пациенту и лечащему врачу для интенсификации и оптимизации сахароснижающей терапии и безопасного достижения целевых показателей гликемии. Это стало возможным за счет равномерного и пролонгированного действия препарата с меньшим риском развития эпизодов гипогликемии. Однако для достижения поставленных целей требуется грамотный и тщательный подбор дозы препарата инсулина. Показано, что самостоятельный подбор дозы пациентами в амбулаторных условиях обеспечивает даже большую эффективность сахароснижающей терапии и способствует вовлечению пациентов с СД в активное управление заболеванием.
Только для зарегистрированных пользователей
Оптимальная инсулинотерапия требует оптимальной титрации дозы
Прогнозы экспертов Международной федерации диабета остаются неутешительными в отношении динамики заболеваемости сахарным диабетом (СД), несмотря на то что они всегда отличались оптимистичностью, а реальные цифры оказывались на десятки миллионов больше предполагаемых. Возрастание популяции больных СД, прежде всего СД 2 типа, и частоты его хронических осложнений – одна из актуальных проблем здравоохранения, с которыми сегодня сталкивается мировое сообщество. Скачкообразное увеличение распространенности данной патологии вносит существенный вклад в увеличение общих расходов [1].
Сахарный диабет – коварное заболевание, которое дает о себе знать, когда развиваются осложнения. У больных, плохо контролирующих свое состояние, очень высока частота инфаркта миокарда, мозгового инсульта, слепоты, почечной недостаточности и гангрены нижних конечностей. В связи с этим оптимизация подходов к фармакотерапии сахарного диабета является приоритетной задачей современной медицины.
Практически все международные и национальные рекомендации по инициации коррекции гликемии у пациентов с СД 2 типа указывают на необходимость начинать с изменения образа жизни и приема одного или нескольких пероральных сахароснижающих препаратов. Однако по мере прогрессирования заболевания фаза гиперсекреции инсулина сменяется фазой истощения, что приводит к дефициту инсулина. В этот период инсулинотерапия становится необходимостью. С учетом полученных данных о связи между состоянием компенсации углеводного обмена и частотой сосудистых осложнений, а также эффективной защитой бета-клеток от воздействия глюкозо- и липотоксичности инсулинотерапия при наличии показаний считается наиболее эффективным методом у пациентов с СД 2 типа и единственным патогенетически обоснованным и жизненно необходимым – у больных СД 1 типа.
Интерес к определению оптимального лечения СД 2 типа постоянно растет, что подтверждается появлением инновационных как пероральных, так и инсулиновых препаратов. Его конечной целью является предотвращение отдаленных осложнений СД и снижение смертности. Важным средством для этого служит улучшение и поддержание гликемического контроля с течением времени. К сожалению, это непростая задача из-за прогрессирующего течения заболевания. Таким пациентам требуется своевременная оптимизация лечения и в большинстве случаев – назначение инсулина [2].
Своевременному назначению инсулина препятствует ряд надуманных барьеров. Промедление в свою очередь чревато как длительной хронической гипергликемией, так и ее выраженной вариабельностью. Исследование A1chieve в России показало, что у пациентов при инициации базальной инсулинотерапии средний уровень гликированного гемоглобина (HbA1c) составил 9,7%, готовыми смесями – 10,1%, базис-болюсной терапии – 10,4%. Эти результаты свидетельствуют о том, что инсулинотерапию, как правило, назначают при уровне HbA1c > 9,0% [3]. Согласно данным B.R. Shah и соавт., даже если лечением управляют врачи-специалисты, его оптимизируют менее половины пациентов с высоким уровнем HbA1c [4]. Необходимо отметить, что в этом исследовании врачи-специалисты более активно назначали инсулин, чем врачи первичной медицинской помощи. Исследование A1chieve, проведенное P. Home и соавт., продемонстрировало, что средний HbA1c на момент инициации терапии инсулином составлял 9,5%, у 90,0% пациентов с СД уже было какое-то осложнение [5]. В данное наблюдательное неинвазивное исследование было включено более 66 000 лиц с диабетом, начавших или перешедших на аналогичную терапию инсулином.
Кроме того, показания к инициации лечения инсулином плохо определены в руководствах и подлежат обсуждению из-за широкого спектра мнений [6]. По сути, нет конкретной точки, с которой должна начинаться инсулинотерапия. В качестве одного из рациональных подходов может быть предложено рассмотрение некоторых клинических сценариев. Сроки старта терапии инсулином могут быть следующими [2]:
Необходимо отметить, что последние годы показания к инсулинотерапии при СД 2 типа значительно расширились. Так, показаниями к ней являются недостаточность функции бета-клеток поджелудочной железы, выраженная глюкозотоксичность, непереносимость и недостаточная эффективность пероральных сахароснижающих препаратов [6, 7]. Согласно консенсусу Американской диабетической ассоциации и Европейской ассоциации по изучению диабета, терапия базальным инсулином признана терапией первого ряда при недостаточном контроле СД 2 типа в связи с более низким риском развития гипогликемий и прибавкой массы тела [8].
Инсулинотерапия при СД 2 типа: преимущества и недостатки
Эффект инсулина при СД 2 типа с момента постановки диагноза был оценен в ряде клинических исследований, в частности в проспективном исследовании сахарного диабета в Великобритании (UKPDS) и снижения исходов при начальном вмешательстве гларгином (ORIGIN) [9, 10].
Согласно результатам исследования UKPDS, ранний и постоянный контроль уровня глюкозы способствовал уменьшению риска микрососудистых осложнений и улучшению сердечно-сосудистого прогноза [11, 12].
Кроме того, улучшение гликемического контроля с помощью инсулина связано с улучшением самочувствия пациента, даже если целевые значения HbA1c не достигнуты [13].
Доказательная база в отношении старта терапии инсулином у больных СД 2 типа представлена в таблице [2].
Нежелательные эффекты инсулинотерапии, такие как увеличение массы тела и эпизоды гипогликемии, можно минимизировать за счет коррекции питания, уровня физической активности [5] и более разумного подхода к выбору индивидуальных целей терапии – в зависимости от возраста, наличия осложнений и сопутствующей сердечно-сосудистой патологии. В краткосрочных исследованиях, в которых сравнивали разные инсулины, установлено, что высокий процент лиц с диагностированным сахарным диабетом 2 типа, плохо контролируемым пероральными препаратами, могут достигать целевой гликемии без высоких показателей гипогликемии [14–16].
Использование базальных инсулинов с меньшей вариабельностью, более продолжительным периодом действия, стабильным высвобождением из подкожно-жировой клетчатки является предпочтительным в силу низкого риска развития гипогликемии [17].
Так, в исследовании ORIGIN инсулинотерапия применялась лицами с недавно диагностированным сахарным диабетом 2 типа и высоким риском сердечно-сосудистых заболеваний [10]. При продолжении предшествующей пероральной терапии и систематической титрации базального инсулина (гларгина) глюкозу натощак удавалось поддерживать на нормальном уровне (
ТИТРОВАНИЕ
ТИТРОВАНИЕ. (от франц. titre – качество, характеристика) – один из методов количественного анализа, основанный на измерении количества реагента, который полностью реагирует с анализируемым веществом. Например, если точно известно, какое количество гидроксида калия (в граммах или молях) израсходовано в реакции с соляной кислотой, то по уравнению реакции KOH + HCl = KCl + H2O легко рассчитать, сколько граммов (или молей) хлороводорода было в анализируемом растворе.
Подобные расчеты можно проводить только для стехиометрических реакций. Этот термин ввел в употребление в 1792 немецкий химик Иеремия Рихтер. Он произвел его от греческих слов, означающих «невидимый» и «измерение», что должно было означать соотношение «невидимых» химических элементов в реакциях. Рихтер впервые в истории химии начала использовать количественные уравнения реакций. Например, по его данным, из 2400 гранов CaCO3 при сильном прокаливании получается 1342 грана CaO, т. е. реакция разложения CaCO3 = CaO + CO2 характеризуется соотношением CaCO3:CaO = 2400:1342 = 1,788, что удивительно хорошо согласуется с современным расчетом, который дает отношение 1,785.
Все реакции, которые используются в количественном анализе, обязательно должны быть стехиометрическими. Для этих реакций коэффициенты, стоящие перед формулами реагентов, показывают, в каких количественных соотношениях находятся реагенты и продукты. Например, соотношение реагентов в реакции окисления щавелевой кислоты перманганатом калия в кислой среде в точности соответствует уравнению
Поэтому эту реакцию можно использовать для точного определения концентрации перманганата в растворе, если известно количество израсходованной щавелевой кислоты (и наоборот). А вот рассчитать точно количество прореагировавшего с перманганатом калия алкена невозможно, так как эта реакция нестехиометрическая: при окислении из алкена образуется диол: R-CH=CH-R + 2[O] ® R-CH(OH)-CH(OH)-R, который может окисляться далее с разрывом углерод-углеродной связи и образованием двух молекул с карбонильной группой (кислоты или кетона). При этом разные опыты, даже проведенные в одинаковых условиях, дадут немного разное количество продуктов и их соотношение; в органической химии выход реакции очень редко бывает в точности равным 100,00%.
Чтобы анализ был точным, необходимо, помимо полного протекания реакции, чтобы реагент добавлялся к анализируемому веществу малыми порциями (например, по одной капле разбавленного раствора), а также чтобы можно было надежно определить момент, когда реакция закончилась. Для выполнения второго условия применяют различные индикаторы.
Индикаторы бывают самые разные. Рассмотрим реакцию питьевой соды с уксусом: NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O. Из этого уравнения следует, что 1 моль соды (84 г) полностью реагируют с 60 г уксусной кислоты. При этом выделяются пузырьки углекислого газа, которые и могут служить индикатором. Если к гидрокарбонату натрия известной массы добавлять по каплям уксус, пока не перестанет выделяться газ, то, измерив объем добавленного раствора и зная его плотность, легко рассчитать количество чистой уксусной кислоты в добавленном растворе и, следовательно, концентрацию уксуса. Например, если для полной реакции с 1,00 г соды потребовалось 10,5 г уксуса, то это значит, что в уксусе было 60/84 = 0,714 г чистой уксусной кислоты, а его крепость составляет (0,714/10,5)100% = 6,8%. При очень точных расчетах химики используют уточненные значения атомных масс элементов (в данном случае 84,01 для гидрокарбоната натрия и 60,05 для уксусной кислоты).
Конечно, описанный опыт по титрованию рассмотрен только для примера. Ведь газ выделяется далеко не во всех химических реакциях, да и заметить последний пузырек газа непросто, особенно если газ частично растворяется, а раствор имеет темную окраску. Поэтому обычно используют специальные индикаторы, изменение цвета которых свидетельствует о достижении конца реакции – так называемой точки эквивалентности.
Одни из самых распространенных индикаторов – кислотно-щелочные. Они применяются в тех случаях, когда в ходе титрования, т.е. постепенного добавления реагента к анализируемому раствору изменяется рН среды. Это происходит, например, если к анализируемому раствору щелочи добавляют раствор кислоты (или наоборот). Анализируемый раствор готовят по объему или по навеске (ее взвешивают на точных аналитических весах обычно до 0,1 мг), которую растворяют в мерной колбе точно известного объема (такие колбы могут иметь объем 10, 25, 50, 100, 200, 250, 500 или 1000 мл). Небольшой объем анализируемого раствора отбирают из мерной колбы с помощью специальных мерных пипеток (их объем также определен с высокой точностью и составляет обычно 10, 20, 25 и 50 мл) и помещают в коническую колбочку для титрования. В эту колбочку по каплям при непрерывном перемешивании добавляют раствор реагента из бюретки до достижения точки эквивалентности.
Объем израсходованного раствора реагента измеряют по делениям бюретки; ее объем может быть равен 10, 25 или 50 мл, а цена деления – 0,1 мл. Существуют и микробюретки емкостью от 1 до 5 мл с ценой деления 0,01 мл. Раствор из бюретки с помощью краника добавляют по каплям к раствору анализируемого вещества. При этом титрование всегда повторяют несколько раз и берут усредненный результат – это повышает точность и надежность анализа. Если концентрацию растворов измерять в единицах моль/л, то по объему растворов анализируемого вещества и реагента можно сразу определить неизвестную концентрацию вещества. Например, если на титрование 25,00 мл раствора KOH пошло 12,55 мл раствора HCl с концентрацией 0,0865 моль/л (ее определяют заранее), то концентрация щелочи равна 0,0865(12,55/25,00) = 0,0432 моль/л. Понятно, что если для титрования использовали раствор серной кислоты, то необходимо учитывать стехиометрический коэффициент 2 в уравнении реакции 2KOH + H2SO4 = K2SO4 + 2H2O. Химики-аналитики, чтобы учесть стехиометрические коэффициенты, обычно используют вместо молярности нормальность раствора. Так, 1 н. раствор H2SO4 соответствует молярной концентрации 0,05 моль/л. Тогда произведение объема на нормальность раствора всегда будет одинаковым и для анализируемого вещества, и для реагента.
Кислотно-основных индикаторов известно множество (около 100), и каждый из них имеет свою область применения. Это можно показать на следующих примерах. При титровании сильной кислоты (HCl) сильной щелочью (NaOH) полная нейтрализация достигается, когда раствор, содержащий NaCl, нейтрален (рН = 7). В этом случае можно пользоваться такими индикаторами как нитразиновый желтый (окраска изменяется от желтой до сине-фиолетовой в интервале рН 6,0 – 7,0) или бромтимоловый синий, имеющий сходные характеристики. При титровании сильной кислоты сильной щелочью (или наоборот) изменение рН в точке эквивалентности бывает настолько резким, что можно использовать и многие другие индикаторы. Например, в указанном примере при концентрациях реагентов 0,1 моль/л после добавления 99,9% всей щелочи рН раствора равен 4, а после добавления 0,1% избытка щелочи рН = 10. Такое резкое изменение рН при титровании может быть вызвано всего 1–2 каплями реактива. Поэтому не будет ошибкой в данном случае воспользоваться и такими индикаторами как метиловый оранжевый (окраска изменяется от красной при рН 3,1 до оранжево-желтой при рН 4) или хорошо известным фенолфталеином (окраска изменяется от бесцветной при рН 8,2 до малиново-красной при рН 10,0).
Если же титровать раствором NaOH слабую кислоту, например, уксусную, то в конце титрования после полной нейтрализации кислоты раствор содержит ацетат натрия CH3COONa, который, вследствие гидролиза, имеет щелочную реакцию (рН около 9). В этом случае уже нельзя пользоваться метиловым оранжевым, но можно – фенолфталеином. С другой стороны, при титровании слабой щелочи (например, раствора аммиака) сильной кислотой (HCl) в точке эквивалентности в растворе присутствует NH4Cl, который из-за гидролиза имеет кислую реакцию (рН около 5), и здесь можно использовать метиловый оранжевый и нельзя – фенолфталеин.
Особый случай – выбор индикатора при титровании многоосновных кислот (например, Н3РО4), а также смесей веществ. Так, растворы NaOH обычно содержат примесь карбоната из-за реакции с углекислым газом воздуха. Если титровать раствор NaOH, содержащий Na2CO3, сильной кислотой в присутствии фенолфталеина, то раствор обесцветится, когда будет нейтрализована вся щелочь и частично – карбонат (это произойдет при рН около 8,5) в соответствии с уравнением
Если к такому раствору добавить метиловый оранжевый и продолжать титрование, то желтая окраска перейдет в розовую, когда прореагирует весь гидрокарбонат (этому соответствует рН около 3,5): NaHCO3 + HCl = NaCl + H2CO3.
Таким образом, используя два кислотно-основных индикатора, можно рассчитать по отдельности содержание щелочи и карбоната в образце.
Если в ходе титрования протекает реакция окисления – восстановления, используются специальные индикаторы, изменяющие свой цвет в зависимости от окислительно-восстановительного потенциала раствора. Часто окрашенный реагент сам может служить индикатором. например, при количественном анализе восстановителей путем их титрования раствором KMnO4, точка эквивалентности определяется по исчезновению розовой окраски перманганата. Таким образом можно, например, определить содержание в растворе железа(II) в соответствии с уравнением 10FeSO4+ 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O. Пока в растворе присутствуют ионы Fe2+, добавляемый KMnO4 обесцвечивается. Как только появится малейший избыток перманганата, раствор приобретает розовую окраску. Так можно анализировать различные восстановители.
Более того, с помощью перманганатометрии можно проводить анализ и окислителей! Для этого используют так называемое обратное титрование. Для этого к известному объему окислителя (например, дихромата калия) добавляют в избытке известное количество восстановителя – железа(II). Реакция K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O проходит очень быстро. Затем с помощью титрования перманганатом определяют, сколько осталось железа(II) и простым вычитанием рассчитывают, сколько его израсходовалось в первой реакции с дихроматом.
Другой распространенный метод с использованием окислительно-восстановительных реакций – иодометрия (см. ИОД) Он применяют, например, для определения окислителей, которые, реагируя с иодидом калия, окисляют его до свободного иода, например: 10KI + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O. Здесь также используют принцип обратного титрования: количество выделившегося в первой реакции иода можно определяют, используя его реакцию с тиосульфатом натрия: I2 + 2Na2S2O3 = Na2S4O6 + 2NaI. Конец этой реакции определяют по исчезновению окраски иода. Однако когда иода в растворе остается мало, его бледно-желтая окраска почти не видна и трудно заметить момент, когда раствор обесцвечивается полностью. Чтобы повысить точность титрования, ближе к его концу к раствору добавляют немного крахмального раствора: малейшие следы иода окрашивают его в синий цвет. Следовательно, исчезновение синей окраски свидетельствует о том, что реакция прошла полностью. Химики обычно используют очень разбавленные растворы тиосульфата (например, 0,01 моль/л), что значительно повышает точность анализа, поскольку большие объемы раствора измеряются более точно.
Иод очень легко и быстро окисляет аскорбиновую кислоту (витамин С). Поэтому с помощью иодометрического анализа можно даже в домашних условиях определить (конечно, без особой точности) содержание этого витамина, например, в апельсиновом соке. (Применять здесь кислотно-основное титрование нельзя, так как в соке в значительно бoльших количествах содержатся другие органические кислоты – лимонная, яблочная, винная и другие.) Анализ основан на том, что 1 моль аскорбиновой кислоты (176 г) реагирует с 1 моль иода (254 г). Для титрования можно использовать аптечную иодную настойку, считая, что иод не выдохся и она точно 5%-ная (это соответствует концентрации около 0,2 моль/л). Количество израсходованного иода можно оценить с помощью обычной пипетки – по числу капель настойки, использованной в реакции. Так как аскорбиновой кислоты в соке обычно не очень много, на титрование его порции (например, 20 мл) может пойти всего 1–2 капли настойки, что приведет к очень большой ошибке анализа. Чтобы результат был более точным, надо либо взять много сока, либо разбавить иодную настойку; в обоих случаях число капель иода, израсходованных на титрование, увеличится, что и сделает анализ точнее. Химики предпочитают второй путь.
Если настойку разбавить кипяченой водой (химики пользуются дистиллированной) в 40 раз, то концентрация такого раствора будет около 0,005 моль/л; 1,0 мл такого раствора соответствует 0,88 мг аскорбиновой кислоты. Необходимо также определить объем капли (он зависит от типа пипетки, а также от конкретного раствора). Для этого надо с помощью медицинского шприца на 1 или 2 мл отмерить 1 мл разбавленного раствора иода, а затем посчитать, сколько в этом объеме содержится капель (это займет всего несколько минут). Методику желательно отработать вначале на стандартном растворе аскорбиновой кислоты. Его можно приготовить из таблетки с известным содержанием аскорбиновой кислоты – например, 0,1 или 0,5 г. Таблетку надо растворить в 0,5 л кипяченой воды и отобрать с помощью аптечной мензурки 25 мл этого раствора (витамина в нем будет в 20 раз меньше, чем в таблетке). К этому раствору и добавляют разбавленную иодную настойку, не забывая в конце добавить немного жидкого крахмального клейстера. И если, например, на титрование 25 мл раствора пошло 6,0 мл раствора иода, то аскорбиновой кислоты в растворе было 0,88.6 = 5,28 мг, а в исходной таблетке – в 20 раз больше, т.е. 105,6 мг. Такая небольшая ошибка свидетельствует о правильности «домашнего» анализа.
Химики, конечно, не капают из пипетки, а используют точные бюретки с делениями. Кроме того, они часто не готовят даже сами стандартные растворы, а пользуются фабричными; такие растворы в запаянных ампулах называются фиксаналами – они содержат фиксированное количество реагента (обычно 0,1 моль) для точного определения концентрации рабочего раствора. Фиксаналами служат, например, растворы KMnO4, K2Cr2O7, NaCl, H2C2O4, HCl, AgNO3, NaOH и др.
Широкое распространение получили комплексонометрические индикаторы – вещества, образующие с ионами некоторых металлов (многие из которых бесцветны) окрашенные комплексные соединения. Примером может служить эриохром черный Т; раствор этого сложного органического соединения имеет синий цвет, а в присутствии ионов магния, кальция и некоторых других образуются комплексы, окрашенные в интенсивный винно-красный цвет. Анализ ведут так: к раствору, содержащему анализируемые катионы и индикатор, добавляют по каплям более сильный, по сравнению с индикатором, комплексообразователь, чаще всего – трилон Б. Как только трилон полностью свяжет все катионы металлов, произойдет отчетливый переход от красного цвета к синему. По количеству добавленного трилона легко вычислить содержание катионов металла в растворе. С помощью комплексонометрического анализа определяют, например, общую жесткость воды.
Существуют методы титрования, основанные на образовании осадка. Так, с помощью аргентометрии можно определить содержание в растворе хлоридов и бромидов. Для этого раствор титруют раствором AgNO3. Для более четкого установления точки эквивалентности, в анализируемый раствор добавляют 1–2 капли раствора K2Cr2O4. Пока в растворе есть избыток галогенид-ионов, образуются менее растворимые AgCl или AgBr. После полного осаждения этих ионов, сразу появится красноватый осадок Ag2CrO4. Если же надо определить ионы серебра в растворе, его титруют раствором NaCl.
Описанные приемы далеко не исчерпали существующие методы титрования. Широкое распространение получили также методы, в которых за ходом титрования следят с помощью приборов. Например, при кондуктометрическом анализе (от англ. conductivity – электропроводность) измеряют электропроводность раствора, которая меняется в ходе титрования. При потенциометрическом методе измеряют потенциал электрода, погруженного в анализируемый раствор. Фотометрический анализ основан на измерении поглощения света при изменении интенсивности окраски раствора. Разработаны приборы, которые не только определяют точку эквивалентности, но и сами автоматически добавляют по каплям рабочий раствор к анализируемому и выдают готовый результат анализа.
Титрование как метод анализа отличается простотой методики и аппаратуры, а также высокой точностью: с помощью титрования нетрудно определить концентрацию вещества в растворе с точностью до 0,1%. Поэтому титриметрические методы широко применяются в научных исследованиях и при контроле технологических процессов на производстве. Так, при изучении кинетики реакции определяют уменьшение со временем концентрации исходного реагента или рост концентрации продукта реакции; таким способом, например, были выполнены классические работы по механизму реакций замещения в органических соединениях. В промышленности широко используются титраторы – приборы для автоматического выполнения титриметрических анализов. Они очень удобны для проведения массовых однотипных анализов (например, для определения состава сплава в процессе его выплавки или содержания в нем вредных примесей). Такие приборы способны долго работать в отсутствие лаборанта, автоматически отбирать пробы и выдавать результаты анализа. Это особенно важно при необходимости работы с радиоактивными, ядовитыми или взрывчатыми веществами, в запыленных помещениях и т.п.