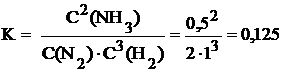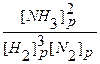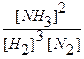Что значит сместить равновесие вправо что значит сместить равновесие влево химия
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Содержание:
В химии есть обратимые и необратимые химические реакции. Они протекают по разному принципу и имеют свои особенности. Равновесие в реакции способно смещаться под воздействием определенных факторов.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами.
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: [A], [B], [C], [D]. Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= [C] x ×[D] y /[A] a ×[B] b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Смещение химического равновесия под действием различных факторов
О подвижности равновесия говорили ученые еще в XIX веке. В то же время активно проводились исследования, чтобы доказать свои предположения. Анри Ле-Шателье был первым, кто попытался рассказать об этом в своих трудах. Позже его исследования обобщил Карл Браун. Принцип Ле-Шателье говорит о:
Если на систему, находящуюся в равновесии оказывается влияние, то равновесие смещается в ту сторону, которое ослабляет это влияние
Влияние температуры
В обратимых реакциях прямая и обратная сторона процесса противоположны по температуре друг другу. В зависимости от температурного коэффициента реакции подразделяются на экзотермические (температура в процессе реакции выделяется). При повышении температуры в такой системе равновесие будет смещаться в сторону обратной реакции.
Эндотермические реакции (которые протекают при нагревании) наоборот, если нагревать такую реакцию, то будет протекать быстрее прямая реакция.
Это значит, если в прямой стороне наблюдается показатель +Q-экзотермический процесс, то в обратной будет –Q – эндотермический процесс. Если увеличить температуру исходных продуктов, то химическое равновесие сместиться в ту сторону, в которой наблюдается пониженная температура.
Влияние концентрации
По принципу Ле-Шателье, увеличение концентрации реагентов вызывает смещение равновесие в сторону, где они расходуются, в прямом процессе. А если концентрация веществ понижается, то химическое равновесие снижается в сторону обратных процессов.
Такой же принцип действует и на увеличение концентрации продуктов реакции. Химическое равновесие смещает в ту сторону, где происходит расход реагентов, значит в сторону обратной реакции. Если концентрацию продуктов понизить, то равновесие сместиться в сторону прямого процесса.
Влияние давления
Давление меняет равновесие не во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Важно! На состояние равновесия процессов с твердыми веществами давление не влияет.
При разной концентрации газообразных веществ слева и справа реакции, повышение давления приведет к смещению химического равновесия. Смещается в ту сторону, где количество газообразных веществ уменьшается, а показатели давления повышаются.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки, в виде соединений и комплексов, которые ускоряют процесс образования продуктов. Их добавление никак не влияет на химическое равновесие. В некоторых процесс способствует быстрому уравновешиванию сторон.
Таблица химического равновесия
Химическое равновесие
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие и способы его смещения



Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют:
Концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое либо внешнее воздействие, тов системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
В) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азоти водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 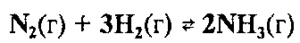
Смещение химического равновесия. Принцип Ле-Шателье
Система, находящаяся в состоянии химического равновесия, будет пребывать в нём до тех пор, пока внешние условия остаются постоянными. Если же изменить внешние условия (концентрации веществ, давление (для газовых систем), температуру), то система выйдет из состояния равновесия, т.к. скорости прямой и обратной реакций изменятся неодинаково.
Процесс изменения концентраций веществ, вызванный нарушением равновесия, называется смещением (сдвигом) равновесия. Если при этом происходит увеличение скорости прямой реакции, то принято говорить о смещении равновесия вправо, т.е. в сторону прямой реакции. Разумеется, что в результате смещения равновесия вправо происходит увеличение концентрации продуктов реакции. Если в результате смещения равновесия увеличивается скорость обратной реакции, то говорят, что равновесие смещается влево, т.е. в сторону обратной реакции; при смещении равновесия влево увеличивается концентрация исходных веществ.
Одним из способов смещения равновесия является изменение концентраций участвующих в реакции веществ за счёт введения в систему извне дополнительного количества реагента или его удаления из системы. Пусть H2, N2 и NH3 находятся в равновесии при определённых температуре и давлении. Если в систему ввести дополнительно некоторое количество исходного вещества, например, азота, и тем самым увеличить его концентрацию, то увеличится скорость прямой реакции, что приведёт к смещению равновесия вправо. В результате преимущественного протекания прямой реакции – взаимодействия азота с водородом – в системе начнёт увеличиваться концентрация аммиака, что повлечёт за собой постепенное увеличение скорости обратной реакции. Через некоторое время скорости прямой и обратной реакции снова сравняются, и установится новое состояние равновесия. Но при этом новая равновесная концентрация аммиака будет больше, чем она была до смещения равновесия, а концентрация водорода меньше. Естественно, что концентрация азота в результате смещения равновесия вправо тоже несколько уменьшится, но новая равновесная концентрация N2 будет большей, чем прежняя равновесная концентрация, которая наблюдалась до введения в систему дополнительного количества азота. Важно понимать, что увеличение концентрации аммиака и уменьшение концентрации водорода вызвано смещением равновесия вправо; более высокая новая равновесная концентрация азота объясняется введением в систему извне большого количества азота для смещения равновесия.
Сказанное можно проиллюстрировать следующим примером. Пусть в состоянии равновесия находятся азот, водород и аммиак в следующих концентрациях: С(N2) = 2 моль/л, С(H2) = 1 моль/л, С(NH3) = 0,5 моль/л.
Предположим, в систему ввели дополнительно 1 моль/л азота. Если бы система никак не отреагировала на это внешнее воздействие, то концентрации всех участников реакции были бы следующими: C(N2) = 2 + 1 = 3 моль/л, C(H2) = 1 моль/л, C(NH3) = 0,5 моль/л. На самом же деле произойдёт смещение равновесия вправо, и концентрации всех веществ изменятся. Расчёты показывают, что новые равновесные концентрации будут таковы: C(N2) = 2,9766 моль/л; C(H2) = 0,9298 моль/л; C(NH3) = 0,5468 моль/л. В справедливости сделанных выводов можно убедиться, рассчитав константу равновесия для новых равновесных концентраций.
Как и должно быть, константа равновесия осталась неизменной. Из приведённого расчёта видно, что вследствие смещения равновесия вправо концентрация азота уменьшается от 3 до 2,9766 моль/л, но оказывается выше, чем была (2 моль/л) до введения в систему дополнительного количества азота.
Если из системы удалить некоторое количество азота, и тем самым уменьшить его концентрацию, то уменьшится скорость прямой реакции. Вследствие этого скорость обратной реакции окажется больше скорости прямой. Равновесие, таким образом, сместится влево. В результате преимущественного протекания обратной реакции – разложения аммиака – в системе будут увеличиваться концентрации азота и водорода, что повлечёт за собой постепенное увеличение скорости прямой реакции. Через некоторое время скорости прямой и обратной реакции снова сравняются, и установится новое состояние равновесия. При этом новая равновесная концентрация аммиака будет меньше, чем она была до смещения равновесия, а водорода больше. Концентрация азота в результате смещения равновесия влево тоже несколько увеличится, т.е. потеря азота будет частично скомпенсирована, но новая равновесная концентрация N2 будет меньшей, чем прежняя, которая наблюдалась до удаления азота из системы.
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расходования этого вещества, а при её уменьшении – в сторону образования этого вещества.
Если в реакции участвуют газообразные вещества, то в ряде случаев изменение давления также может привести к смещению химического равновесия.
Пусть смесь газов N2, H2 и NH3 находятся в состоянии истинного химического равновесии при определённых температуре и давлении. Если, не изменяя температуры, увеличить давление в несколько раз (это можно сделать, уменьшив объём системы путём сжатия), то во столько же раз возрастут концентрации всех газов. Таким образом, увеличение давления эквивалентно увеличению концентрации газообразных веществ. Равновесие в этом случае сместится так, что суммарная концентрация газообразных компонентов (т.е. число молекул в единице объёма) уменьшится. Для реакции N2 + 3 H2 ⇆ 2 NH3 это означает смещение равновесия вправо, т.к. в этом случае 4 молекулы исходных газообразных веществ (N2 и 3 H2) превращаются в 2 молекулы газообразного продукта реакции (2 NH3). Следовательно, если на систему, находящуюся в состоянии химического равновесия оказывается воздействие, заключающееся в увеличении внешнего давления,равновесие смещается в сторону уменьшения числа молекул газообразных веществ. В результате такого смещения равновесия происходит некоторое снижение давления в системе. Аналогичным образом можно показать, что если воздействие заключается в уменьшении внешнего давления, то равновесие смещается в сторону большего числа молекул газообразных веществ. В этом случае в результате смещения равновесия происходит некоторое увеличение давления в системе.
Если реакция протекает без изменения числа молекул газообразных веществ (например, H2 (газ) + I2 (газ) ⇆ 2 HI (газ) ), то изменение давления не приводит к смещению равновесия.
Равновесие большинства химических реакций смещается при изменении температуры. Фактором, определяющим смещение равновесия, является знак теплового эффекта реакции. При повышении температуры равновесие смещается в направлении эндотермической реакции (т.е. протекающей с поглощением тепла), а при понижении температуры – в сторону экзотермической реакции (т.е. протекающей с выделением тепла). Реакция синтеза аммиака – экзотермическая (N2 + 3 H2 ⇆ 2 NH3 + 92,4 кДж), поэтому при повышении температуры равновесие сместится влево (в сторону эндотермической реакции), в результате чего дополнительно введённая в систему теплота будет израсходована на протекание обратной реакции. При понижении температуры (т.е. при охлаждении системы) равновесие реакции синтеза аммиака сместится вправо (в сторону экзотермической реакции), в результате чего потеря теплоты системой из-за охлаждения будет частично скомпенсирована протеканием экзотермической реакции.
Рассмотренные выше примеры смещения равновесия вследствие изменения концентраций реагирующих веществ, давления и температуры представляют собой частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип известен под названием принципа Ле-Шателье.
Если на систему, находящуюся в состоянии химического равновесия, оказывается какое-либо внешнее воздействие, то равновесие в результате протекающих в системе процессов сместится таким образом, что оказанное воздействие уменьшится.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Смещение химического равновесия
Химическое равновесие является случаем устойчивого равновесия. Если система находится в состоянии устойчивого равновесия и на нее не оказываются внешние воздействия, она будет находиться в этом состоянии бесконечно долго.
Некоторые воздействия (изменение температуры, изменение концентрации одного из веществ, изменение давления) могут вывести систему из состояния равновесия. Но за счет того, что система находится в состоянии именно устойчивого равновесия, она самопроизвольно возвращается опять в состояние равновесия.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия оказать какое-либо внешнее воздействие, выводящее ее из этого состояния, то в системе усилится тот процесс (прямая или обратная реакция), который возвратит систему в состояние равновесия.
Часто говорят о сдвиге (смещении) равновесия в системе: усиление прямой реакции приводит к смещению равновесия вправо (в сторону продуктов), а усиление обратной реакции смещает равновесие влево (в сторону исходных веществ).
Например, для обратимой реакции:
Внешнее воздействие влияет на равновесие следующим образом:
| Внешнее воздействие | Смещение равновесия |
| 1. Увеличение концентрации одного из исходных веществ (Н2 или N2) | 1. Вправо |
| 2. Уменьшение концентрации одного из исходных веществ (Н2 или N2) | 2. Влево |
| 3. Увеличение концентрации продукта | 3. Влево |
| 4. Уменьшение концентрации продукта (NH3) | 4. Вправо |
| 5. Увеличение температуры | 5. Влево (т.к. эндотермической является обратная реакция) |
| 6. Уменьшение температуры | 6. Вправо (т.к. эндотермической является прямая реакция) |
| 7. Увеличение давления | 7. Вправо (т.к. в уравнении данной реакции слева 4 моль газообразных веществ, а справа только 2 моль). |
| 8. Уменьшение давления | 8. Влево (см. пункт 7) |
Любое смещение равновесия для данной системы можно доказать двумя способами: по принципу Ле-Шателье или исходя из понятия о константе равновесия.
Например: произошло увеличение концентрации молекул Н2 (в реакционный сосуд ввели некоторое дополнительное количество газообразного водорода).
1. По принципу Ле-Шателье должна усиливаться та реакция, в ходе которой концентрация Н2 уменьшается, то есть водород расходуется. Это прямая реакция, а значит равновесие смещается вправо.
2. До внешнего воздействия система была равновесной, то есть выполнялось равенство:
Kp =
После введения в систему дополнительного количества водорода концентрации всех веществ стали неравновесными, т.к.:
Kp >
Чтобы система вернулась в состояние равновесия необходимо, чтобы увеличилась концентрация продукта (NH3) или уменьшились концентрации исходных веществ (H2 или N2). Если усилится прямая реакция, то произойдет и то и другое (концентрация NH3 увеличится, а концентрация H2 и N2 уменьшатся). Произойдет смещение равновесия вправо и концентрации веществ опять станут равновесными (но теперь уже будут иметь другие значения).
Дата добавления: 2015-04-29 ; просмотров: 832 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ