Что значит смесь в химии
Понятие о смеси веществ.
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
Примером смеси может служить обыкновенный чай (напиток), который многие самостоятельно готовят и пьют по утрам.
Кто-то любит крепкий чай (большое кол-во заварки), кто-то любит сладкий чай (большое кол-во сахара)… Как видим, смесь под названием «чай» всегда получается немного разной, хотя и состоит из одних и тех же компонентов. Однако, следует отметить, что каждый компонент смеси сохраняет набор своих характеристик, поэтому, разные вещества можно выделить из смеси.
Гомогенные и гетерогенные смеси.

Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
Гетерогенные смеси двух веществ можно разделить по агрегатным состояниям на следующие группы:
| Твёрдые частички | Капли жидкости | Пузырьки газа | |
| В твердом теле | Сплав | Капиллярная система | Твёрдая пена, порошок |
| В жидкости | Суспензия | Эмульсия | Пена |
| В газе | Аэрозоль | Туман | Неустойчиво |
Основные способы разделения смеси
Существуют различные методы разделения смесей. Для газов эти методы основаны на разнице в скоростях либо массах молекул веществ, входящих в смесь.
1. Основные способы выделения веществ из неоднородной (гетерогенной) смеси:
— Отстаивание, фильтрование, действие магнитом
2. Основные способы выделения веществ из однородной (гомогенной) смеси:
— выпаривание, кристаллизация, дистилляция, хроматография
Состав смесей: объемная и массовая доли компонентов смеси, массовая доля примесей.
Мерой, указывающей доли веществ в смеси, является концентрация.
1.Для жидких и твёрдых смесей массовая доля компонента (w) рассчитывается по формуле:
2. Объёмная доля компонента газообразной смеси (φ) рассчитывается по формуле:
3. Используя материал пунктов 1 и 2, выведите формулы для расчётов:
m (раствора)=V*ρ
1. В 40 г дистиллированной воды растворили 2 г хлорида натрия. Рассчитайте массовую долю соли в полученном растворе.
2. Сколько воды и соли нужно взять, чтобы приготовить 250 г 10%-го раствора нитрата натрия?
3. К 1 кг 60%-го раствора соли добавили 50 г этой соли. Какова массовая доля соли в полученном растворе? Ответ округлить до десятых.
4. Смешали 120 г 40%-го и 280 г 10%-го раствора азотной кислоты. Определите массовую долю азотной кислоты в полученном растворе.
В 2 л раствора серной кислоты содержится 456 г H2SO4. Рассчитайте массовую долю растворённого вещества, учитывая, что плотность раствора равна 1,14 г/мл.
Вопросы для самоконтроля
1) Что такое чистое вещество?
3) Сравните чистое вещество и смесь.
4) Классификация смесей по агрегатному состоянию.
5) Перечислите способы разделения смесей.
6) Для борьбы с болезнями растений, особенно плодовых деревьев и виноградников применяют раствор сульфата меди (II). Обычно растворяют 100 г соли на ведро воды (8 л). Какова массовая доля соли в полученном растворе? Сколько воды и соли содержится в 500 г этого раствора?
ПЛАН ЗАНЯТИЯ № 10
Дисциплина: Химия.
Тема:Дисперсные системы.
Цель занятия: Расширить представление о дисперсной системе, дисперсной фазе и дисперсионной среде, классифицировать дисперсные системы, ввести понятие о коллоидных системах.
Предметные: владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой; владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование абстрактного мышления, умение классифицировать и делать выводы, продолжить развитие химической речи, обогащать ее словарный запас при устных ответах и грамотное выполнение при самостоятельных заданиях.
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1-Понятие о дисперсной системе.
2-Дисперсная фаза и дисперсионная среда.
3-Классификация дисперсных систем.
4-Понятие о коллоидных системах.
Оснащение: периодическая система химических элементов Д. И. Менделеева, образцы различных дисперсных систем.
Литература:
Преподаватель: Тубальцева Ю.Н.
Что значит смесь в химии
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
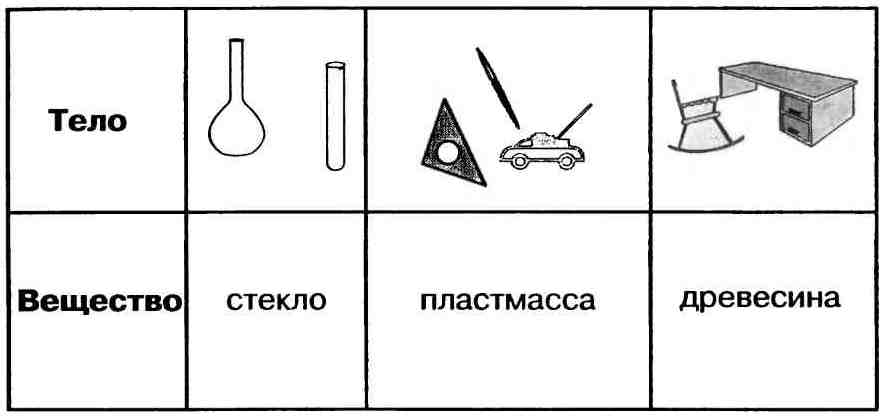
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
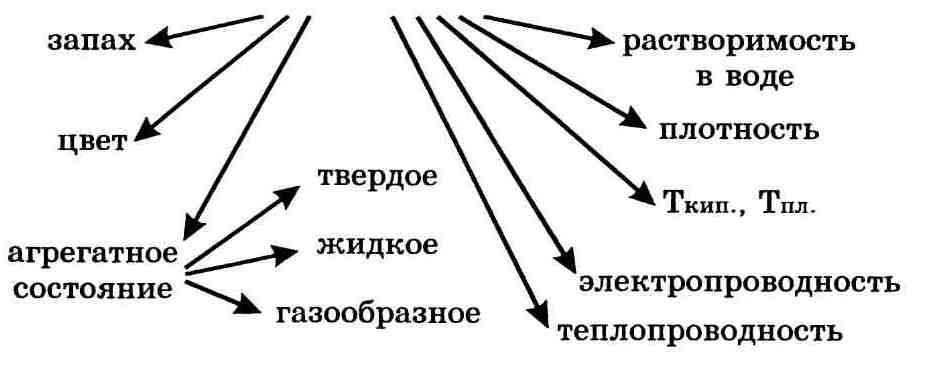
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
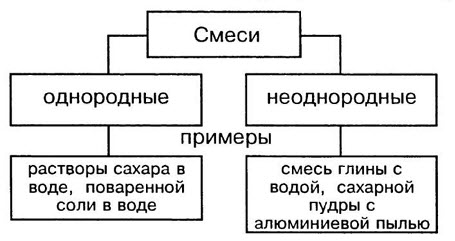
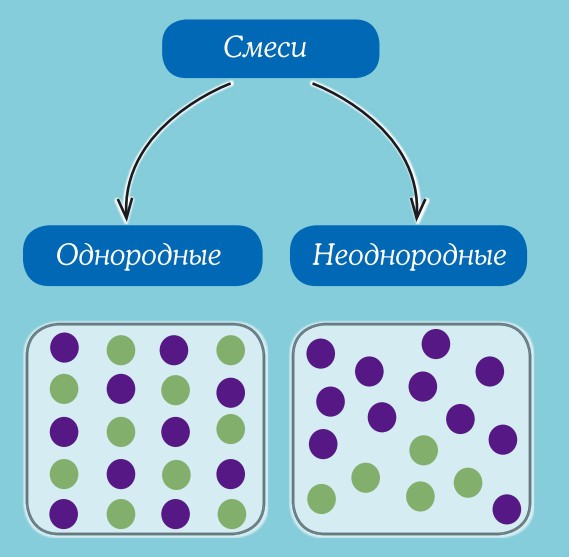
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
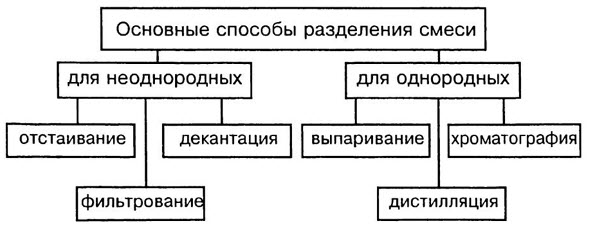
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Смешение веществ
Один из самых интересных и важных аспектов химии заключается в смешении различных веществ. Иногда во время этого процесса происходит химическая реакция и создается новое вещество. Однако очень часто химической реакции не возникает, но образуется смесь, в состав которой входят уже имеющиеся элементы.
Смеси
Что же такое смесь? Это вещество, компоненты которого перемешаны, но не соединены между собой химической связью.
На первый взгляд такое толкование может показаться довольно странным и непонятным, но давай рассуждать дальше. Если элементы вещества не связаны химически, это означает, что в любой момент их можно разъединить. Это действительно так! Например, если смешать железо с серой, то при помощи магнита можно легко извлечь частички железа, в то время как сера не будет реагировать на магнит.
Основные отличительные признаки смесей:
Виды смесей
Смеси могут быть твердыми, жидкими и газообразными. Например, воздух — это смесь газов, соленая вода — смесь жидкости и твердого вещества (соли), а бронза — смесь твердых компонентов (сплав меди и олова).
Типы смесей
Химики разделяют все смеси на две основные категории: гомогенные, или однородные, смеси и гетерогенные, или неоднородные.
В однородных компоненты равномерно распределены по всей смеси. Примеры — соленая вода, кровь, воздух. В отличие от однородных, в неоднородных смесях компоненты распределены неравномерно. Более того, каждый из них может быть виден в этой смеси. Все однородные и неоднородные смеси делятся на виды: растворы, сплавы, суспензии и коллоидные вещества.
Растворы
Раствором называется смесь, в которой одно из веществ растворено в другом. Самый простой пример раствора — соленая вода, т.е. смесь соли и воды. В данном случае вода выступает в качестве растворителя, а соль — растворимого вещества. Такой раствор очень легко разделить на исходные компоненты путем выпаривания, при этом каждый из них сохраняет свои первоначальные свойства.
Сплавы
Сплав — это смесь металлов. Один из наиболее распространенных примеров сплавов — сталь (смесь железа и углерода).
Сплавы относятся к однородным смесям.
Коллоидные и истинные растворы
В коллоидном растворе очень маленькие частицы одного вещества равномерно распределяются в другом веществе. Истинный же раствор является однородной системой, в которой растворенное вещество содержится в виде молекул.
В чем разница между коллоидным раствором и суспензией?
С течением времени частицы вещества коллоидного раствора не оседают, а продолжают либо плавать на поверхности, либо находиться во взвешенном состоянии.
Суспензии
Суспензией называется смесь жидкости и частиц твердого вещества, которые растворяются в этой жидкости не полностью. Поэтому суспензии относятся к неоднородным типам смесей. Наиболее типичные суспензии — краски, чистящие пасты, некоторые косметические средства, уличная грязь и т.д.
Главное отличие суспензии от остальных смесей заключается в том, что с течением времени, если суспензию не подвергали никакому воздействию, частички твердого вещества оседают.
Элементы, соединения и смеси. Как разобраться?
По мнению химиков, все вещества на нашей планете — это элементы, соединения или смеси. Что они собой представляют? Чем одни отличаются от других? Давай разбираться.
Элемент
Соединение
Соединение — это вещество, в составе которого находятся атомы двух и более элементов, соединенные между собой химической связью. Это означает, что в результате соединения атомов друг с другом образуется абсолютно новое вещество. Например, вода — это соединение водорода и кислорода, т.е. соединив кислород с водородом, мы можем получить воду! Стекло — это соединение кислорода, кремния, кальция и натрия.
Интересная особенность соединений заключается в том, что их химические и физические свойства отличаются от свойств образующих их атомов. Например, поваренная соль образуется во время реакции натрия с хлором. Несмотря на то, что хлор — ядовитый газ, полученное соединение — поваренная соль — не обладает опасными свойствами хлора.
Калий + марганец + кислород = марганцовка
Обычная марганцовка известна очень давно. Это вещество в виде порошка или кристаллов темно-фиолетового цвета довольно широко используется в медицине (как антисептик), промышленности, пиротехнике, садоводстве (для протравливания семян и избавления домашних растений от вредителей) и быту (для проведения дезинфекции).
Сточки зрения химии марганцовка, или перманганат калия, считается химическим соединением, в состав ко-торого входят калий, марганец и кислород.
Смеси
Смеси — это вещества, в состав которых входят элементы или соединения, не вступившие в химические реакции друг с другом. Это означает, что компоненты смеси перемешаны между собой, но не связаны химической связью, и их легко можно разделить. Например, перемешав металлические кнопки с осколками стекла, мы получим смесь. Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
А теперь давай посмотрим с точки зрения химии на тесто. Легко представить, что тесто — это тоже смесь, в состав которой входят различные «соединения»: мука, молоко, яйца, жиры, сахар и т.д.
Однако «смесью» тесто мы можем называть только до тех пор, пока оно не попало в духовку. Готовый пирог — это уже новое «соединение».
Чай с точки зрения химии
Свойства смесей
Каждый компонент смеси сохраняет свои индивидуальные химические свойства, и все компоненты могут находиться в абсолютно любых пропорциях. Например, воздух, которым мы дышим, представляет собой смесь кислорода и других веществ, количество которых может меняться в зависимости от того места, где ты находишься. Согласись, что содержание пыли, копоти и прочих вредных веществ на оживленной загазованной улице мегаполиса будет гораздо выше, чем в лесу или парке.
Смеси могут быть твердыми, жидкими и газообразными. Например, воздух — это смесь газов, соленая вода — смесь жидкости и твердого вещества (соли), а бронза — твердая смесь (сплав меди и олова).
Основные отличительные признаки смесей:
Виды однородных смесей и способы их разделения
Однородные смеси в химии — определение понятия
Смесью в химии называют систему, содержащую два или более разных вещества, которые не реагируют друг с другом.
Концентрация веществ в смеси может меняться в широких пределах. В качестве примера смеси можно привести воздух в атмосфере. Он представляет собой смесь газов, в состав которой входят:
Компоненты смеси являются веществами, входящими в состав смеси.
Выделяют следующие классы смесей:
Однородные (гомогенные) смеси — представляют собой смеси, в которых невооруженным глазом или через микроскоп не получится выявить компоненты, входящие в состав.
Примерами гомогенной смеси являются вода, в которой растворен сахар, а также воздух и превалирующая часть металлических сплавов. Все перечисленные вещества представляют собой однородные смеси.
Для приготовления однородной смеси можно добавить в стакан с водой какое-то количество сахара. В процессе интенсивного перемешивания такой массы сахар растворяется, а жидкость становится сладкой на вкус. В результате сахар не исчезает, а становится компонентом смеси. Однако происходят изменения, в результате которых кристаллы сахара невозможно рассмотреть даже с помощью мощного микроскопа. Полученная субстанция из сахара и воды представляет собой однородную смесь с равномерно перемешанными мельчайшими частицами данных веществ.
По-другому однородные смеси называют растворами. Это однородная смесь, состоящая из растворенного вещества и растворителя.
Однородные смеси отличаются по физическим свойствам. Определяющим фактором являются свойства составных компонентов. К примеру, вода кипит при 100 °C, а водный раствор соли может закипать при более высокой температуре. При охлаждении воды до температуры 0 °С, данное вещество трансформируется в лед. Раствор соли при аналогичных условиях сохраняет жидкое агрегатное состояние, а замерзание происходит при температуре ниже 0 °С.
Сплав из олова и свинца, который применяют для паяния, плавится при более низкой температуре по сравнению с чистыми металлами.
Однородной смесью также является раствор спирта и воды. Определение раствора применимо к смесям не только в жидком, но и в твердом или газообразном агрегатном состоянии.
Виды гомогенных смесей и способы их разделения
Классификация гомогенных смесей:
Воздух является гомогенной смесью газообразных веществ. Чистый воздух состоит из следующих компонентов:
Примерами однородных смесей газов являются природный газ и попутный нефтяной газ. Данные вещества состоят из газообразных углеводородов:
Растворами в распространенных случаях называют смеси веществ в жидком агрегатном состоянии. Однако термин распространяется и на газы, и на твердые вещества. В широком понимании, раствор представляет собой любую однородную смесь веществ.
Одним из самых ценных растворов природного происхождения является нефть. В результате переработки этой смеси получают следующие материалы:
Перечисленные вещества являются смесями из разнообразных углеводородов.
Для приготовления раствора требуется вещество в виде жидкости, газа или твердого материала смешать с растворителем. Роль растворяющих компонентов могут играть вода, спирт, ацетон и другие подобные вещества. Получение нашатырного спирта, к примеру, основано на растворении в воде газообразного аммиака. Получить тинктуру йода можно путем растворения кристаллического йода в этиловом спирте (этаноле).
Сплавы представляют собой твердые растворы. Данные материалы получают путем обработки металлов. Состав сплава может включать большое количество разнообразных веществ. В современном мире высоко ценятся сплавы железа в виде чугуна и стали. В чугуне содержится свыше 2% углерода, а в стали — концентрация углерода меньше.
Другими распространенными составными компонентами железных сплавов являются:
С целью придания сталям каких-либо специфических свойств используют процесс легирования, то есть вводят в состав металла особые примеси. К примеру, сталь с повышенной ударопрочностью содержит марганец в высокой концентрации. В процессе выплавки нержавеющей стали в состав материала вводят добавку в виде хрома.
В современной промышленности активно используют сплавы алюминия. Такие материалы обладают легкостью и хорошими прочностными характеристиками. Сплавы алюминия, как правило, содержат следующие компоненты:
Человек достаточно давно использует медные сплавы, что известно из истории. Бронза представляет собой сплав меди с оловом, а латунь — сплав меди и цинка. Современные технологии металлургического производства допускают применение в выплавке медных сплавов и других металлов, в том числе, алюминия, никеля, свинца.
Какими методами можно такие смеси разделить
Существует несколько основных методов разделения гомогенных смесей:
Метод выпаривания (кристаллизации) основан на различии в температурах, при которых можно наблюдать кипение растворителя и растворенного вещества. С помощью данной методики выделяют растворимые твердые вещества из раствора. В распространенных случаях технология выпаривания включает несколько стадий:
В процессе происходит постепенное испарение воды или другого растворителя. В результате на дне чаши остается твердое вещество.
Конденсация — является фазовым переходом вещества из состояния газа или пара в жидкое или твердое состояние.
В результате конденсации вещество, которое испарилось, к примеру, вода или другой растворитель, может быть собрано в виде конденсата на более холодной поверхности. Действие данного метода можно объяснить таким образом: при помещении холодного предметного стекла над выпаривательной чашей легко заметить на его поверхности воду в виде капель. По аналогичному принципу работает метод дистилляции (перегонки).
Смесь веществ нагревают, при этом компоненты при повышении температуры испаряются поочередно, начиная с самого легкокипящего. Пары компонента отводят и конденсируют, таким образом разделяют смесь.
В том случае, когда вещество, к примеру, сахар, в процессе нагрева разлагается, воду испаряют не полностью. После упаривания раствора до насыщенного состояния кристаллы сахара выпадают в осадок.
Возникают ситуации, когда необходимо удалить примеси из состава растворителей, например, очистить воду от соли. Тогда растворитель испаряют, а его пары собирают и конденсируют при понижении температуры. Данный метод разделения однородной смеси также носит название дистилляция, или перегонка.
В природном мире невозможно обнаружить чистую воду, не содержащую каких-либо примесей. Растворами солей в воде являются океаническая, морская, речная, колодезная, родниковая вода. Чистая вода без солей нередко используется в моторах автомобилей, на химических производствах, где получают разные вещества и растворы, при изготовлении фотографий. Такая вода является дистиллированной (полученной в результате дистилляции) и подходит для применения в лабораториях в процессе постановки разных химических экспериментов.
С помощью перегонки разделяют такие вещества, как:
Хроматография — является способом разделения и исследования смесей веществ.
Данный метод основан на неодинаковых скоростях, с которыми распределяется изучаемое вещество между двумя фазами:
Неподвижная фаза в распространенных случаях является сорбентом с развитой поверхностью, то есть мелкодисперсным порошком. В качестве примера можно привести оксид алюминия или оксид цинка. Подвижная фаза представляет собой поток газа или жидкости. Поток подвижной фазы фильтруется при прохождении сквозь слой сорбента, либо движется вдоль слоя сорбента, к примеру, по поверхности фильтровальной бумаги.
Рассмотреть метод хроматографии на практике и получить хроматограмму можно, если смешать некоторое количество чернил. После нанесения капли смеси на фильтровальную бумагу следует в ее середину приливать по каплям чистую воду. При этом каждая капля вносится после впитывания предыдущей. Вода выполняет функцию элюэнта, с помощью которого изучаемое вещество переносится по сорбенту в виде пористой бумаги.
Вещества, являющиеся составными компонентами смеси, задерживаются бумагой неодинаково. Можно заметить, что одни из них хорошо удерживаются, а другие — впитываются труднее и в течение некоторого времени растекаются, соединяясь с водой. После недолгого ожидания наблюдатель начнет распознавать на листе красочную хроматограмму с пятнами одного цвета в центре и разноцветными концентрическими кольцами по кругу.
В синтезе органических веществ активно используют тонкослойную хроматографию. Преимущество данного метода заключается в максимально простом и высокочувствительном способе детектирования в виде визуального контроля. Пятна, которые невозможно визуально различить, проявляются с помощью разных реактивов, а также ультрафиолетового излучения или авторадиографии.