Что значит редкий фенотип крови ccdee
Фенотип антигенов эритроцитов и индекс сенсибилизации у доноров компонентов крови и пациентов г. Астаны
Ж.К. Буркитбаев, Р.Б. Меирбекова, Е.Н. Курганская, Л.Л. Карп, Р.З. Магзумова
Научно-производственный центр трансфузиологии, г. Астана, Казахстан
Трансфузиология №2, 2013
Резюме
В результате проведенного исследования установлено большое разнообразие фенотипов в системе Резус, а также достаточно высокая степень сенсибилизации у реципиентов и высокий индекс сенсибилизации населения города Астаны.
Ключевые слова: антигенный состав эритроцитов.
Введение
Исследование распространенности у доноров основных клинически значимых антигенов эритроцитов, определение индекса аллоиммунизации является непременным условием адекватной профилактики посттрансфузионных реакций и осложнений гемолитического типа. Определение группы крови, резус-принадлежности и типирование антигенов эритроцитов имеет большое значение при проведении гемотрансфузий для подбора совместимых пар донор-реципиент и профилактики наиболее опасных для жизни реципиентов посттрансфузионных осложнений гемолитического типа [1–16]. Методика агглютинации в геле была разработана с целью стандартизации реакций гемагглютинации и получения достоверных результатов. Тестирование на индивидуальную совместимость крови донора и реципиента по антигенам эритроцитов не заменяет обязательное иммуногематологическое исследование, а лишь дополняет его. Использование гелевой системы позволяет также снизить риск заражения персонала даже при работе с потенциально инфицированными образцами [2]. Благодаря высокой чувствительности, стандартности и хорошей воспроизводимости результатов, методы агглютинации в геле получили широкое распространение [3].
Цель и задачи исследования
Целью работы явилось изучение частоты встречаемости антигенов эритроцитов и определение уровня сенсибилизации населения г. Астаны.
Материал и методы исследования
Материалом исследования служили 119882 образцов крови доноров и 6313 реципиентов за период 2010–2012 гг. Возраст доноров колебался от 18 до 60 лет. Средний возраст доноров составил 43,4±5,1 года. Возраст больных колебался от 0 до 77 лет. Средний возраст больных составил 37,9±9,5 года. Среди доноров было 64736 мужчин (54,0%) и 55146 – женщин (46,0%). Среди реципиентов мужчины составили 66,9%, женщины – 33,1%. Контингент обследованных пациентов: реципиенты, в анамнезе которых многократные трансфузии; беременные, входившие в группу риска по аллоиммунизации; дети с гемолитической болезнью новорожденных. Все образцы крови доноров исследовались на групповую принадлежность по системе АВО перекрестным методом с использованием моноклональных антител, стандартных эритроцитов, а также методом микроколоночной агглютинации с использованием кассет ORTHO BioVue. Образцы крови реципиентов исследовались на групповую принадлежность по системе АВО с применением гелевой методики Scangel. А нтиген D с истемы Р езус выявляли с помощью Цоликлона АнтиD Супер (ООО «Гематолог», Москва) и с применением метода микроколоночной агглютинации с использованием кассет ORTHO BioVue, дополнительно все RH(D)-отрицательные доноры (3464 из 119 тысяч) исследовались на наличие вариантных и слабых форм антигена D с помощью моноклональных антител анти-RH1(D)/ RhW1 в реакции Кумбса с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), «BioRad Laboratories», США). Все образцы крови доноров тестировались на наличие антигена К системы Кell с использованием моноклональных антител анти-К Супер (ООО «Гематолог», Москва) и с помощью метода микроколоночной агглютинации с использованием ORTHO BioVue анти-К. Все RH(D)-отрицательные доноры, а также «кадровые» RH(D)-положительные доноры были фенотипированы по антигенам С, с, Е, е системы Резус с использованием метода микроколоночной агглютинации с использованием кассет RH/K ORTHO BioVue, все реципиенты были фенотипированы по антигенам С, с, Е, е системы Резус с помощью гелевого метода с использованием карт Scangel Моноклональные RH/Kell производст- ва «Bio-Rad Laboratories», США. Во всех образцах крови доноров и реципиентов был проведен скрининг антиэритроцитарных аллоантител с помощью реакции Кумбса, выполненной с применением гелевой методики Scangel (Карты Scangel Кумбс анти-IgG, C3d), с эритроцитами Scangel I-II-III производства фирмы «Bio-Rad Laboratories», США-Франция). При положительных результатах скрининга проводилась идентификация анти- тел с эритроцитами ScanPanel из 10 линий клеток, «Bio-Rad laboratories», США.
Результаты и обсуждения
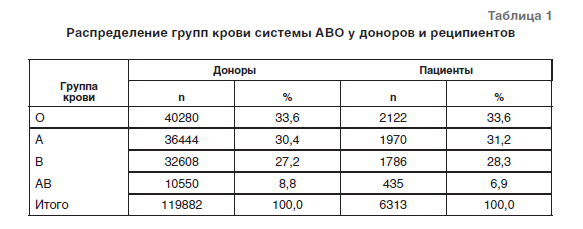
Нами было проанализировано распределение групп крови системы АВО у доноров и реципиентов (таблица 1).
Полученные данные свидетельствуют о том, что распределение групп крови по системе АВО у доноров и пациентов сходны. Преобладающими являются O и А группы крови. Выявленная нами частота встречаемости антигена А2 в группе крови А и АВ составляет для доноров 0,32%, а для пациентов 3,2%. Выявленное нами соотношение Rh(D)-положительных и Rh(D)-отрицательных лиц среди пациентов составило 94,39 и 5,6% соответственно. Для доноров это соотношение составило 92,43% Rh(D)-положительных и 7,57% Rh(D)-отрицательных (табл. 2).
Полученные нами данные выявили значительно больший процент антигена D вариантного у пациентов. Возможно, это является результатом ослабления антигена D при заболеваниях. Изучение антигенного состава эритроцитов кадровых доноров и пациентов показало, что наиболее распространенным фенотипом среди Rh(D)-положительных лиц является фенотип CCDee-, далее следуют фенотипы CcDee-, CcDEe- и ccDEe- (табл. 3).
Наибольшую опасность представляют в трансфузионном отношении гомозиготные сочетания антигенов системы Резус (СС, сc, ЕЕ и ее), которые встречаются у 86% резус-положительных (D+). Всем донорам и реципиентам независимо от групповой и резус- принадлежности предварительно проводился скрининг на наличие антиэритроцитарных антител. При оценке антиэритроцитарных антител у 13,3% пациентов обнаружены иммунные антитела различной специфичности. В связи с тем, что среди контингента обследованных в лаборатории лиц превалировали беременные, входившие в группу риска по аллоиммунизации, а также больные получившие многократные трансфузии, – индекс сенсибилизации у пациентов оказался высоким. Антитела к антигенам эритроцито системы Резус появляются в организме в результате трансфузий эритроцитов доноров, содержащих антигены, отсутствующие у реципиента, а также при иммунизации матери эритроцитами плода. Частота встречаемости аллоантител к антигенам эритроцитов системы Резус различна и определяется иммуногенностью антигена и частотой встречаемости в популяции. В 31% случаев антитела не идентифицировали, что связано с сочетанной специфичностью антител или наличием антител к широко распространенным в популяции антигенам. При изучении частоты аллосенсибилизации среди RH(D)-положительных и RH(D)-отрицательных лиц, было обнаружено, что RH(D)-отрицательные люди иммунизируются в 2–2,5 раза чаще, чем RH(D)-положительные. Антитела к минорным антигенам эритроцитов чаще встречаются у резус-положительных лиц, чем у резус-отрицательных. У доноров встречаемость аллоантител составила 0,46% (табл. 4).
Проблема гемолитической болезни новорожденных (ГБН) для города Астана актуальна. Наиболее часто ГБН развивается вследствие конфликта по антигенам системы Резус и АВ0 (табл. 5).
СКРИНИНГ АНТИЭРИТРОЦИТАРНЫХ АНТИТЕЛ И ДРУГИЕ ПРАКТИЧЕСКИЕ ВОПРОСЫ ИММУНОСЕРОЛОГИИ
Жибурт Е.Б., Попова В.И., Иванова И.В., Рейзман П.В.
Центр крови Минздрава России, Москва
В целях профилактики трансфузионных осложнений и аллоиммунизации рекомендуется практика определения антиэритроцитарных антител у доноров и использование тестов повышенной чувствительности для выявления очень слабых аллоантител [1, 3, 6].
Скрининг антиэритроцитарных аллоантител имеет важное клиническое значение для предупреждения развития гемолиза донорских эритроцитов, выявления аллосенсибилизированных лиц, профилактики гемолитической болезни новорожденных по антигенам системы группы крови Резус и антигенам других систем.
Методика гелевой технологии разработана Lapierre в 1990 году [1]. ID-гелевая система представляет собой пластиковые карты с микропробирками, заполненными гелем, к которому добавляются эритроциты и сыворотки. Пробирки с нейтральным гелем содержат модифицированный Sephadex с буфером и предназначены для скрининга антител. После центрифугирования в специальной центрифуге агглютинированные эритроциты задерживаются в верхних слоях геля, в то время как неагглютинированные эритроциты, беспрепятственно пройдя через гель, образуют осадок на дне пробирок. Положительные реакции наглядно отличаются от отрицательных, и могут быть разделены по силе реакции, как и при стандартных методах.
Материалы и методы
Для параллельного исследования сывороток применялись непрямая проба Кумбса в растворе низкой ионной силы (Liss-Coombs) для гелевой технологии (Diamed, Швейцария) и желатиновый метод с 10% раствором желатина (ФГУП «Мосхимфармпрепараты» имени Н.А.Семашко, Москва).
Результаты и обсуждение
Антиэритроцитарные антитела обнаружены 8 сыворотках доноров (1,4 %). Из них в желатиновом методе в 7 случаях наблюдался отрицательный результат.
Лишь в одном случае (донор Г. №8 АII Rh+) аллоантитела выявлены как желатиновым методом, так и гелевой технологией. Однако, чувствительность реакции при скрининге антител желатиновым методом (+) ниже, чем в гелевом тесте (++) (таблица 2).
Различия в распределении аллоиммунизации в зависимости от пола доноров и больных не выявлено (p>0,05).
Использование панели из трех эритроцитов в сочетании с информацией о фенотипе донора/пациента позволяет лишь предположить специфичность выявленных антиэритроцитарных антител. Для точной идентификации необходима расширенная панель эритроцитов.
Установлено, что гелевый тест является простым, быстрым и очень чувствительным методом, который сводит к минимуму ошибки, встречающиеся при использовании традиционных методик. Исследование гелевой технологией аллоантител к антигенам эритроцитов у доноров (не имеющих антител) проводят 1 раз в год [2], при отсутствии в анамнезе переливаний крови. У доноров-женщин репродуктивного возраста желательно проводить исследования антиэритроцитарных аллоантител не менее 2 раз в год.
При обнаружении нерегулярных тепловых антиэритроцитарных аллоантител все компоненты крови донора, за исключением отмытых эритроцитов, не должны быть использованы для переливания.
У больных необходимо исследовать наличие антиэритроцитарных аллоантител перед проведением каждой гемотрансфузии, и обязательно перед выпиской из стационара (через 15-30 дней после переливания эритроцитов) для определения сенсибилизации антигенами эритроцитов и дачи соответствующих рекомендаций. Если реципиенту была проведена даже одна трансфузия эритроцитсодержащих компонентов, то в последующем он попадает в группу «риска», т.к. в большинстве случаев, к сожалению, переливание проходит без типирования антигенов эритроцитов, и организм может быть сенсибилизирован отсутствующим у человека эритроцитарным антигеном. При повторном переливании донорских эритроцитов (попадании того же чужеродного антигена), возможен быстрый иммунный ответ с выработкой антиэритроцитарных аллоантител и развитием внесосудистого гемолиза.
Поиск антител после гемотрансфузии зачастую не проводится, поскольку не влияет на результат данной госпитализации и завершающегося лечения. Однако он весьма значим для последующей жизни пациента, поскольку спустя какое-то время антитела могут перестать выявляться, но сохранятся T-клетки «памяти». При необходимости переливания крови в будущем новый контакт с сенсибилизирующим антигеном будет сопровождаться бурным гуморальным иммунным ответом с возможной гемолитической трансфузионной реакцией.
В действующих документах Минздрава России нет единой точки зрения на обеспечение совместимости донора и реципиента по антигенам системы Келл (таблица 4). Серьезные проблемы создает неудачная формулировка [3] «В целях профилактики посттрансфузионных осложнений, обусловленных антигеном Келл, отделения и станции переливания крови выдают для переливания в клинику эритроцитную взвесь или массу, не содержащие этого фактора. Келл положительным реципиентам могут быть перелиты Келл положительные эритроциты». Очевидно, что первое предложение исключает второе, а значит, во-первых, ведет к уничтожению Келл-положительных эритроцитов (6-8 % всех заготовленных доз) и, во-вторых, увеличивает риск посттрансфузионного гемолиза, обусловленного антигеном k (Cellano).
При организации скрининга антиэритроцитарных антител, как и для решения многих других проблем современной трансфузионной медицины имеет важное значение оптимальное распределение ресурсов. Относительные затраты на одно исследование (амортизация оборудования, гелевые карты, панели стандартных эритроцитов) снижаются по мере увеличения количества исследований. Необходимо максимально централизовать иммуногематологические исследования, как это предусмотрено Концепцией развития службы крови в Российской Федерации в 2004-2010 годы [4].
Донор должен быть информирован о выявленных антителах. Эту информацию необходимо внести в индивидуальную медицинскую документацию и использовать при возможных переливаниях крови в будущем.
Выводы
1. Для скрининга антиэритроцитарных аллоантител оптимально использовать гелевый тест.
2. Целесообразно проводить поиск антиэритроцитарных антител спустя 2-4 недели после гемотрансфузии и сохранять данные об аллоиммунизации в медицинской документации пациента.
3. Целесообразно выносить на этикетку гемоконтейнера данные о фенотипе донора по системам групп крови Резус и Келл,
4. У Келл-положительных реципиентов оптимально использование Келл-положительных донорских эритроцитов.
5. Для индивидуального выбора донора крови в заявке на гемокомпоненты целесообразно указывать фенотип реципиента.
Литература
1. Жибурт Е.Б. Трансфузиология: учебник.- СПб: Питер, 2002.- 736 с.
2. Инструкция по предупреждению посттрансфузионных осложнений, обусловленных факторами Кеll и с(hr’) (утв. приказом Минздрава России от 9 января 1998 г. № 2)
3. Инструкция по применению компонентов крови (утв. приказом Минздрава России от 25 ноября 2002 г. № 363)
4. Решение Коллегии Минздрава РФ и Президиума Российской академии медицинских наук от 11 ноября 2003 г. «О Концепции развития службы крови в Российской Федерации» (протокол N 16)
5. Техническое руководство американской ассоциации банков крови/ Пер. с англ.- Милан: Европейская школа трансфузионной медицины, 2000.- 1035 с.
6. Требования к проведению иммуногематологических исследований доноров и реципиентов на СПК и в ЛПУ/ Методические указания Минздрава России от 11 апреля 2002 г. № 2001/109)
Гид по крови. Мифы и правда о донорстве

СКОЛЬКО КРОВИ В ЧЕЛОВЕКЕ
Расскажите для начала, сколько всего крови в человеке и сколько ее можно сдать в качестве донора?
В зависимости от пола, возраста и телосложения объем циркулирующей крови (ОЦК) на 1 кг массы тела колеблется от 50 до 80 мл на килограмм веса. ОЦК можно посчитать по формуле: масса тела * 77. Например, если человек весит 56 кг, то его объем крови будет равен 4,31 л. При этом сдать в качестве донора можно не более 12% этого объема.
Но вообще стандартный объем заготовки крови — 450 мл, без учета крови, взятой для анализов — еще до 40 мл.
СРОК ХРАНЕНИЯ
А что происходит с кровью, которую сдают доноры? Мы слышали, что довольно значительная часть ее просто утилизируется, грубо говоря, выливается в унитаз. В каких случаях так происходит?
Обычно, говоря о донорстве, чаще всего имеют в виду процедуру сдачи цельной крови. Во время этой непродолжительной и не вызывающей даже незначительного дискомфорта процедуры из кровеносного русла донора извлекают в специальный пластиковый контейнер около 450 мл крови.
При этом у донора сверх этого отдельно забирают около чтобы позже провести обследования в специальных лабораториях и определить ее принадлежность к определенной группе крови и резус-фактор, биохимические показатели, а также маркеры вируса иммунодефицита (ВИЧ), гепатита В и С и сифилиса.
Сразу после сдачи крови ее разделяют на компоненты — эритроциты, тромбоциты и плазму.
ВРЕД МАССОВОЙ СДАЧИ КРОВИ
Сейчас часто бывает, что после терактов или бедствий разворачиваются различные пункты приема крови, кто-то зарабатывает политические очки на этом. Люди же думают, что их кровь напрямую будет переливаться жертвам. Есть ли смысл идти и становиться донором в таких ситуациях?
На случай чрезвычайных ситуаций в учреждениях службы крови постоянно поддерживается неснижаемый запас компонентов крови. При необходимости резервы немедленно обеспечат потребность для лечения весьма большого количества пострадавших. Именно резерв — ранее заготовленные от регулярных доноров компоненты крови, протестированные в полном объеме и готовые к переливанию ‑ расходуется в первую очередь при ликвидации последствий чрезвычайных ситуаций.
В период катастроф обычно происходит массовый приток доноров. Такой наплыв несет опасность создания запасов невостребованной крови. Самое досадное, что краткосрочная донорская активность не улучшает ситуацию с повседневной нехваткой компонентов крови,а иногда даже ухудшает.
РЕДКАЯ КРОВЬ
Правда ли, что бывают особо редкие виды крови, содержащие некий уникальный набор элементов и что такая кровь особенно востребована? Есть ли нехватка какого-то конкретного вида крови (группа/резус, что-то еще)?
Вся кровь разделяется по принципу групповой принадлежности (группы крови системы АВО), основанной на комбинациях эритроцитарных антигенов А и В — I (O), II (A), III (B) и IV(AB), а также по резус-фактору — антиген, который находится на поверхности эритроцитов. Около 85% людей имеют этот самый резус-фактор и являются резус-положительными (Rh+). Остальные 15% являются резус-отрицательными (Rh-).
Существуют так называемые редкие фенотипы — определенный набор буквенных показателей. Но ни в коем случае нельзя говорить о какой-то особой востребованности данного фенотипа. Ведь если фенотип редкий, соответственно и людей с таким фенотипом мало и крови им надо также мало.
Специалисты, работающие в учреждениях переливания крови, сходятся во мнении, что считать IV группу крови с Rh+ и Rh редкой — неправильно. Каждый день потребность клиник в компонентах крови определенной группы меняется. В какой-то момент «редкой» может стать и I, и II группы крови, если количество запросов на компоненты данной группы, поступающих от ЛПУ, будет превышать возможности учреждения переливания крови.
С полной версией интервью Вы можете ознакомиться в блоге ЗОЖНИК.
Группа крови
Под группами крови понимают различные сочетания антигенов эритроцитов (агглютиногенов).
Антигены групп крови расположены на внешней поверхности мембраны эритроцитов и являются генетическими признаками, наследуемыемыми от родителей и не изменяющимися в течение жизни (могут изменяться только при патологических состояниях).
На сегодняшний день известно около 270 антигенов эритроцитов, которые образуют 26 систем антигенов группы крови. Важное значение имеют наиболее иммуногенные (иммуногенность — способность вызывать осложнения после переливания компонентов крови) антигены, в первую очередь систем АВ0, Rh (Резус), Кеll и др.
Фенотип антигенов эритроцитов человека включает в себя набор антигенов разных систем групп крови, расположенных на поверхности эритроцитов. Этот набор для каждого человека индивидуален. Поэтому при переливании крови и эритроцитарной массы необходимо учитывать совместимость не только по эритроцитарным антигенам систем АВ0 и Резус, но и по антигенам других систем.
Группа крови системы АВ0
Система АВ0 — первая эритроцитарная система антигенов — открыта венским ученым Карлом Ландштейнером в 1900 г. Чуть позднее, в 1907 г, и независимо от Ландштейнера чешский врач Ян Янский пришел к заключению о существовании четырех групп крови. С этого времени и по сей день определение групп крови по данной системе основывается на наличии в эритроцитах группоспецифических антигенов (0,А,В), а в сыворотке — изоиммунных антител — анти-А (α — устаревшее название) и анти-В (β — устаревшее название).
Группоспецифические антигены — 0, А, В – генетически обусловлены. Один из трех аллельных генов передается от матери, другой — от отца. Различные сочетания этих антигенов и антител образуют четыре группы крови. В нашей стране, как и в некоторых других, принято буквенно-цифровое обозначение групп крови — 0 (I), А (II), В (III), АВ (IV). Группа крови в течение всей жизни не меняется. Уникальность системы АВ0 состоит в том, что в плазме у людей имеются естественные антитела к отсутствующему на эритроцитах антигену.
Следует отметить, что существуют различные виды (слабые варианты) как антигена А (в большей степени), так и антигена В. Наиболее часто встречаются виды антигена А – А1 и А2.
Частота встречаемости групп крови по системе АВ0 различна у разных народов и зависит от частоты распространения соответствующего фенотипа. Частота встречаемости групп крови (среднеевропейская популяция): 0 (I) — 43%, А (II) — 42%, В (III) — 11%, АВ (IV) — 4%. У жителей азиатских стран антиген 0 встречается реже, а у народов Севера, аборигенов Полинезии, Австралии и индейцев Южной Америки значительно чаще, чем у жителей Европы. По мере продвижения с запада на восток уменьшается встречаемость антигена А и возрастает частота антигена В.
Группа крови системы Резус
Система антигенов Резус представлена 6 антигенами, которые наследуются и не меняются в течение всей жизни. После антигенов АВ0 система антигенов Резус имеет наибольшее значение в клинической практике. Антигены системы резус встречаются со следующей частотой: Д – 85 %; С – 70 %; с – 80 %; Е – 30 %; е – 97,5%. Антигены системы резус обладают способностью вызывать образование иммунных антител. Наиболее активным в этом отношении является антиген Д, который и подразумевается под термином «резус – фактор». Именно по наличию или отсутствию антигена Д все люди делятся на резус – положительных и резус – отрицательных.
Иммуногенность других антигенов системы резус существенно ниже и убывает в следующем ряду: с > Е > C > е. Обладая выраженными иммуногенными свойствами, антиген D в 95 % случаев является причиной гемолитической болезни новорожденных при несовместимости матери и плода, а также частой причиной посттрансфузионных осложнений.
Доноры, на эритроцитах которых отсутствует антиген Д, но присутствует один из антигенов С или Е, считаются резус – положительными.
В системе Резус встречаются случаи отсутствия на эритроцитах какого-либо из антигенов и очень редко – полное отсутствие всех антигенов системы резус (фенотип Rh – ноль).
Из-за сложной структуры антигенов системы резус существует возможность возникновения трудностей при определении резус – принадлежности крови человека. Не правильное определение резус – принадлежности может привести к развитию осложнения после переливания компонентов крови, несовместимых по антигенам Резус.
Частота резус-положительных лиц достигает среди европейцев 85%, а среди монголоидов — 99%.
Другие системы групп крови:
Система антигенов Kell
В настоящее время насчитывается 24 антигена системы Kell, наибольшее клиническое значение имеет антиген К из-за высокой иммуногенности. Антиген К был открыт в 1946 году, частота встречаемости 7 – 9 %. Иммуногенная активность антигена К несколько ниже активности антигенов Резус. Сенсибилизация к фактору К может явиться причиной гемолитического трансфузионного осложнения или гемолитической болезни новорожденных, а также аутоиммунной гемолитической анемии. В настоящее время скрининг на антиген К проводится у всех доноров и при его наличии эритроцитная масса передается в относительный брак.
Система антигенов МNSs
Открыта в 1927 году, в настоящее время насчитывает 38 антигенов. Наибольшее клиническое значение имеют антигены N и S.
Система антигенов Р
Р антиген является антигеном высокой встречаемости — 80 %. Описано только два случая отсроченных осложнений после переливания крови, несовместимой по данному антигену.
Система антигенов Лютеран
Насчитывает 20 антигенов, наиболее изучены имеющие клиническое значение антигены Lua и Lub, так как они могут явиться причиной посттрансфузионной реакции и гемолитической болезни новорожденных (в легкой форме).
Система антигенов Льюис
Включает 4 антигена — Lеa, Lеb, Lec и Lеаb. Льюис антитела не вызывают развитие гемолитической болезни новорожденных и редко являются причиной посттрансфузионной реакции. В последние годы установлено, что антиген Льюис участвует в воспалительном процессе. Лица с фенотипом Lea-b- имеют дефект противоинфекционной резистентности, а так же обладают повышенным риском к возникновению ишемической болезни сердца (ИБС). У мужчин с фенотипом Lea-b- зарегистрировано повышение индекса массы тела, увеличение частоты заболеваемости сахарным диабетом.
Система антигенов Даффи
Система антигенов Кидд
Включает 2 антигена, антитела к антигенам этой системы имеют клиническое значение, вызывают посттрансфузионные осложнения немедленного или отсроченного типа.
Система антигенов Диего
Малоизученная система эритроцитарных антигенов. Известно два аллельных антигена Dia и Dib. Для европоидов антиген в гемотрансфузионном отношении не имеет большого значения, т. к. отсутсвует практически у всего белого населения.
Часто встречающиеся (общие) и редко встречающие эритроцитарные антигены:
К часто встречающимся относятся антигены (Vel, Ge, Lan, San и др.), частота выявления которых около 100%. Практически не имеют какого-либо значения для гемотрансфузий.
Редко встречающиеся эритроцитарные антигены — Wpa, Bi, By, Ba. Значение таких антигенов в практической трансфузиологии незначительно, поскольку повторных гемотрансфузий, несовместимых по этим антигенам, ничтожно мало.