Что значит при беременности оага что это
Беременность высокого риска
В центре иммунологии и репродукции мы ведём как физиологическую беременность, так и беременность высокого риска.
К беременности высокого риска относится:
Сопутствующие заболевания
Наши врачи ведут беременность на фоне аутоиммунных состояний в сотрудничестве с ревматологами. В ЦИР большой исторический опыт наблюдения за такими пациентками, ведь много лет мы работали в институте ревматологии. Мы провели беременность у многих пациенток с антифосфолипидным синдромом, системной красной волчанкой. В этом случае беременность ведется по определенным схемам.
У нас было много пациенток с эпилепсий. Мы ведём такую беременность в связке с врачом неврологом. Важно тщательное наблюдение за состоянием здоровья плода.
Заболевания щитовидной железы, гестационный сахарный диабет, заболевания мочевыводящей системы курируются нашими специалистами – эндокринологом, урологом. При необходимости подключается врач генетик.
Отягощенный акушерский анамнез
В нашу клинику часто обращаются за экспертным мнением при отягощенном акушерском анамнезе: преэклампсия, антенатальная гибель плода в прошлом, нарушения плацентарной функции. Факторы риска этих осложнений часто совпадают с бесплодием неясного генеза и невынашиванием беременности. В этом случае мы проводим углубленное обследование на тромбофилические состояния, выявление аутоиммунных антител, оценку рисков нарушений сосудистого тонуса.
Ведение осложненной беременности: принципы ЦИР
Лицензия № ЛО-77-01-013791 от 24.01.2017
Центр иммунологии и репродукции © ООО «Лаборатории ЦИР» 2006–2021
Версия для слабовидящих в разработке
Лечение плацентарной недостаточности
Предсказание риска задержки внутриутробного развития и/или гипоксии плода либо их своевременное выявление чрезвычайно важны для предупреждения и коррекции этих осложнений. Для оценки состояния плаценты особенно широко используется определение в крови пептидных гормонов и специфических белков беременности.
Совместно с НИИ морфологии человека РАМН мы исследуем динамику плацентарных белков у женщин с герпесвирусными инфекциями.
При подготовке к беременности в сыворотке крови с 26 дня менструального цикла до 2 дня менструации и/или во время менструации в менструальной крови определяется концентрация АМГФ (альфа-2-микроглобулин фертильности, РР14).
Во время беременности в первом триместре определяются:
Во втором триместре определяются:
В третьем триместре определяются:
АМГФ (альфа-2-микроглобулин фертильности, РР14)
Определение содержания АМГФ в кровянистых выделениях матки после ранних самопроизвольных абортов показало, что при потере беременности концентрация АМГФ в 50-100 раз превышает уровень белка в нормальной менструальной крови. Поэтому тест на АМГФ может быть использован для дифференциальной диагностики маточных кровотечений и установления причины женского бесплодия. Резкое увеличение содержания АМГФ в сыворотке крови отмечается при тяжелом эндометриозе. При хроническом эндометрите отмечено уменьшение содержания АМГФ в эндометриальном секрете в среднем в 5 раз по сравнению с нормой. Это уменьшение было особенно выраженным при хроническом эндометрите с недостаточностью лютеиновой фазы (более чем в 20 раз по сравнению с нормой). При ановуляторном цикле АМГФ в секрете эндометрия не обнаружен.
При наступлении беременности содержание АМГФ в сыворотке быстро увеличивается, достигая максимума между 6 и 12 неделями. После 16 недель концентрация АМГФ уменьшается и выходит на плато начиная с 24 недель беременности. В первом триместре уровень АМГФ в сыворотке крови матери перестает нарастать или падает при угрозе невынашивания беременности еще до начала клинических проявлений. Так как уровень АМГФ чрезвычайно индивидуален, целесообразно его исследование в первом триместре в динамике 2-3 раза с интервалом в 2-3 недели.
ТБГ(трофобластический бета-1-гликопротеин)
ТБГ – специфический белок беременности и связанных с нею заболеваний (пузырный занос, хорионэпилиома), синтезируется клетками цито- и синцитиотрофобласта и секретируется в кровоток матери. ТБГ обнаруживается в сыворотке крови на протяжении всей беременности, начиная с самых ранних сроков. По мере развития физиологической беременности уровень ТБГ в сыворотке крови постоянно возрастает, достигая максимума к 35-38 неделям. Наблюдается отсутствие положительной динамики или снижение концентраций ТБГ в сыворотке крови беременных женщин по сравнению с нормой:
Уровень ТБГ в сыворотке крови матери резко возрастает при многоплодии, сахарном диабете, гемолитической болезни плода, перенашивании беременности.
В связи с широким диапазоном индивидуальных концентраций ТБГ, рекомендуется его исследование в динамике 2-3 раза с интервалом в 1-2 недели.
Плацентарный альфа-1-микроглобулин (ПАМГ)
Повышенный уровень ПАМГ-1 является:
Задержка внутриутробного роста плода при повышенном уровне ПАМГ-1 может быть обусловлена нарушениями развития и созревания плаценты. Ряд исследователей рассматривают ПАМГ-1 как естественный «материнский» регулятор инвазивности трофобласта. Вероятно, что в аномально высоких концентрациях ПАМГ препятствует нормальному внедрению цитотрофобласта в спонгиозный слой эндометрия и ограничивает рост трофобласта ворсинчатого хориона.
Концентрация ПАМГ-1 в материнской сыворотке в норме не превышает 40 нг/мл на протяжении всей беременности. Для выявления фетоплацентарных нарушений рекомендуется исследовать сыворотку крови матери, начиная с 16-17 недели беременности до 33-35 недель беременности.
Наш медицинский центр оказывает самый широкий спектр услуг. Вы всегда можете обратится к нам по вопросам ведения беременности. Мы готовы оказать вам услуги ведения беременности после эко и ведения поздней беременности.
Что значит при беременности оага что это
Значение акушерского анамнеза очень велико для текущей беременности. И хотя это понятие не получило официального признания в медицинских справочниках, где есть понятия наследственного анамнеза, профессионального, социального и эпидемиологического, ни один врач-акушер не будет отрицать значимость ОАА.
Все эти особенности должны быть учтены для того, чтобы максимально снизить развитие патологий у следующего плода. Если рассматривается вопрос о кесаревом сечении, то доводы врача должны быть подкреплены, к примеру, рентгенографией плода.
Своевременное выяснение причин мертворождения и детской смертности в перинатальном периоде оказывает положительное влияние на ведение других беременностей и родов. Часто мертворождение и врожденные пороки имеют сразу несколько причин: к примеру, внутричерепная травма при рождении крупного плода у женщины с анатомически узким тазом, несовместимость матери и ребенка по резус-фактору, роды в зрелом возрасте при наличии гемолитической болезни новорожденных (несовместимость крови матери и ребенка по антителам).
Женщины с диагнозом «отягощенный акушерский анамнез» (ОАА) в России
Число женщин в России с диагнозом ОАА составляет около 80%, причем, количество это из года в год не уменьшается и держится на одном уровне. На этом фоне частота угрозы прерывания беременности также остается высокой. Каждая четвертая женщина по несколько раз в течение всей беременности проходит курс лечения в акушерском стационаре.
Хроническая гипоксия плода диагностируется практически у всех больных беременных. Это состояние связано с тем, что кислород поступает к плоду в меньших количествах или не поступает вообще. В результате в организме плода накапливается углекислота и недоокисленные продукты обмена.
В отягощенном акушерском анамнезе существует термин «невынашивание беременности». Им обозначают самопроизвольное прерывание беременности на сроке до 37 недель. Частота возникновения этой патологии может достигать в первом триместре до 50%, во втором — до 20%, в третьем — до 30%.
Невынашивание беременности в сроки от зачатия до 22 недель называется самопроизвольным выкидышем. Преждевременные роды обозначают рождение незрелого, но жизнеспособного ребенка массой до 2.5 кг и ростом до 45 см. Факторы, влияющие на невынашивание беременности, можно разделить на несколько групп.
К ним относят низкое социально-экономическое положение, низкий доход, низкий уровень образования, недостаточное питание, работу, связанную с физическими нагрузками и стрессом.
Данные акушерско-гинекологического анализа
Возраст роженицы младше 16 и старше 30 лет (это относится к первородящим матерям), отягощенный акушерский анамнез.
Сахарный диабет, заболевания сердечно-сосудистой системы, бронхиальная астма, артериальная гипертензия, заболевания почек, продолжительное курение, а также употребление алкоголя и наркотических веществ.
Осложнения текущей беременности
Тазовое прилежание плода, внутриматочная инфекция, внутриутробное инфицирование плода, сильные токсикозы первого триместра, поздние токсикозы, отслойка плаценты.
Пренатальная (дородовая) диагностика врожденной патологии плода
Рождение здорового ребенка – естественное желание каждой беременной женщины. Но, к сожалению, надежды на счастливое материнство не всегда оправдываются. Около 5% новорожденных имеют различные врожденные заболевания. Скрининг в 1 и во 2 триместрах беременности позволяет определить, насколько велик риск врожденной патологии у будущего ребенка.
В настоящее время существуют достаточно эффективные методы пренатальной (дородовой) диагностики многих заболеваний плода, которые можно выявить с 11 недели беременности. Своевременное проведение скрининговых обследований дает возможность определить большой спектр патологии плода и увидеть ультразвуковые признаки хромосомных аномалий.
Что такое ранний пренатальный скрининг и когда он проводится
Скрининг (от англ. «просеивание») – это совокупность исследований, позволяющих определить группы беременных, у которых существует риск рождения ребенка с хромосомными аномалиями и врожденными пороками. Но ранний скрининг – это только начальный, предварительный этап обследования, после которого женщинам, с выявленным риском врожденных аномалий, рекомендуется более детальное диагностическое обследование, которое точно подтвердит или исключит наличие патологии.
Что включает в себя ранний пренатальный скрининг
В комплексное обследование входят:
Полученные данные: анамнез, УЗИ и биохимические маркеры помещают в специально разработанную программу Astraia, которая рассчитывает риск рождения ребенка с врожденными аномалиями. Комбинация данных исследований увеличивает эффективность выявления плодов с синдромом Дауна и другими хромосомными заболеваниями.
Что такое программа Astraia
Astraia – это профессиональная программа, вычисляющая вероятность хромосомных аномалий у плода. Программа была разработана Фондом Медицины Плода (Fetal Medicine Foundation – FMF) в Лондоне и успешно апробирована на огромном клиническом материале во многих странах мира. Она постоянно совершенствуется под руководством ведущего специалиста в области пренатальной диагностики профессора Кипроса Николаидеса, в соответствии с последними мировыми достижениями в области медицины плода.
Специалист, проводящий ранний пренатальный скрининг, должен иметь международный сертификат FMF, дающий право на выполнение данной диагностики и работу с программой Astraia. Сертификат подтверждается ежегодно после статистического аудита проделанной за год работы и сдачи сертификационного экзамена. Таким образом обеспечивается высокая диагностическая точность полученных рисков.
Проведение раннего пренатального скрининга с помощью данной программы регламентировано приказом Министерства Здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство-гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Ранний пренатальный скрининг позволяет вычислить следующие риски:
Что оценивается при УЗИ в 1 триместре
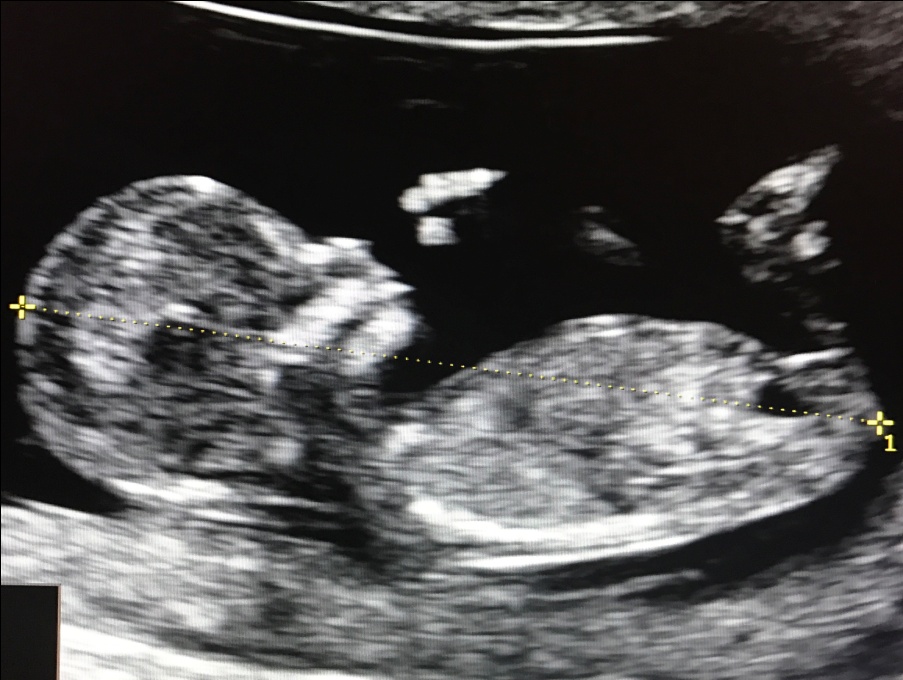
1. Копчико-теменной размер (КТР) плода
Правильное измерение КТР плода
2. Маркеры хромосомной патологии:
— толщина воротникового пространства (ТВП) – является основным признаком хромосомной патологии у плода. Патологической величиной считается увеличение ТВП больше 95-й процентили для каждого срока гестации. Каждое увеличение ТВП повышает риск существования хромосомной аномалии у плода.
ТВП в норме ТВР при патологии
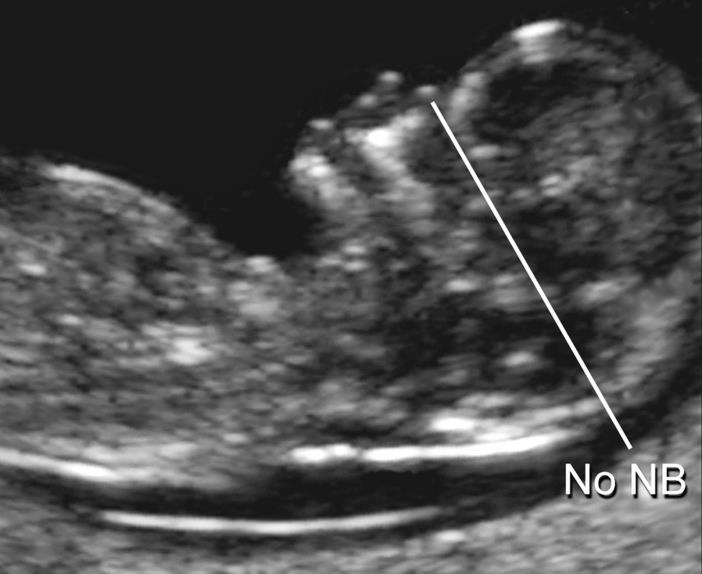
— носовая кость. У плодов с синдромом Дауна носовая кость может отсутствовать, либо быть уменьшенной (гипоплазированной). Очень редко такое может встречаться и у совершенно здоровых детей. Точный диагноз устанавливается только при помощи генетического анализа.
Нормальная носовая кость Отсутствие носовой кости
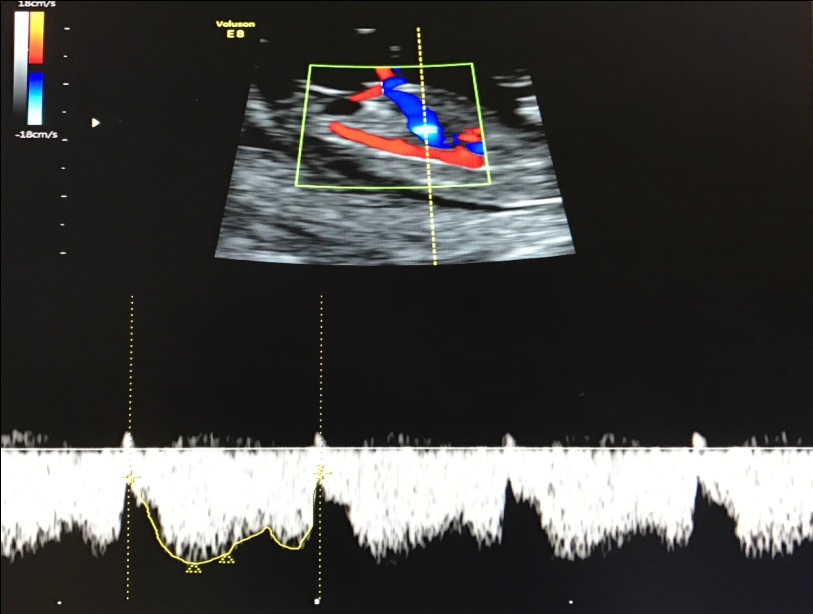
— кровоток в венозном протоке – это маленький сосуд в печени плода. При обратном (ретроградном) токе крови в данном сосуде можно предположить, что у плода хромосомный синдром, либо врожденный порок сердца.
Нормальный кровоток в венозном протоке
Но важно правильно получить этот кровоток и дать ему оценку. Для этого требуются определенные навыки и квалификация врача, которые подтверждаются ежегодной сертификацией FMF.
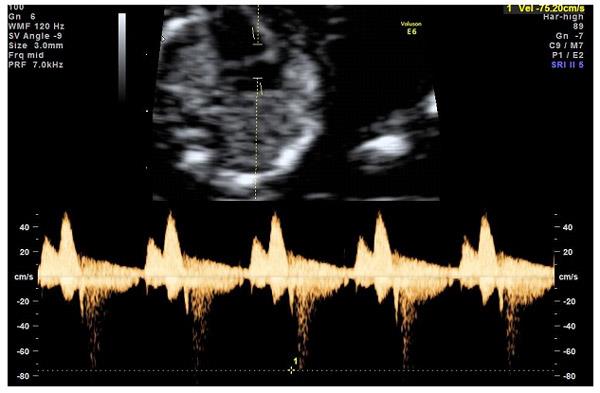
— кровоток через трикуспидальный клапан в сердце плода. Здесь ретроградный (обратный) кровоток тоже указывает на хромосомную патологию, либо может проявляться при врожденных пороках сердца.
3. Анатомические структуры плода и исключение крупных врожденных пороков
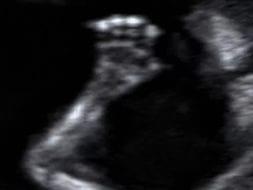
Ручка плода Мозг плода в виде “бабочки” в норме
4. Длина шейки матки
5. Стенки матки и придатков (яичников)
6. Кровоток в маточных артериях
УЗИ может проводиться как трансабдоминально, так и трансвагинально.
Что делать при высоком риске хромосомной патологии у плода
Если комплекс раннего пренатального обследования указывает на высокий риск врожденной патологии у плода, Вам будет рекомендована консультация генетика с последующей инвазивной диагностикой (биопсия ворсин хориона на сроке до 14 недель или амниоцентез, проводимый после 16 недель) и генетическим анализом. Именно генетический анализ точно определяет хромосомные заболевания и врожденные патологии у плода.
Что представляет собой скрининг во втором триместре беременности
Согласно приказу № 572н от 1.11.2012 г., второй скрининг состоит из ультразвукового исследования плода на сроке 18-21 неделя беременности. В этом возрасте кровь на биохимические маркеры уже не сдается. Плод имеет массу около 300-500 грамм и длину 20-25 см, и УЗИ позволяет детально проанализировать все анатомические структуры плода и выявить большинство пороков развития. Тогда же оценивается количество околоплодных вод, расположение и структура плаценты, длина шейки матки и др.
После проведения УЗИ на данных сроках беременности большинство вопросов пренатальной диагностики считаются закрытыми.
Надеемся, что эта информация поможет Вам лучше понять важность и необходимость скрининга в первом и втором триместрах беременности. В нашей клинике у Вас есть уникальная возможность пройти качественное обследование и получить максимально объективные данные о состоянии Вашего плода.
Перинатальные и отдаленные исходы у детей с синдромом задержки роста плода
В. Е. Радзинский, А. А. Оразмурадов, Е. А. Девятова
Кафедра акушерства и гинекологии с курсом перинатологии Российского Университета Дружбы Народов
ул. Миклухо – Маклая, 8, Медицинский факультет, 117198, Москва, Россия
Т. В. Златовратская, Н. М. Старцева
ГБУЗ «Городская клиническая больница № 29 им. Н.Э. Баумана» ДЗМ
Госпитальная площадь, д. 2, 111020 Москва, Россия
Актуальность: в статье представлен широкий обзор литературы по проблеме хронической плацентарной недостаточности (ПН), и освещены взгляды, сложившихся на рубеже XX–XXI веков. ПН остается одной из наиболее актуальных проблем современного акушерства и перинатологии, так как перинатальная заболеваемость и смертность в большой мере определяются степенью тяжести ПН, а малый вес при рождении – фактор риска повышенной заболеваемости на протяжении всей последующей жизни ребенка и формирует перинатальную заболеваемость и смертность.
Перинатальные поражения центральной нервной системы приводят к возникновению неврологических осложнений различной степени тяжести, что существенно ухудшает качество жизни таких детей.
При изучении отдаленных исходов у детей с синдромом задержки роста плода (ЗРП) в анамнезе обращает на себя внимание не только большой удельный вес неврологических осложнений, но и высокая частота болезней органов дыхания и болезней крови.
Хроническая ПН остаётся ключевой проблемой акушерства, неонатологии, патологии анте- и перинатального периодов, поскольку функциональная недостаточность плаценты приводит к угрозе прерывания беременности, гипоксии, отставанию роста и развития плода, либо к его гибели ( Савельева Г. М., 1991; Бунин А. Т., 1993; Башмакова Н. В. и др., 1996; Макаров И. О., 1998; Радзинский В. Е., Милованов А. П. и др., 2004). Плацентарная недостаточность – это клинический синдром, отражающий патологическое состояние материнской (маточно – плацентарной) и плодной (плацентарно – плодной) частей плаценты, приводящее к замедлению развития и роста плода (Савельева Г. М. и др., 1991). Милованов А. П., (1999) предложил определение ПН: это клинико – морфологический симптомокомплекс, возникающий как результат сочетанной реакции плода и плаценты на различные нарушения состояния материнского организма. Клинически обоснована терминология и классификация ПН предложенная Радзинским В. Е. (1983, 2001): это поликаузальный синдром, возникающий как результат сочетанной реакции плода и плаценты на различные изменения в материнском организме, характеризующийся нарушением молекулярных, клеточных, тканевых и органных адаптационно – гомеостатических реакций фетоплацентарной системы и реализующийся в компенсированной, субкомпенсированной и декомпенсированной формах. Частота плацентарной недостаточности составляет 17 – 26%, не имеет тенденции к снижению и обусловливает до 47% перинатальных потерь (Колгушкина Т. Н., 2004). По данным Барашнева Ю. И. и др. (1997), частота ее колеблется от 3 – 4 % до 45 %, перинатальная заболеваемость достигает 700 %о, а смертность 24,2 – 177,4%о. По данным других исследователей, ПН составляет более 20% в структуре причин перинатальной смертности (Мурашко Л.Е., Бадоева Ф.С., Асымбекова Г.У., Павлович С.В., 1997).
К основным звеньям многогранного патогенеза ПН относят нарушения маточно – плацентарного и плодово – плацентарного кровотока, метаболизма, синтетической функции и состояния клеточных мембран плаценты, изменения иммунного статуса плода. Патология маточно – плацентарного кровообращения в свою очередь характеризуется тремя важнейшими моментами: нарушением притока крови в межворсинчатое пространство, затруднением оттока из него и локальными изменениями реологических и коагуляционных свойств крови.
Функциональная недостаточность плаценты оказывает прямое отрицательное воздействие на развитие плода и новорожденного, что проявляется характерной клинической симптоматикой, в частности синдромом ЗРП, который занимает важное место в структуре перинатальной смертности и оказывает отрицательное влияние на последующее развитие ребенка. (Борзова Н. Ю., Гагаева Ю. В. и др., 2004). Синдром ЗРП – одно из наиболее часто встречающихся состояний новорожденного (Афанасьева Н. В., Игнатко И. В., 2003). В акушерской практике, по данным Медведева Н. В., Юдиной Е. В. (1998), данная патология встречается в 5 – 31 % случаев.
Учитывая важность своевременной профилактики и диагностики ПН, необходима адекватная оценка степени риска ее развития. По данным Сидельниковой В. М. (2002), хроническая ПН наблюдается у каждой третьей женщины из группы высокого перинатального риска. Легко оцениваемым фактором риска является возраст матери до 18 и старше 35 лет. По данным Стрижакова А. Н. (2003), у 26 – 30 % беременных в возрасте до 20 лет выявляются признаки ПН, что создает угрозу развития ЗРП у данной группы беременных. При наличии экстрагенитальной патологии риск развития ПН составляет 24 – 45%. Важная роль в формировании ПН отведена заболеваниям сердечно – сосудистой и эндокринной систем, а болезни почек составляют до 9,5% среди факторов риска ее развития. Среди эндокринных заболеваний особого внимания заслуживает сахарный диабет. Популяционная частота сахарного диабета у беременных составляет 0,2 – 3,0%, однако среди беременных с ПН он встречается в 2 – 3 раза чаще. При этом частота гипотрофии плода составляет 35,5%, а отставание в росте плода, по данным ряда исследователей, отмечается уже в начале II триместра гестации.
В последние годы все больше внимания уделяется изучению внутриутробного инфицирования как этиологического фактора развития ПН. Так, при хронических неспецифических заболеваниях легких отмечается увеличение процента рождения детей с низкими весо – ростовыми показателями. При этом у 30,8% детей выявляются признаки внутриутробной инфекции. У беременных с ПН на фоне генитальных инфекций в 1,6 раза чаще наблюдается ЗРП, при этом в 2 раза чаще возникает ее симметричная форма.
Среди осложнений беременности, наиболее часто приводящих к развитию ПН, первое место занимает гестоз. При наличии ПН на фоне гестоза, частота ЗРП составляет 22,7 – 44%. Частота клинических проявлений ПН прямо пропорциональна тяжести гестоза и составляет при легкой, среднетяжелой и тяжелой степени 16, 22 и 62% для ЗРП соответственно (Федорова М. В. и др., 1997).
Существенную роль в патогенезе плацентарной недостаточности играет неполноценное питание беременных, прежде всего недостаток белков, жиров, витаминов. При отсутствии рациональной диеты частота ЗРП может достигать 16,2%.
Из данных акушерского анамнеза статистически достоверную связь с развитием плацентарной недостаточности имеют перенесенные ранее самопроизвольные аборты, антенатальная гибель плода и рождение детей с низкой массой тела.
Ранняя диагностика ПН и профилактическое лечение беременных групп высокого риска по развитию синдрома ЗРП позволяет предупредить декомпенсированные формы маточно – плацентарной дисфункции и прогнозировать благополучный исход беременности с высокой степенью вероятности (Афанасьева Н. В., Стрижаков А. П., 2004).
Выявление синдрома ЗРП и определение его формы является основной задачей эхографии при диагностике хронической ПН. ЗРП диагностируется при выявлении параметров фетометрии ниже 10 – го перцентиля или более чем на 2 стандартных отклонения ниже среднего значения для данного гестационного возраста. Некоторые исследователи допускают прогнозирование развития ЗРП по отклонению фетометрических показателей ниже 25 – го перцентиля (Федорова и др., 2001). Однако в этом случае вероятность подтверждения прогноза составляет только 70%.
При ультразвуковой (УЗИ) диагностике ЗРП, говоря о I степени тяжести, наблюдается отставание фетометрических параметров до 2 недель (34,2%), при II степени – в пределах 2 – 4 недель (56,6%), при III степени – более 4 недель (9,2%) от должных значений для данного гестационного срока. Клинически принято выделять симметричную, ассиметричную и смешанную формы данного синдрома. Ассиметричная форма встречается чаще симметричной, но развивается обычно позднее (в 30 – 34 недели гестации). Смешанная форма синдрома ЗРП характеризуется непропорциональным отставанием всех фетометрических показателей при наиболее выраженном отставании размеров живота и считается наиболее неблагоприятной. При обнаружении несоответствия одного или нескольких показателей показано произведение расширенной фетометрии. В то же время отставание фетометрических параметров не всегда позволяет уверенно диагностировать ЗРП. До настоящего времени остаются недостаточно разработанными вопросы тактики ведения беременных с симметричным отставанием размеров плода от срока гестации при отсутствии остальных проявлений ПН, поскольку имеются данные о том, что в этих случаях (генетически детерминированная малая масса, плод «small for date») перинатальные исходы не отличаются от таковых в популяции.
Экстрагенитальные заболевания матери в сочетании с акушерской патологией, реализуясь посредством различных патогенетических механизмов, приводят к единому результату – прогрессирующей ЗРП (Радзинский В. Е., Милованов А. П. и др.,2004). Многолетние наблюдения за развитием детей, родившихся у пациенток с диагностированной ПН, позволили сделать вывод, что акушерская патология обусловливает значительное увеличение перинатальной заболеваемости и является субстратом для возникновения многочисленных патологических изменений в организме ребенка, которые в течение первых лет жизни становятся основной причиной нарушения его физического, умственного развития и повышенной заболеваемости.
По данным Л. О. Бадаляна и др. (1983), более 60% всех заболеваний центральной нервной системы детского возраста связано с перинатальной гипоксией плода. Многие авторы (Paneth N., Stark R., 1983; Seidman D.S., Paz G., 1991 и др.) отмечают, что более половины энцефалопатий обусловлено не острой гипоксией при родах, а длительной, хронической гипоксией плода и новорожденного, нередко связанной с внутриутробной инфекцией. Дети, перенесшие острую гипоксию в родах, чаще имеют совершенно нормальное развитие в дальнейшем (Самсыгина Г.А. и др., 1995).
По данным А. Н. Стрижова и др. (1995), при декомпенсированной форме ПН перинатальная смертность достигает 50%, а заболеваемость новорожденных 100%. ЗРП формирует перинатальную заболеваемость и смертность, а также является фактором риска повышения заболеваемости на протяжении предстоящей жизни. Кроме того, у детей, родившихся маловесными, сокращается средняя продолжительность предстоящей жизни, в сравнении с детьми, не имевшими дефицита веса при рождении (Lithell., 1999). Частота ЗРП по данным многих авторов колеблется от 3% до 22% у доношенных, от 18 до 24% у недоношенных, и не имеет тенденции к снижению (Белоусова В. Б., 1988, Ахмадеева Н. Э. и др., 1989; Радзинский В. Е. и др., 1990).
В структуре перинатальной смертности 23% – 25% занимает ЗРП и связанные с этой патологией осложнения. У 32,5% детей, родившихся с гипотрофией, в возрасте одного года сохраняются отклонения в физическом развитии.
Перинатальные поражения центральной нервной системы занимают одно из важнейших мест в структуре перинатальной заболеваемости по частоте и значимости и составляют 60 – 80% всех заболеваний нервной системы детского возраста ( Студеникин М. Я., Халлман Н., 1984; Яцык Г. В., 1989; Бадалян Л. О., 1989, Барашнев Ю. И., 1993). Перинатальные повреждения головного мозга характеризуются многофакторным генезом, но гипоксия является центральным патогенетическим фактором, приводящим к различным структурным и функциональным повреждениям и порокам развития центральной нервной системы. Характер церебральных изменений зависит от гестационного возраста в период развития патологии, времени действия гипоксии и её интенсивности (Студеникин М.Я. и др., 1993).
Серьёзные неврологические осложнения: такие как детский церебральный паралич, ретинопатиия недоношенных, глухота, грубая задержка темпов психомоторного развития, приводят к неполноценному развитию и снижению качества жизни у таких детей. Неврологические осложнения наиболее распространены у недоношенных детей. Частота неврологических нарушений легкой степени у этих детей составляет 10% – 45 %, тяжелой степени 7% – 9 % (Савельева Г. М., Федорова М. В., Клименко П. А., Сичинава Л. Г., 1991).
Снижение уровня смертности в последние годы сопровождается повышением процента инвалидизации (Cano A., Fons F., Brines J., 2001). Ведущее место среди причин детской инвалидности занимают болезни нервной системы, врождённая и наследственная патология, состояния перинатального периода (Емельянова А. С. 1999).
При снижении летальности новорожденных с массой тела при рождении 1500 г и менее до 49—57%, число выживших детей достигает 43—51%. Однако из выживших детей здоровыми оказываются не более 10—25%. Причем количество детей с тяжелыми психоневрологическими расстройствами может достигать 12—19% (Michelsson K., Lindahl E., Parre M.,1984; Lloyd B. W., 1984; Vohr B.R., Coll C., 1985).
Риск развития психоневрологических расстройств разной степени тяжести у новорожденных с очень низкой массой тела при рождении в 3 раза выше, чем у детей с нормальной массой тела при рождении. Для новорожденных с экстремально низкой массой тела (ЭНМТ) при рождении 1000 г и менее перинатальная смертность может достигать 64—85%, а число выживших детей — не более 15—36%. У выживших детей тяжелые инвалидизирующие расстройства могут превышать 28%, а менее грубые психоневрологические нарушения до 44%. Причем, из выживших детей здоровые составляют не более 8—15% ( HirataT., Epcar J.R., Walsh A.,1983; Fleischman A.R.,1986). При сравнении перинатальных исходов в группах новорожденных с ЭНМТ, 1001 – 1500, 1501 – 2000 и 2001 – 2500 гр. Шалина Р. И. и др., 1999, пришли к заключению, что абдоминальное родоразрешение не позволяет полностью избежать развития мозговых дисфункций, но тем не менее способствует уменьшению числа детей с умеренно выраженными и тяжелыми нарушениями центральной нервной системы.
Изучение отдаленного катамнеза у детей группы высокого инфекционного риска от матерей с внутриутробным инфицированием также представляет большой интерес, поскольку имеются сведения, что у таких детей отмечаются симптомы поражения центральной нервной системы: отставание в психомоторном развитии, прогрессирующие нарушения зрения и слуха (Веденеева Г. Н. и др., 1997; Тареева Т.Г. и др., 1999; Hess D.,1993; Couvreus J. Et al., 1996).
По данным Волгиной С. Я. (2000), в структуре заболеваемости недоношенных детей с ЗРП, в различные периоды жизни выявлялись свои особенности. Доминирующее положение занимают болезни органов дыхания. У детей раннего возраста второе и третье места занимали болезни нервной системы и крови. К 7 годам жизни у значительного количества детей, родившихся с признаками ЗРП, сохраняются изменения неврологического статуса. Развитие этой патологии соотносится со степенью отставания фетометрических показателей и выраженностью признаков внутриутробного страдания плода.
Вывод: состояние здоровья маловесных детей в перинатальном и отдаленном периоде не позволяет приуменьшить значимость проблемы плацентарной недостаточности в настоящее время, а лишь еще раз указывает на необходимость ее детального изучения, своевременной профилактики и лечения.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.