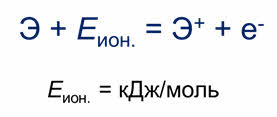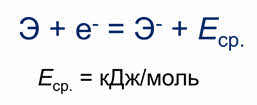Что значит ослабление металлических свойств
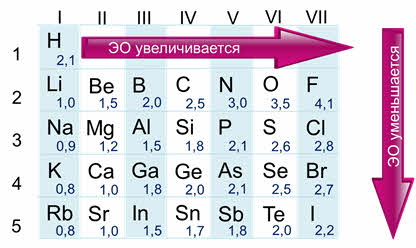
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Изменение свойств элементов и их соединений в зависимости от положения в ПСХЭ Д. И. Менделеева
Урок 6. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Изменение свойств элементов и их соединений в зависимости от положения в ПСХЭ Д. И. Менделеева»
Электронная конфигурация атомов химических элементов изменяется периодически с ростом зарядов их ядер, поэтому и все свойства, которые определяются электронным строением, закономерно изменяются по периодам и группам. К этим свойствам относятся: атомные и ионные радиусы, электроотрицательность и другие.
Условно форму атома или иона можно представить шарообразной, поэтому количественной характеристикой их размера служит радиус.
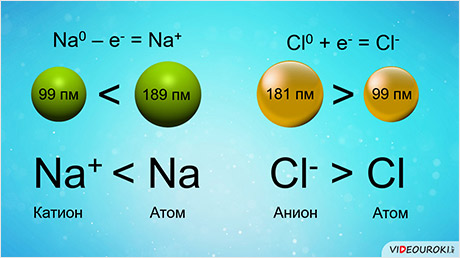
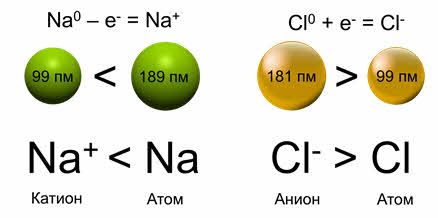
Различают атомные и ионные радиусы. Радиусы положительно заряженных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так они отдают электроны, чтобы превратиться в катионы, а радиусы отрицательно заряженных ионов (анионов) больше радиусов атомов, потому что они образовались путём присоединения электронов к атомам.
Например, радиус атома натрия 189 пикометров, а иона натрия – 99 пикометров, радиус атома хлора 99 пикометров, а иона хлора – 181 пикометр.
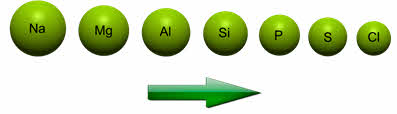
В периодах с увеличением зарядов ядер атомов, электроны сильнее притягиваются к ядру, что приводит к уменьшению радиусов атомов.
Например, у элементов третьего периода атомные радиусы уменьшаются от натрия к хлору.
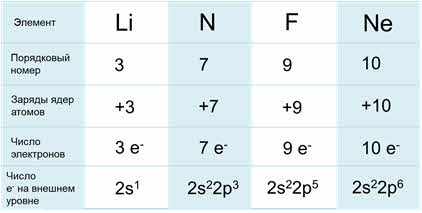
Сравним строение атомов элементов, находящихся во втором периоде. Порядковый номер лития – три, азота – семь, фтора – девять, а неона – десять. Заряды ядер данных атомов, соответственно равны: у лития – плюс три, у азота – плюс семь, у фтора – плюс девять, у неона – плюс десять. Число электронов для каждого атома химического элемента равно значению заряда ядра, порядковому номеру и числу протонов в ядре. Значит у лития три электрона, у азота – семь, у фтора – девять, у неона – восемь.
Строение атомов элементов второго периода
А чтобы определить, сколько электронов находится на внешнем уровне, необходимо посмотреть в какой группе Периодической системы находится данный химический элемент. Например, у лития на внешнем слое находится один электрон, так как он располагается в первой А группе. У азота на внешнем слое находится пять электронов, у фтора – семь электронов и у неона – десять электронов.
К концу второго периода количество электронов на внешнем энергетическом уровне возрастает.
Важно также знать, что число энергетических уровней атомов химических элементов равно номеру периода, в котором они находятся. У лития, азота, фтора и неона число энергетических уровней равно двум.
Атомный радиус к концу периода уменьшается, так как происходит взаимопритяжение ядра атома и электронов внешнего энергетического уровня.
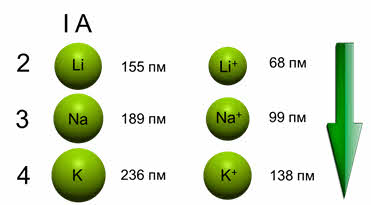
В группах сверху вниз увеличивается число электронных слоёв, поэтому увеличиваются и радиусы атомов, и радиусы ионов. Например, в первой A группе идёт увеличения радиусов атомов: у лития – 155 пикометров, у натрия – 189 пикометров, у калия – 236 пикометров, радиус иона лития 68 пикометров, иона натрия – 99 пикометров, ионов калия – 138 пикометров.
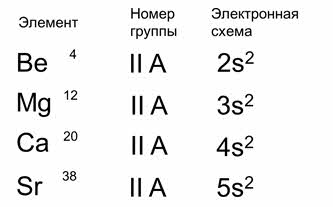
Рассмотрим изменение свойств для элементов второй группы главной подгруппы. Порядковый номер бериллия – четыре, у кальция – двадцать и у стронция – тридцать восемь. Сверху вниз по группе заряды ядер атомов увеличиваются. Количество электронов на внешнем энергетическом уровне остаётся неизменны, так как у всех химических элементов второй группы главной подгруппы на внешнем слое находится два электрона. К концу второй группы главной подгруппы количество энергетических уровней у атомов данных химических элементов постепенно возрастает, соответственно возрастает и атомный радиус.
Способность атомов отдавать электроны при увеличении атомного радиуса усиливается, а способность принимать электроны ослабевает. Значит, сверху вниз по группе металлические свойства увеличиваются.
Проявление металлических и неметаллических свойств связано со способностью присоединять или отдавать электроны.
Способности отдавать электроны количественно характеризуется энергией ионизации.
Энергия ионизации – это минимальная энергия, необходимая для отрыва от атома наиболее слабо связанного с ним электрона. Энергия ионизации выражается в килоджоулях на моль.
Наименьшую энергию ионизации имеют щелочные металлы, наибольшую – элементы седьмой A группы. Поэтому в периодах слева направо энергия ионизации увеличивается, так как увеличиваются заряды ядер и уменьшаются радиусы атомов.
В группах А сверху вниз энергия ионизации уменьшается, так как увеличивается расстояние между электронами внешнего слоя и ядром атома.
Вы знаете, что при отдаче электрона атом превращается в катион, поэтому энергия ионизации характеризует проявление металличности.
Для неметаллов, наоборот, характерна способность присоединять электроны, поэтому количественной характеристикой неметалличности является энергия сродства к электрону.
Энергия сродства к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому.
Следовательно, чем больше энергия сродства к электрону, тем легче атом присоединяет электрон. Эта величина также выражается в килоджоулях на моль.
Наибольшую энергию сродства к электрону имеют элементы седьмой A группы. Поэтому в периодах слева направо энергия сродства к электрону увеличивается, а в группах сверху вниз уменьшается.
Разберём, как же изменяется электроотрицательность по периодам и группам.
Электроотрицательность – это условная величина, характеризующая способность атомов в химических соединениях притягивать к себе электроны от других атомов.
Величина электроотрицательности зависит от энергии ионизации и от энергии сродства к электрону.
Для оценки этой способности принята условная шкала относительных электроотрицательностей. Здесь видно, что самым электроотрицательным является фтор, а наименее электроотрицательным рубидий.
Шкала электроотрицательности (Л. Полинг)
Как правило, у элементов А групп в периоде слева направо электроотрицательность возрастает, а в группах сверху вниз уменьшается. По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы имеют большое значение электроотрицательности (больше двух), а у металлов это значение гораздо меньше (меньше двух). Элементы, у которых значение электроотрицательности близко к двум являются полуметаллами. Например, бор, кремний, германий, мышьяк, сурьма и тэллур.
Чтобы понять, в чем причина периодичности, сравним атомы элементов второй А группы. Порядковый номер бериллия четыре, номер двенадцать – у магния, номер двадцать – у кальция, номер тридцать восемь – у стронция.
Во-первых, все эти элементы располагаются во второй группе главной подгруппе, имеют одинаковое строение внешнего энергетического уровня. Так, на внешнем энергетическом уровне у них по два электрона. Но электроны, которые находятся на внешнем энергетическом уровне расположены на разном удалении от их ядер. Поэтому активность у них разная, а свойства сходны. Это и есть причина периодичности – изменение строения внешнего и предвнешнего энергетических уровней и повторение числа электронов внешнего энергетического уровня.
А теперь, рассмотрим, как периодичность химических элементов сказывается на образуемых ими соединениях: оксидах и гидроксидах.
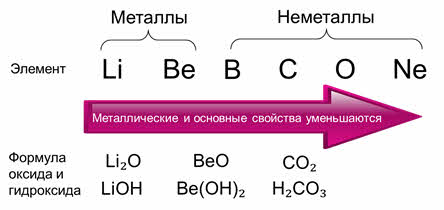
В качестве примера, рассмотрим второй период и проследим, как изменяются «металличность и неметалличность» по периоду. Во втором периоде располагаются: литий, бериллий, бор, углерод, кислород и неон.
Литий и бериллий – это металлы, а бор, углерод, кислород и неон – это неметаллы. Значит, металлические свойства по периоду слева направо уменьшаются, а неметаллические усиливаются.
Литию соответствует оксид лития, который проявляет основные свойства, бериллию соответствует оксид бериллия, который проявляет амфотэрные свойства, углероду соответствует оксид углерода четыре, который проявляет кислотные свойства. Аналогично и гидроксиды: гидроксид лития проявляет основные свойства, гидроксид бериллия – амфотэрные свойства, а гидроксид углерода – угольная кислота – проявляет кислотные свойства.
Значит, по периоду кислотные свойства увеличиваются, а основные уменьшаются слева направо.
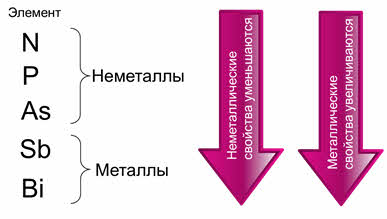
Рассмотрим, как изменяются «металличность и неметалличность» на примере пятой А группы. К элементам этой группы относятяся: азот, фосфор, мышьяк, сурьма и висмут.
Азот, фосфор и мышьяк являются неметаллами, а сурьма и висмут – металлами. Сурьма и висмут считаются полуметаллами, так как находятся на границе с неметаллами. Значит, неметаллические свойства атомов химических элементов уменьшаются сверху вниз по группе, а металлические – увеличиваются.
Таким образом, в периоде при переходе от одного элемента к другому происходит ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек и поэтому проявляют схожие химические свойства.
Характер изменения свойств элементов и их соединений повторяется во всех периодах (кроме первого), поэтому такое изменение свойств называется периодическим.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.